高产γ-氨基丁酸植物乳杆菌的筛选、鉴定及益生特性
吴剑,南博,李侠,曹勇,王玉华,4,5*,王秀娟*
(1.吉林国际旅行卫生保健中心(长春海关口岸门诊部),吉林 长春 130062;2.吉林农业大学 食品科学与工程学院,吉林 长春 130118;3.吉林农业大学 食品生物制造创新中心,吉林 长春 130118;4.吉林农业大学 大豆工业与技术国家加工实验室,吉林 长春 130118;5.吉林农业大学 国家小麦和玉米深加工工程研究中心,吉林 长春 130118)
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种天然的、自身不能合成蛋白的氨基酸,由于其独特的生理功能,如改善睡眠、抗抑郁症[1]、医治癫痫、降血压[2-4]、降血糖、激活和增强记忆力、缓解和治疗孕妇自主神经障碍等[5],还可作为治疗尿毒症的辅助药物[6],并具有间接促进受孕等功能[7],近年来GABA 的发展和使用受到越来越多的关注[8-9]。
获取GABA 的传统生产途径一般分为化学法和生物合成法,化学法由于对环境的污染较大,生产的GABA 难以完全提纯,副产物对人体的危害大不能应用于食品医药行业中。生物合成法更常用[10],主要包括植物富集法和微生物发酵法。植物富集法比化学法的反应条件温和且基本不会对环境造成危害。植物富集法的主要原理是高等植物组织中的内源酶催化谷氨酸钠的脱羧和多胺的降解[11],这两条合成和转化途径生成GABA,具有反应慢、不稳定及产率低等缺点,因此不常用于GABA 的生产。微生物发酵法具有反应迅速、产率较高的优点,大量微生物都能通过发酵生产GABA[12]。GABA 在生物体中一般以谷氨酸通过谷氨酸脱羧酶脱羧反应产生,选择合适的产GABA 的生物载体是大量获得GABA 的前提条件[13]。在早期的研究中,微生物以大肠杆菌为主,通过谷氨酸钠的脱羧反应生产GABA,虽然大肠杆菌有很强的谷氨酸脱羧酶的能力,但是将所得产物应用于食品中存在许多局限性。乳酸菌是一种国际公认的食品级食用细菌,可以提高食品的品质和营养,并赋予食品特殊的风味[14],具有重要生物学功能(如提高免疫力、调节肠道菌群及降低胆固醇等[15])。目前由乳酸菌发酵的GABA,发酵条件简单,可以直接用作食品添加剂[16]或开发乳酸菌发酵酸奶。有研究[17]从传统的发酵泡菜中分离出67 种乳酸菌,通过高效液相色谱分析有27 株菌株产GABA,在37 ℃培养48 h 后,其中一株GABA 产量达到3.92 g/L。利用乳酸菌发酵产GABA 安全快捷且产量相对较高,可以直接应用到食品中。由此可见利用乳酸菌生产GABA 技术日渐成熟。筛选出合适的乳酸菌菌株和发酵条件以大量获取GABA 是利用生物法获取GABA领域的研究热点之一。
植物乳杆菌作为乳酸菌系统的一个分支,具有益生特性,适应环境能力较强,能够定植于人体肠道中,发挥作用。本研究从东北酸菜和韩国泡菜中筛选获得高产GABA 的植物乳杆菌菌株,通过16S rDNA 对其进行测序鉴定乳酸菌种类,并对该菌株的益生特性进行深入研究,旨在为其后续功能性食品的研究开发提供参考。
1 材料与方法
1.1 材料
自然发酵东北酸菜、韩国泡菜:市售;人工胃肠液、GABA 标准品:北京奥博星生物技术有限公司;冰醋酸:江苏奥福生物科技有限公司;DNA 提取试剂盒、蛋白胨、酵母提取物、葡萄糖:北京鼎国生物技术有限责任公司。所用试剂均为分析纯。
1.2 仪器与设备
PCR 仪(7500fast):美国Applied Biosystems 公司;酶标仪(TECAN-F50):瑞士TECAN 公司;电泳仪(DYY-6C):北京六一仪器厂;高速冷冻离心机(JXN-30/26):上海BBI 公司;-80 ℃冰箱(MDF-U3386S):日本SANYO 电器集团。
1.3 方法
1.3.1 试剂的配制
纸层析展开剂:正丁醇∶冰醋酸∶水(体积比)=2∶1∶1,加入0.8% 显色剂茚三酮。层析洗脱剂:75% 乙醇∶0.1% 硫酸铜(体积比)=38∶2。硼酸缓冲溶液:称取1.236 8 g 硼酸和0.292 5 g NaCl,溶解定容至100 mL制成A 液,溶解1.907 0 g 硼酸钠并定容至100 mL 制成B 液;将A 液与B 液混合(体积比1∶9)配制成pH9.0 的硼酸缓冲液,4 ℃避光保存,现用现配。5 mg/mL GABA标准浓储液溶液:适量去离子水溶解500 mg GABA 粉末并定容至100 mL,4 ℃保存。
MRS 培养基:蛋白胨10 g,牛肉膏10 g,酵母提取物5 g,磷酸氢二钾2 g,柠檬酸二铵2 g,乙酸钠5 g,葡萄糖20 g,吐温80 1 mL,硫酸镁(7H2O)0.58 g,硫酸锰(4H2O)0.25 g,蒸馏水1 000 mL,pH6.2,121 ℃灭菌15 min。固体培养基加入琼脂粉15 g。
胰蛋白胨酵母膏葡萄糖培养基(tryptone yeast extract and glucose medium,TYG):胰蛋白胨10 g,酵母提取物5 g,葡萄糖20 g,丁二酸钠5 g,1 000 mL 蒸馏水,加入L-谷氨酸(1 mg/mL)20 mL,pH6.5,115 ℃灭菌25 min。
溶菌肉汤培养基(lysogeny broth medium,LB):胰蛋白胨10 g,酵母粉5 g,NaCl 10 g,琼脂粉15 g,蒸馏水1 000 mL,pH6.5,121 ℃灭菌20 min。
1.3.2 产GABA 乳酸菌菌株的筛选
菌株初筛:取自然发酵的东北酸菜及韩国泡菜汁水稀释10 倍,将稀释液涂布于固体MRS 培养基上,37 ℃恒温培养24 h,选取成型单菌落于固体平板上划线分离,反复进行纯化培养,最终选取革兰氏阳性菌株接种于MRS 液体培养基中培养24 h(2%,体积分数),3 代连续培养,得到有活力的菌株备用。
菌株复筛:将初筛得到的菌株接种于TYG 选择培养基中(2%,体积分数),37 ℃恒温培养24 h,连续培养2 代,备用。
1.3.3 发酵液中GABA 的定性分析
发酵液中GABA 的定性分析参照熊京京等[18]方法稍作改动,取1µL 发酵上清液,在薄层层析硅胶板底部1 cm 处间隔0.7 cm 点样,GABA 标准液作为对照。层析缸中放入0.8 cm 的展开剂,将硅胶板平稳放入,密封,直至展开剂扩展至距离硅胶板上沿1 cm 处时,取出晾干,放入烘箱85 ℃显色20 min,初筛产GABA的菌株。
1.3.4 发酵液中GABA 的定量分析
将GABA 标准浓储液依次稀释配制成0.25、0.50、0.75、1.00、1.25、1.50 mg/mL 的GABA 标准溶液。具塞试管中分别加入0.2 mL 不同浓度的标准液和处理后的发酵上清液,加入重蒸苯酚1.0 mL(60%)和硼酸盐缓冲液0.4 mL(pH9.0),混匀后再加入NaClO 溶液1.0 mL(10%),充分振荡混匀。静置5 min 后,沸水中加热10 min,冰浴10 min,溶液变为蓝绿色后,加入2.0 mL 60% 乙醇溶液,于645 nm 波长处测定吸光值。以GABA 浓度为横坐标,吸光值为纵坐标,绘制标准曲线,计算发酵液中GABA 的含量。
1.3.5 产GABA 菌株的鉴定及形态观察
菌株的鉴定:GABA 菌株DNA 的提取参照DNA提取试剂盒说明进行,利用基因通用引物27f 和1492r扩增,通过聚合酶链式反应(polymerase chain reaction,PCR)体系标准化操作后,产物经0.75%琼脂糖凝胶电泳并通过凝胶成像装置观察,进行16S rRNA 基因序列测序。使用美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)的Gen-Bank 数据库对各菌株序列分析比对,对同源性较高的模式菌株的16S rDNA 基因序列采用MEGA7.0 构建系统发育树。
菌株的形态观察:取分离纯化后的菌液1 mL 涂于MRS 培养基上,37 ℃培养48 h 后记录菌落形态,取菌液革兰氏染色,在显微镜下观察并拍照。
1.3.6 菌株的生长曲线及产酸曲线绘制
在MRS 液体培养基中接种2% 活化好的菌株,37 ℃培养,每2 h 测定OD600nm值和pH 值,绘制生长曲线及产酸曲线。
1.3.7 菌株发酵上清液对常见病原菌的抑菌试验
将实验室保藏的金黄色葡萄球菌、沙门氏菌和大肠杆菌分别活化,再稀释至105CFU/mL,取0.1 mL 涂布于LB 培养基上,将无菌的滤纸片放于平板中,做3个平行组。分别吸取0.3 mL 活化好的菌株发酵上清液放入滤纸片上,于37 ℃培养24 h,观察并测量抑菌圈直径大小,进行3 次平行试验。
1.3.8 菌株对胆盐的耐受性
向MRS 培养基中加入牛胆盐,配制成0.2%、0.3%及0.5%的胆盐培养基,取2%活化后的菌株接种于上述胆盐养基中,于37 ℃培养24 h 后,进行稀释涂布,做3 组平行试验,计算活菌数。
1.3.9 菌株对酸度的耐受性
菌株对酸度的耐受性参照Wang 等[17]的方法稍作修改,于MRS 液体培养基中分别加入盐酸,配制成酸性培养基(pH2.0、3.0、4.0),取2% 活化后的菌株接种于酸性培养基中,于37 ℃培养24 h 后,进行稀释涂布,做3 组平行试验,计算活菌数。
1.3.10 菌株对人工胃液和人工肠液的耐受性
参照赵芳等[19]的方法稍作修改,于MRS 液体培养基中接种2% 菌株,37 ℃培养24 h 后取10 mL 菌液,5 000 r/min 离心10 min,沉淀用无菌磷酸盐缓冲溶液(phosphate buffer saline,PBS)洗涤2 次,收集菌体沉淀加入10 mL PBS 混匀。取1 mL 菌液加入9 mL 模拟人工胃液,37 ℃培养4 h 后,再从模拟人工胃液中取1 mL 菌液加入9 mL 模拟人工肠液,37 ℃培养4 h。每2 h 分别取样进行平板涂布计数,做3 组平行试验。
1.3.11 菌株对常用抗生素的敏感性
在MRS 固体培养基上均匀涂布2%菌株,用无菌镊子放置不同的药敏片,于37 ℃培养24 h,观察药敏片周围是否形成抑菌圈,并测量直径,进行3 组平行试验。药敏片为红霉素30 µg、卡那霉素30 µg、氯霉素30µg、链霉素30µg、四环素30µg。用游标卡尺测量抑菌圈大小。
1.4 统计分析
通过Excel、GraphPad Prism 6.0 和Design-Expert 12 对数据进行统计分析。试验数据以平均值±标准差表示。
2 结果与分析
2.1 高产GABA 乳酸菌菌株的筛选
薄层层析定性分析结果如图1 所示。
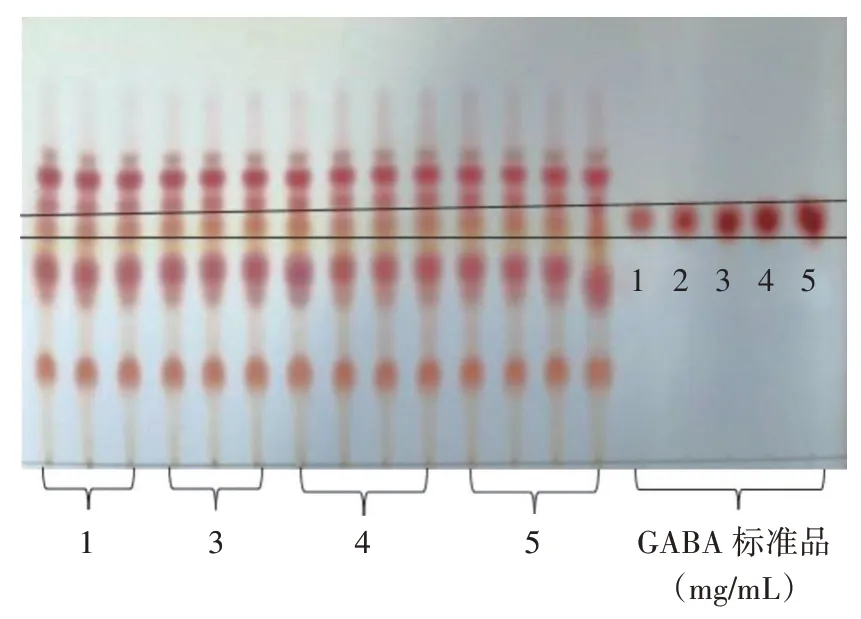
图1 菌株发酵液GABA 薄层层析色谱Fig.1 Thin-layer chromatogram of gamma-aminobutyric acid(GABA)in the strain fermentation broth
由图1 可以看出,除了菌株2,菌株1、菌株3、菌株4、菌株5 均有与GABA 标准品相同的比移值(化合物在薄层层析板上移动的距离与溶剂前端移动的距离之比),初步认为4 株菌株均产生GABA。
比色法定量分析结果如图2 所示。
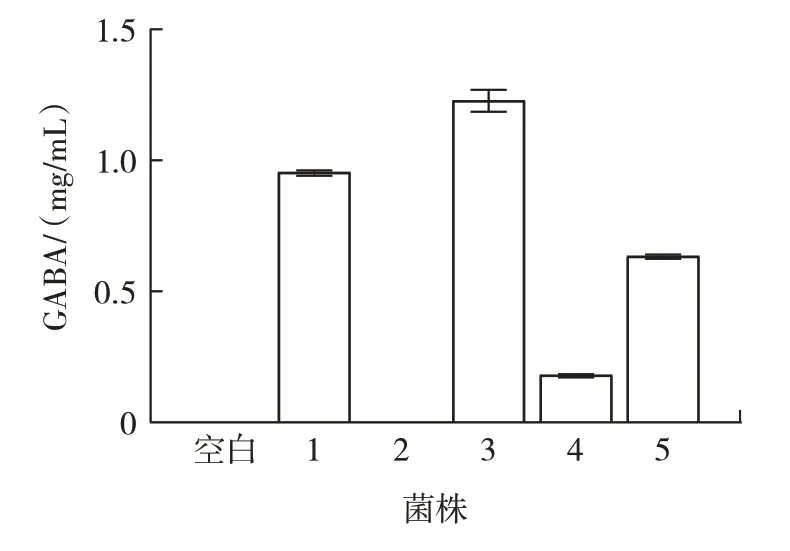
图2 5 株菌株GABA 产量对比Fig.2 Comparison of GABA production among 5 strains
由图2 可以看出,菌株2 没有产生GABA,菌株1、3、4、5 均有GABA 产生,且菌株3 的GABA 产量最高。Cataldo 等[20]从藜麦和苋菜中分离出17 株乳酸菌,30 ℃培养72 h 后,GABA 产量为16~258 mmol/L,从同一来源中筛选出来的乳酸菌的GABA 产量不同。综上,选用产GABA 能力较强的菌株3 作为后续试验的主要研究菌株。
2.2 筛选菌株16S rRNA 序列分析鉴定及形态学观察
高产GABA 的菌株3 的琼脂糖凝胶电泳如图3所示。
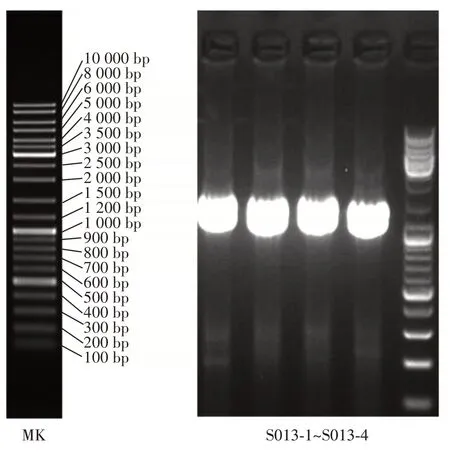
图3 筛选菌株的DNA 电泳图Fig.3 DNA electropherogram of the screened strains
由图3 可以看出,在1 400 bp 左右有明显的条带出现。进行16S rRNA 测序构建系统发育树如图4所示。

图4 植物乳杆菌Lp3 的系统发育树Fig.4 Phylogenetic tree of Lactobacillus plantarum Lp3
由图4 可以看出,该菌株的16S rRNA 与L.plantarumstrain UFLA WFC331 的同源性达到99.6%,命名为植物乳杆菌Lp3,拉丁文学名L.plantarumLp3。其菌落形态及镜检结果如图5 所示。
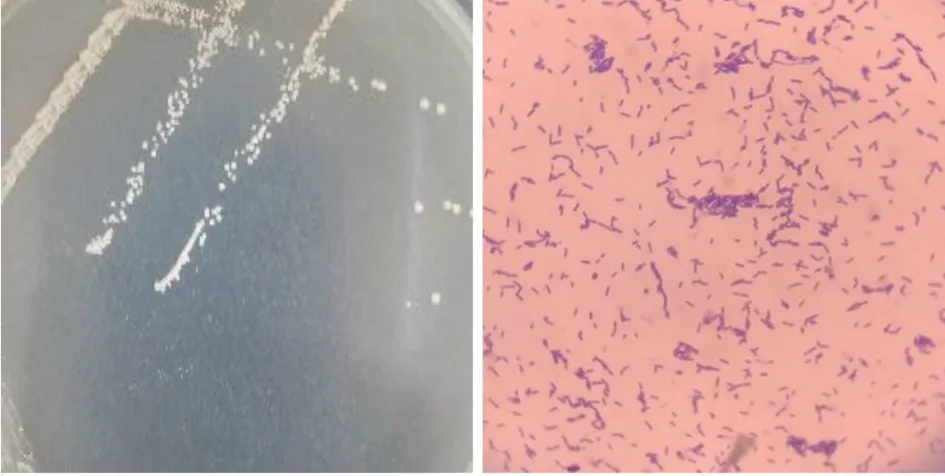
图5 植物乳杆菌Lp3 的菌落及菌体形态Fig.5 Colony and cell morphology of L.plantarum Lp3
由图5 可以看出,该菌株的菌落凸起,呈乳白色,圆形光滑,半透明,边缘整齐;菌体呈杆状,革兰氏阳性。
2.3 L.plantarum Lp3 菌株的生长曲线和产酸曲线
L.plantarumLp3 菌株的生长曲线和产酸曲线如图6 所示。
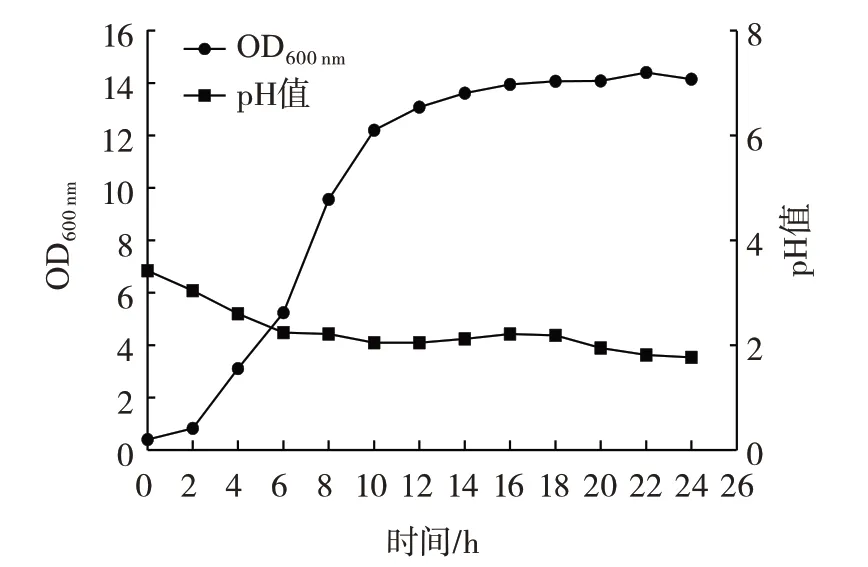
图6 植物乳杆菌Lp3 生长曲线和产酸曲线Fig.6 Growth and acid production curves of L.plantarum Lp3
由图6 可以看出,该菌株在0~2 h 生长缓慢,2~12 h 生长速率快速上升,进入对数期,因该菌株是从活化二代后的菌液中分离出来的,所以菌种活力较强,代谢快;12 h 后生长逐渐放缓进入平稳期,在22 h 时,菌株活力最高。由产酸曲线可知L.plantarumLp3 菌株在接种0~6 h 发酵液pH 值下降迅速,快速产酸,6 h 后pH 值缓慢降低。说明该菌株有良好的生长和产酸能力。马莉等[21]研究结果与本研究L.plantarumLp3 菌株的生长曲线和产酸曲线的趋势一致。
2.4 L.plantarum Lp3 菌株对常见病原菌的抑制
分别取L.plantarumLp3 菌株发酵上清液及pH 值调至7.0 的上清液进行抑菌试验,对3 种常见病原菌的抑制作用如表1 所示。
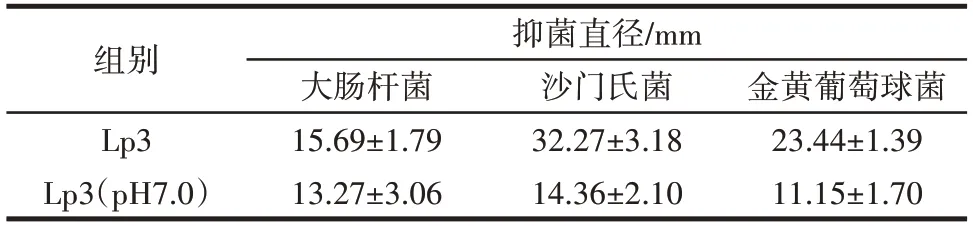
表1 植物乳杆菌Lp3 的抑菌效果Table 1 Antibacterial effects of L.plantarum Lp3
由表1 可知,该菌株对3 种致病菌均有比较好的抑制效果,对大肠杆菌、沙门氏菌和金黄色葡萄球菌的抑菌圈直径分别为15.69、32.27、23.44 mm,对沙门氏菌的抑制作用最强。当发酵上清液的pH 值调至7.0时,L.plantarumLp3 抑菌能力均降低,尤其是沙门氏菌和金黄色葡萄球菌。Halimi 等[22]研究发现,发酵乳杆菌的低pH 值培养上清液对金葡菌及铜绿假单胞菌均有较强的抑菌能力。综上,L.plantarumLp3 菌株具有较强的抑菌能力。
2.5 L.plantarum Lp3 菌株的耐受性
益生菌的重要特性之一是耐受能力,肠道环境胆盐浓度较高,因此L.plantarum菌株的耐胆盐能力显得尤为重要。植物乳杆菌Lp3 体外耐胆盐能力如图7所示。
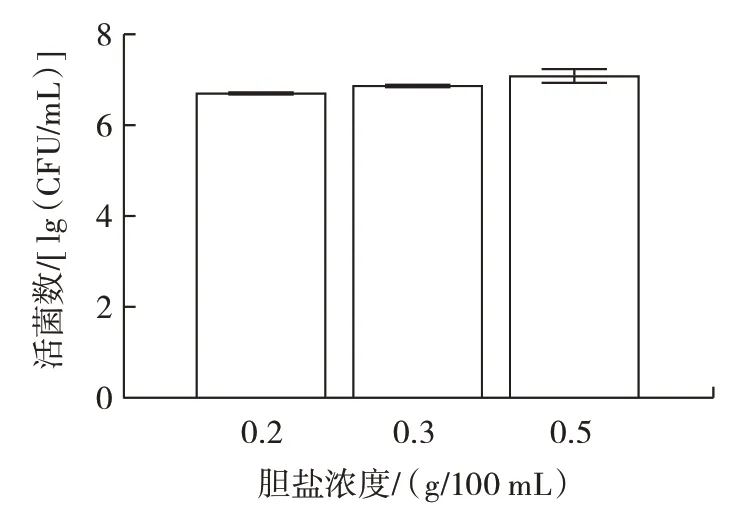
图7 植物乳杆菌Lp3 体外耐胆盐能力Fig.7 Bile salt tolerance of L.plantarum Lp3 in vitro
由图7 可以看出,当胆盐浓度为0.2、0.3 g/100 mL和0.5 g/100 mL 时,培养24 h 后L.plantarumLp3 菌株的活菌数可达6.84、6.96、7.12 lg(CFU/mL),且活菌数符合乳酸菌发挥作用的最低值,表明L.plantarumLp3菌株耐胆盐能力较强。作为革兰氏阳性菌,植物乳杆菌具有较厚的细胞壁,可能是该菌株对胆盐环境耐受的原因之一。王祎然等[23]从酸汤中筛选出的6 株乳酸菌在相同胆盐浓度下培养3 h 后存活率均超过88%。肠道由于胃酸的存在酸性较高,因此L.plantarum菌株的耐酸能力也很重要。L.plantarumLp3 菌株的耐酸能力如图8 所示。
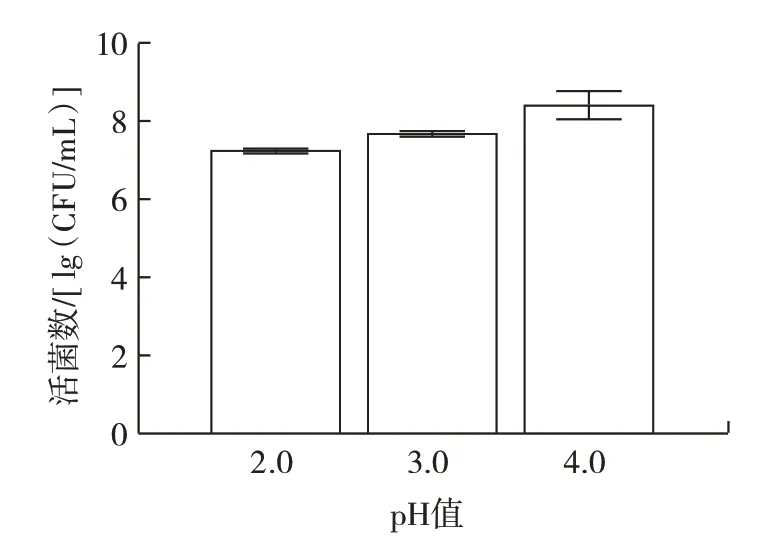
图8 植物乳杆菌Lp3 体外耐酸能力Fig.8 Acid tolerance of L.plantarum Lp3 in vitro
由图8 可以看出,在pH 值2.0、3.0 和4.0 的条件下,L.plantarumLp3 菌株在24 h 后的活菌数分别为7.29、7.72、8.28 lg(CFU/mL),存活率仍能达到90% 以上,表明L.plantarumLp3 菌株具有良好的耐酸能力。王帅静等[24]对7 株菌株在pH2.0 和pH3.0 时培养几乎不生长。
2.6 L.plantarum Lp3 菌株对模拟人工胃肠液的耐受性
益生菌菌株的重要标准是在人体胃肠道中存活的能力[25]。L.plantarumLp3 菌株先后暴露在模拟人工胃肠液的环境中,活菌数如图9 所示。
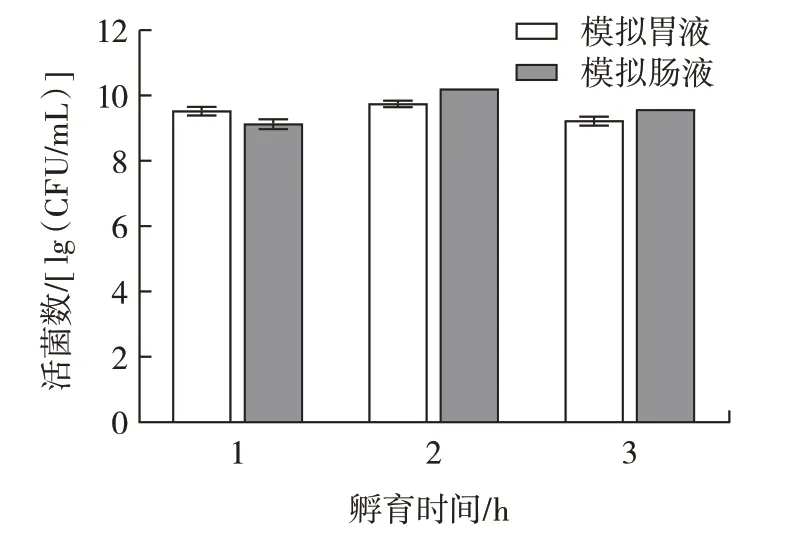
图9 植物乳杆菌Lp3 在模拟胃肠液中的存活情况Fig.9 Survival of L.plantarum Lp3 in simulated gastrointestinal fluid
如图9 所示,随着在人工胃肠液中处理时间的延长,L.plantarumLp3 菌株的活菌数降低。这说明L.plantarumLp3 菌株对人工胃肠液具有较好的耐受性,能显著抵抗胃肠道环境,具备一定的益生特性。Wang等[17]将L.plantarumHU-C2W 先暴露于模拟胃液环境培养3 h,然后接种到模拟肠液环境培养12 h,乳杆菌的存活率从67.75%降至43.82%。
2.7 L.plantarum Lp3 菌株对常用抗生素的敏感性
细菌会产生临床耐药性,耐药基因可以遗传,从而威胁宿主,因此有必要对乳酸菌进行抗生素敏感性试验[26]。L.plantarumLp3 菌株对常用抗生素的敏感性如表2 所示。

表2 植物乳杆菌Lp3 的抗药性比较Table 2 Antibiotic resistance of L.plantarum Lp3
如表2 所示,L.plantarumLp3 菌株对卡那霉素和链霉素不敏感,对红霉素、氯霉素和四环素较为敏感,但仍在安全浓度的范围内。结果表明L.plantarumLp3 菌株对胃肠中常用的抗生素具有一定的敏感性。
3 结论
GABA 是一种自然界含量较少的氨基酸,提取困难,微生物发酵法作为一种安全且高产GABA 的方式,越来越受到人们的重视。本研究从东北酸菜和韩国泡菜中筛选出高产GABA 的菌株3,通过16Sr DNA序列分析鉴定其为植物乳杆菌,命名为L.plantarumLp3。该菌株生长性能良好,对大肠杆菌、沙门氏菌、金黄色葡萄球菌均有比较好的抑制效果,具有良好的耐胆盐及耐酸能力。L.plantarumLp3 菌株在体外模拟胃肠液环境中表现出良好的生存能力,对常用的红霉素、氯霉素和四环素等抗生素具有一定的敏感性。L.plantarumLp3 益生性能适合作为食用菌种应用于食品开发。

