土壤中多环芳烃衍生物污染特征及迁移转化
程鹏飞 ,王泽铭 ,赵旭强 ,高彦征 *(1.江苏大学,环境健康与生态安全研究院,环境与安全工程学院,江苏 镇江 1013;.南京农业大学,土壤有机污染控制与修复研究所,江苏 南京 10095;3.广东省科学院生态环境与土壤研究所,广东省农业环境综合治理重点实验室,广东 广州 510650)
多环芳烃(PAHs)衍生物是由PAHs 中氢被其他官能团取代所形成,如氯代、硝基、甲基、氨基和含氧PAHs[1].PAHs 衍生物与PAHs 一样往往由人类活动造成并排放到环境中,但具有更强生物毒性、环境持久性、生物累积性,对食品安全和人体健康存在较大风险[2].受检测手段限制,PAHs 衍生物被发现和研究较晚,现阶段尚未有效监管,属于典型新型持久性有机污染物[3].土壤是持久性有机污染物重要储存库,人类活动产生的PAHs 衍生物通过干湿沉降、灌溉等方式进入土壤[4-5].近年来,土壤PAHs 衍生物污染逐渐受到关注.
氯代多环芳烃(ClPA H s)和硝基多环芳烃(NPAHs)是土壤中常见的两类PAHs 衍生物,商业、工业、交通及住宅用地中均有ClPAHs 和NPAHs检出[6-8].农田土壤中也逐渐检测到低浓度的ClPAHs 和NPAHs,Ni 等[9]在深圳地区农田土壤中检测到ClPAHs(0.33µg/kg),Sun 等[10]则发现我国26个省份农田土壤中普遍存在NPAHs(50µg/kg).农田土壤PAHs 衍生物污染会直接影响食品安全,市售蔬菜和稻米中也检测到ClPAHs(14.7~15.8µg/kg)和NPAHs(ND~4.19µg/kg)[11-12].鉴于ClPAHs 和NPAHs 的持久性和高毒性,土壤中长期低水平暴露会对人体健康产生危害[3].土壤中PAHs 衍生物的赋存形态和生物有效性受其迁移转化行为影响,-Cl 和-NO3为憎水基、亲电子基以及助/生色团,使ClPAHs 和NPAHs 物理、化学和生物特性与母体PAHs 不同,迁移转化机制更多样化[13].因此,开展ClPAHs 和NPAHs 污染和环境行为研究对于环境污染风险评估和防治具有重要意义.近年来,ClPAHs 和NPAHs 在土壤中迁移转化规律已得到广泛关注,开展了吸附-解吸、光降解、氧化还原及微生物降解等基础科学方面研究,但缺少系统的归纳总结.本文对新型污染物PAHs 衍生物在土壤中污染特征和迁移转化规律进行总结,提出未来研究方向和内容,为人们全面认识土壤中PAHs 衍生物迁移转化过程提供参考.
1 土壤中ClPAHs 和NPAHs 污染特征
1.1 土壤中ClPAHs 污染特征
土壤中ClPAHs 污染浓度、组成及分布主要受污染源控制.表1列出国内外土壤中ClPAHs和PAHs的浓度和主要成分.ClPAHs 总浓度范围为0.11~2880µg/kg,比母体PAHs(2200~158000µg/kg)低0~4个数量级.从研究区域看,文献报道的土壤ClPAHs污染主要出现在中国、越南、菲律宾、加纳等亚非国家.电子垃圾拆解是土壤中ClPAHs 重要来源,亚非国家等发展中国家是全球电子垃圾主要集中地,大多采用低技术含量方法拆解.从土壤利用类型分析,ClPAHs 主要分布在典型污染场地如电子垃圾、阻燃剂制造厂、交通道路及周边土壤[14-15]. Wang等[4]在石油化工厂(3.12µg/kg)、阻燃剂制造厂(1.48µg/kg)、电子垃圾回收站(0.26µg/kg)土壤中检测到 8~11 种 ClPAHs,周边土壤也检测到较高ClPAHs(0.48~3.23µg/kg).Nishimura 等[16]在电子废弃物露天焚烧土壤中检测到 26 种 ClPAHs(21~2800µg/kg),其中越南河内电缆电线焚烧厂(2800µg/kg)是目前污染浓度最高的土壤.农田土壤中ClPAHs 浓度相对较低,Ma 等[5]在农田土壤中检测到3-氯荧蒽(3-ClFlt, 0.05µg/kg)和6-氯苯并[a]芘(6-ClBaP, 0.10µg/kg),Ni等[9]则在深圳农业用地中检测到 2-氯蒽(2-ClAnt, ND~0.91µg/kg)、9-氯菲(9-ClPhe, ND~0.51µg/kg)和 9,10-二氯蒽(9,10-DClAnt, ND~0.33µg/kg).从土壤 ClPAHs 组成来看,2-氯蒽(2-ClAnt)、9,10-DClAnt、9-ClPhe、1-氯芘(1-ClPyr)、3-ClFlt、7-氯苯并[a]蒽(7-ClBaA)和 6-ClBaP 是 ClPAHs 主要成分.表 1 显示6-ClBaP(ND~84%)在大多数土壤ClPAHs 占有主要地位,Ma 等[5]发现6-ClBaP 在电子回收站和化工用地土壤ClPAHs 占49%和84%.较低含量苯并[a]芘(BaP, 2.3%~3.9%)对应高含量6-ClBaP,高含量菲(Phe)、芘(Pyr)、荧蒽(Flt)对应 ClPAHs 却低于6-ClBaP,(Chr, 7%~15%)对应氯代(ClChr)未检测到.土壤中6-ClBaP 和BaP 具有相关性,其他ClPAHs 与母体无相关性.6-ClBaP 可由BaP 直接氯化形成,土壤中有较高含量6-ClBaP,而其他ClPAHs很难直接氯化,主要来自二次反应[17]. Xu 等[18]发现PAHs 氯化动力学与其电离能(IP)、分子硬度(η)等电化学性质呈正相关.BaP 比其他PAHs 具有较小IP值和较高反应性,这也可解释6-ClBaP 更可能被直接氯化形成.同样解释土壤中高含量低活性(Chr,IP=7.60)、芴(Flu, IP=7.88)、荧蒽(Flt, IP=7.90)对应ClPAHs 含量却不如高活性蒽(Ant, IP=7.44)、Pyr(IP=7.43) 和 BaP(IP=7.10) 对应 ClPAHs 含量高[5,9,19-20].土壤PAHs 含量与ClPAHs 也会存在明显相关,Nishimura 等[19]发现土壤中 Phe 是(18%~53%)PAHs 主要成分,则检测到种类丰富的高含量ClPhe,如 9-ClPhe(11%~23%)、3,9-二氯菲(3,9-DClPhe, 5.3%~25%)、9,10-二氯菲(9,10-DClPhe,3.4%~19%)、1,9-二氯菲(1,9-DClPhe, ND~0.6%)、3,9,10-三氯菲(3,9,10-TClPhe, ND~1.3%).同种PAH有诸多Cl 代同分异构体,土壤中ClPAHs 中Cl 取代位置与C 原子活性相关,如9,10-DClAnt 中C9 和C10,1-ClPyr 中C1,6-ClBaP 中C6[1].目前,ClPAHs 检测方法尚不完善,以往研究中ClPAHs 种类和浓度的精确度和准确度仍然不足,需优化前处理和检测技术并建立完善的土壤ClPAHs 污染数据库.
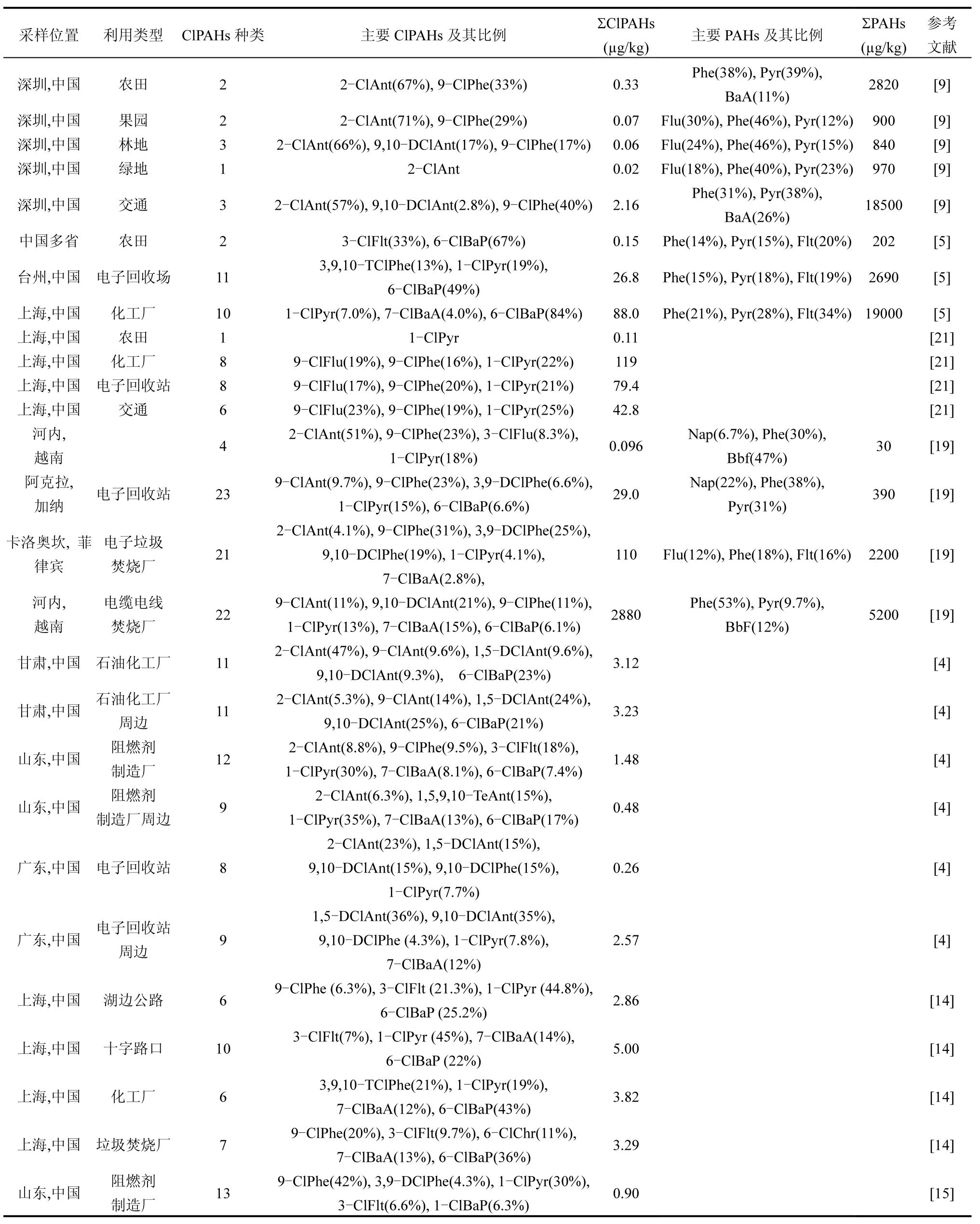
表1 土壤中氯代多环芳烃污染特征Table 1 The contaminant characteristics of ClPAHs in soils
1.2 土壤中NPAHs 污染特征
表2 列出国内外土壤中NPAHs 和PAHs 浓度和主要成分.NPAHs 总浓度为0.184~5280µg/kg,比母体PAHs(81~122876µg/kg)低1~4 个数量级.从研究区域看,NPAHs 分布比ClPAHs 广,中国、澳大利亚、西班牙、瑞士等地都有研究.NPAHs 来源比ClPAHs 更普遍,可从柴油等燃烧源排放,也可由PAHs 与OH 和NO3自由基反应形成[22].从采样点分析,不同利用类型土壤中均检测到 NPAHs.Niederer 等[23]在瑞士巴塞尔游乐园和公园土壤中检测到8 种NPAHs(0.030~0.800µg/kg).Idowu 等[8]检测到澳大利亚工业城市中娱乐区、工业区、吸烟区和居住区土壤中NPAHs 浓度分别为32.7~216.0、98.5~111.0 和 28.6~157.1µg/kg. Garcia-Alonso 等[24]发现西班牙农业、城市和煤气厂土壤中NPAHs 浓度分别为0.184、59.6 和5280µg/kg.De Guidi 等[25]在意大利工业区土壤中检测到3-硝基荧蒽(3-NFlt)、1-硝基芘(1-NPyr)、6-硝基苯并[a]芘(6-NBaP),总浓度在0.053~ 0.260µg/kg.Sun 等[10]调查了我国26 个省份农田土壤中NPAHs,11 种NPAHs 总浓度为(50±45)µg/kg,辽宁、山西、河南和贵州浓度较高.Bandowe 等[16]在青海高原、西安城镇/农村、巢湖盆地以及湛江农业和林业土壤中均检测到 NPAHs(0~10.9µg/kg),4 个气候带中NPAHs 组成存在差异,农村和城市也存在差异.NPAHs 和PAHs 浓度与经度呈正相关,随纬度升高逐渐降低.但此研究只选取了青海、西安、巢湖、湛江4 个城市数据,不具有普遍性.

表2 土壤中硝基多环芳烃污染特征Table 2 The contamination characteristics of NPAHs in soils
从土壤NPAHs 主要成分看,1/2-硝基萘(1/2-NNap, <0.03~205µg/kg)、2-硝基芴(2-NFlu, 0.07~196µg/kg)、9-硝基菲(9-NPhe, 0.011~291µg/kg)、1-NPyr(0.04~1360µg/kg) 、 9- 硝基蒽(9-NAnt,0.011~313µg/kg)、3-NFlt(0.018~3361µg/kg)是土壤中NPAHs 主要成分[8,10,26].Idowu 等[8]发现NPAHs总量与PAHs 呈显著正相关, NPAHs 与PAHs 来源、空间分布可能相同.Cai 等[27]发现土样中1-NNaP 与Nap 呈正相关(r=0.187, P=0.006),但未分析NPAHs总量及其他NPAH.Bandowe 等[16]则证明高原、温带、亚热带土壤中PAHs 总量与NPAHs 呈正相关(r=0.643~0.900, P<0.022),且低分子量和高分子量PAHs 含量均与NPAHs 呈正相关.
2 土壤中ClPAHs 和NPAHs 的迁移转化
土壤既是ClPAHs 和NPAHs 的储存库也是净化场所,土壤中ClPAHs 和NPAHs 可发生吸附-解吸、光降解、氧化还原、生物降解等行为.-Cl 和-NO3使ClPAHs 和NPAHs 的性质和迁移转化规律与母体PAHs 不同.采用EPI Suite 软件评估了ClPAHs 和NPAHs 的物化性质和环境归趋(表3),并总结了它们在土壤中的转化行为及机制(图1).

图1 土壤中ClPAHs 和NPAHs 的转化行为Fig.1 The transformation behaviors of ClPAHs and NPAHs in soils
2.1 土壤中ClPAHs 和NPAHs 的迁移
-Cl 和-NO2为憎水基团,ClPAHs 和NPAHs水溶解度相比PAHs 更低(表3),NPAHs 在土壤中吸附系数和持久性高于母体PAHs[31].Sun 等[10]发现灌溉频繁农业土壤中低水溶性NPAHs 比含氧PAHs有更强固定性、更持久滞留性和更高浓度.PAHs 衍生物在土壤中残留还受有机质、微生物等因素影响,Bandowe 等[16]发现NPAHs 含量与土壤有机碳呈正相关,单独NPAH(1-NNaP、5-NAce、2-NFlu 等)也与有机碳呈正相关.马涛[32]则发现太滆运河流域土壤中总有机碳与高环 PAHs 呈正相关,而与NPAHs 并无显著相关性,因为NPAHs 含量较低.表3显示 PAHs、ClPAHs 和 NPAHs 沸点顺序为NPAHs>ClPAHs>PAHs,土壤中大分子ClPAHs 和NPAHs 比PAHs 更难向空气扩散.而Li 等[6]发现,大气中NPAHs 比PAHs 更易吸附在颗粒物上,容易随颗粒向土壤输入.因此,ClPAHs 和NPAHs 在土壤具有持久性,不易在土壤与水、气界面发生迁移.现在仍无ClPAHs 和NPAHs 在土壤中迁移数据,未来需通过土柱等实验模拟其在土壤中迁移过程.

表3 PAHs、ClPAHs 和NPAHs 物化性质和环境归趋Table 3 The physico-chemical properties and environmental fates of PAHs, ClPAHs, and NPAHs
2.2 土壤中ClPAHs 和NPAHs 的吸附和解吸
ClPAHs 和NPAHs 可在土壤多界面发生吸附-解吸,芳香环上取代基发挥重要作用.以往研究表明,矿物和有机质对芳香烃吸附机制是供体-受体(EDA)作用,包括阳离子-π、n-π、π-π 等[33].-Cl和-NO2是亲电子基,缺电子芳香环和富电子有机质及矿物质(供体)可形成强烈π-π 作用.王珑等[34]提出NPAHs 中芳环上离域电子云π 键受-NO2拉电子作用而缺电子成为电子受体,与黏土矿物中硅氧烷表面氧原子孤对电子n(供体)形成EDA 络合物.-NO2拉电子作用越强,EDA 作用越强烈.而Boyd[35]提出矿物层间水合能力弱的阳离子(K+、NH4+等)可与NPAHs 中-NO2形成Mn+-NO2作用.而-NO2位置影响作用效果,2-硝基萘(2-NNap)和1-硝基萘(1-NNap)中只有2 号位-NO2与萘环共平面,具有较强拉电子作用,与K 基蒙脱石形成KNO2作用[34].NPAHs 分子大小也会影响吸附, 1,5-二硝基萘(163Å2)比1,8-二硝基萘(167Å2)分子面积大,很难进入蒙脱石层间被吸附.其研究仍处于推测阶段,缺少具体数据支持,需采用计算化学方法进一步分析.Al-Bashir 等[36]发现土壤中氨基和硝基Nap吸附行为不同,非电离性硝基Nap 吸附并不随pH值变化,分配系数与溶解度密切相关.1-硝基-2-甲基-萘在土/水中分配系数要高于1-硝基萘,疏水基-CH3降低了1-硝基-2-甲基-萘溶解度.PAHs 衍生物也能被生物体吸附, Choi 等[37]发现短小芽孢杆菌释放的蛋白质对氯代萘有较好吸附能力,疏水作用占据主导,高氯同系物吸附量大于低氯同系物.ClPAHs 在土壤中吸附行为研究匮乏,可借鉴氯苯类污染物研究.Ololade 等[38]发现有机质对氯代苯酚的吸附量与lgKow呈反比, Yang 等[39]则证明矿物是土壤中氯代有机物主要吸附剂,氯代苯酚吸附量与其lgKow呈正比.土壤中ClPAHs 吸附解吸与氯代苯酚有相似之处,但其芳香环种类繁多、取代基复杂,迁移转化规律更加多样.有机质和矿物对污染物吸附规律存在差异,开展研究应针对不同深度和类型土壤具体分析.现有吸附机制研究多限于猜测,未来需通过理论计算结合实验更深入研究.
土壤中ClPAHs 和NPAHs 也会与外来物质发生吸附-解吸行为,影响其环境命运和暴露风险.Zhang等[40]发现聚乙烯等微塑料对9-NAnt 具有高吸附,微塑料疏水表面对疏水有机物具有高亲和性.Hu等[2]的研究同样表明Phe 衍生物在微塑料上的富集依赖于分子疏水性,吸附量与lgKow呈正相关依次为:Phe-Cl > Phe-CH3> Phe > Phe-NO2> PheCHO.分子表面电势显示,-CHO 和-NO2使分子表面电荷更不平衡,导致污染物有弱极性而吸附减弱.微塑料对NPAHs 的吸附受pH 值、盐离子等环境条件影响[40].富电子基-NO2容易与正电荷结合,低pH 下微塑料表面倾向质子化,有助于两者静电吸引[41].盐离子会与NPAHs 竞争位点,微塑料对NPAHs 吸附量随离子浓度增加而下降.Zhang 等[42]指出9-NAnt、微塑料复合暴露中微塑料对9-NAnt 吸附降低了其在生物体内积累,但延长了生物毒性时间,持续对斑马鱼产生神经毒性.而He 等[2]发现吸附有Phe 衍生物的微塑料在胃肠道液中生物可给性在81.34%~98.72%,终身癌症风险高于美国环保局安全限制.微塑料和PAHs 衍生物作为新兴污染物,研究两者在土壤中相互作用及生物毒性具有重要意义,未来仍需重点关注.碳材料作为优良修复材料广泛应用于土壤污染修复,表面积大、官能团丰富的碳材料进入土壤后会与PAHs衍生物发生作用.Li等[43]将活性炭分别加入Pyr 和1-NPyr 污染土壤中,1d 后吸附量分别为78.0%和88.1%.大分子1-NPyr 与活性炭间有更强范德华力,同时1-NPyr 中N 和O 可与活性炭上氢原子形成氢键.而Manousi 等[44]探究了碳材料对2-NFlu、9-NAnt、3-NFlt 等的吸附机理,红外光谱显示苯环C=C 峰向较低波数偏移,N 基团峰也发生明显变化.炭材料中π-电子与NPAHs 中π-电子发生π-π 作用,含氮官能团也参与了相互作用.此外,碳材料对NPAHs 吸附量随其疏水性增加而增加,疏水作用也参与反应.但不少研究提出碳材料有传递电子能力,有毒有机物吸附过程会涉及降解反应,相关研究未考虑到降解反应的可能贡献[45].
2.3 土壤中ClPAHs 和NPAHs 的降解
2.3.1 光降解 PAHs、ClPAHs、NPAHs 光降解是其在土壤中重要消减方式.助色团-Cl 和生色团-NO2使ClPAHs 和NPAHs 吸收光谱发生红移,摩尔吸光系数增加,对日光吸收程度比母体更强[46].NPAHs 光降解半衰期短于母体PAHs, Cvrčková and Ciganek[47]发现Nap、Ant、Chr 在二氯甲烷中光降解半衰期为4252, 8.4, 60d,对应硝基衍生物1-NNap、9-NAnt、6-NChr 半衰期为6, 0.5, 15d.Ohura等[48]发现,ClPAHs 耐光降解能力6-ClBaP<1-ClPy<7-ClBaA ClPAHs 和NPAHs 光降解中间体和产物与母体也具有明显差异. C-C 断裂一般生成含有氯代或硝基小分子有机物,•Cl 或•ON 自由基会与中间体反应生成氯代或硝基有机物.以往研究发现,PAHs在光照下生成有机阳离子自由基,在铁氧化物、黏土矿物等基质表面稳定存在,也叫环境持久性自由基EPFRs[53-54].Zhao 等[52]发现2-ClAnt 和1-ClPyr 在Fe(III)-蒙脱石表面光降解中生成EPFRs,2-ClNap和9-ClPhe 反应体系并未发现.EPFRs 来源于电子传递反应,后两者HOMO 值较低,很难与矿物发生电子传递.Ni 等[55]在1-NNap、9-NAnt、1-NPyr 在赤铁矿光反应体系发现相似规律,1-NNap 光降解中未产生EPFRs.遗憾的是体系未将PAHs 与其衍生物共同研究,未能得到衍生物与母体生成 EPFRs 的差异[52,55].NPAHs 在赤铁矿表面光降解中还可生成•ON 和•NO2活性自由基,CO2存在也可诱导•CO3−生成.PAHs 及其衍生物光修饰和光敏化过程可产生光致毒性,光敏化生成的ROS 会对生物体造成损伤.Onduka 等[56]对10 种NPAHs 在光照和黑暗下急性毒性开展研究,发现除1,5-二硝基萘均具有光致毒性.1-NPyr 光照条件下毒性是黑暗条件下1000多倍,比母体及其羟基和氨基衍生物光致毒性高100 倍,且1-NPyr 在中等光照强度下即可产生光致毒性.鉴于ClPAHs 和NPAHs 的光致毒性效应,未来应重点关注实际土壤中它们的光降解过程和毒性效应. ClPAHs 和NPAHs 光降解会受土壤粒径、厚度等环境因素影响.王依雪等[57]发现2-ClNap 光降解速率随土壤粒径增大而增大,较大土壤颗粒利于通气、透光.土壤颗粒有光屏蔽作用,2-ClNap 光降解速率随土壤厚度增加而减少[53].低pH 值有利土壤中O2•−向H2O2和•OH 转化,促进2-ClNaP 降解.2-ClNap 光降解随腐殖酸含量增高受到抑制.腐殖酸可作为光敏剂诱导1O2、•OH 生成促进光降解,也会与污染物竞争吸收光子产生光屏蔽效应而抑制污染物光降解,说明腐殖酸光屏蔽效应发挥主要作用.Zhao 等[52]发现,环境湿度对ClPAHs 在Fe(III)-蒙脱石光降解具有明显影响,光降解速率随着湿度从10%升高至80%明显受到促进,•OH和O2•−浓度分别增加1.07 倍和62.79 倍.环境因素对ClPAHs 和NPAHs 光降解的影响与母体具有相似性,而其中的差异性仍需要通过大量研究来揭示. 2.3.2 氧化还原降解 有毒有机物被氧化或还原降解能力依赖于自身性质, 亲电子基团-Cl 和-NO2能够显著改变PAHs 氧化还原性质.EPI 评估了污染物被空气氧化半衰期,半衰期顺序为NPAHs>ClPAHs>PAHs,且随取代基团增多而延长(表3).以蒽及其衍生物为例,空气氧化半衰期顺序为9-NO2Ant(2.14d)>9,10-DClAnt(1.30d)>9-ClAnt(0.380d)>Ant(0.267d).而最近研究常采用密度泛函评估污染物分子供/吸电子能力,常用运算符有最高占据分子轨道HOMO、最低未占据分子轨道LUMO、电离能IP、电子亲和度EA等[1,18].IP=7.55eV是微生物和矿物氧化降解 PAHs 阈值,Ant(7.44eV)、Pyr(7.43eV)、BaP(7.10eV)会被锰过氧化物酶和含铁黏土矿物氧化降解[58].HOMO 值可用于评估分子给电子能力,本文采用密度泛函理论计算了常见ClPAHs、NPAHs和PAHs 的HOMO 值.图2 显示HOMO 值顺序为NPAHs 图2 PAHs、ClPAHs 和NPAHs 的HOMO 值和轨道分布Fig.2 The HOMO values and orbital distribution of PAHs, ClPAHs, and NPAHs 2.3.3 生物降解 微生物是土壤中PAHs 及其衍生物转化主要驱动力,取代基种类、数量、位置等会影响降解菌种、速率和途径[64].表3 中快速生物降解性顺序为PAHs> ClPAHs > NPAHs,随着取代基增多而减小.Heitkamp 等[65]将石油污染沉积物中分离的PAHs 降解微生物Mycobacterium sp.用于1-NPyr 降解,培养10d 后矿化率仅有12.3%.好氧和厌氧体系中降解均缓慢,好氧体系检测到少量14CO2,厌氧体系则没有14CO2生成,1-NPyr 被还原为1-氨基芘.PAHs 高降解菌很难降解NPAHs,硝基引入改变了代谢途径并减缓降解速率.而Walker 等[66]分离的萘降解土著菌可将1-ClNap 降解生成萘羟基衍生物和水杨酸衍生物. Mori 等[67]发现白腐真菌Phlebia lindtneri 可将1/2-ClNap 加氧生成羟基氯代衍生物,但不能实现脱氯和苯环断裂,P450 单加氧化酶发挥主要作用.而马涛等[68]则发现黄孢原毛平革菌和9,10-DClAnt 反应过程中则发生脱氯反应和开环反应.除P450 单加氧酶外,木质素过氧化物酶、锰过氧化物酶等也发生作用.过氧化物酶利用H2O2使氯蒽发生单电子氧化,脱氯生成9,10-蒽醌,进而开环生成酮、酸、酯类化合物[69-70]. NPAHs 降解机理与PAHs 不同,与硝基芳烃相似,可作为碳源和氮源被微生物降解[70].Li 等[71]从富含1-NNap 的美国新泽西州化工土壤中分离出Sphingobium sp.菌株JS3065,发现编码1-NNap 代谢基因簇位于质粒上,与编码萘分解基因簇具有共同起源.分解起始,双加氧酶作用下1-NNap 生成1,2-羟基萘,随后降解途径与Nap 一致.好氧条件通过氧化和还原途径生物降解NPAHs,厌氧体系通过还原途径降解[71].RAFII 等[72]发现Mycobacterium sp.也可通过氧化和还原途径降解1,3-DNPyr、1,6-DNFlu和6-NChr 等,还原过程产物为氨基PAHs. Pothuluri等[73]发现真菌Cunninghamella elegans 可通过P450单加氧酶和环氧化物水解酶将1-NPyr、6-NBaP、2/3-NFlt、2-NFlu 和1-NChr 氧化为硝基芳烃氧化物和硝基芳烃反式二氢二醇,随后发生重排并与硫酸盐、葡萄糖等偶联生成硝基硫酸酯而实现解毒.Al-Bashir 等[36]发现土壤中硝基萘矿化第一阶段由微生物控制快速降解,动力学曲线符合酶催化反应Michaelis-Menten 模型.第二阶段降解缓慢,土壤上污染物未饱和,生物降解受其解吸速率影响.同时发现硝基萘矿化速率是氨基萘2~4 倍,但矿化时间滞后4~6 周.研究者并未解释相关机制,结合后期NPAHs降解途径研究猜测,硝基萘先被还原酶快速还原成羟胺,随后同氨基萘一样缓慢矿化.1-硝基-2-甲基-萘降解速率要慢于1-硝基萘,-CH3基团会减少加氧酶对萘环攻击位点数.研究发现,碳材料可增强NPAHs生物降解.Wang 等[74]将炭黑加入希瓦氏菌MR-1 与硝基联苯体系中,污染物还原速率常数从0.0044h−1提高到0.035h−1.增强倍数与炭黑电导率呈正相关,炭黑在污染物生物还原过程可能充当了导体作用.ClPAHs 和NPAHs 生物降解文献报道比较陈旧,应结合土壤污染特征,开展主要污染物降解菌筛选,加强降解途径和降解产物毒性效应研究. ClPAHs 和NPAHs 浓度低于母体PAHs(0~5)数量级,ClPAHs 集中在典型污染场地和附近土壤,NPAHs 在各种土壤中广泛存在.土壤中ClPAHs和NPAHs 迁移转化与母体PAHs 有明显区别,易发生光降解,难以迁移且不易被矿物和微生物转化.现有研究仍存在不足,建议从以下几个方面进行深入研究. 3.1 国内外还没有PAHs 衍生物标准检测方法,且土壤中污染数据仍然较少.受检测技术限制, PAHs衍生物检测准确度、精度以及种类很难满足需求.未来需更多PAHs 衍生物标准品商业化,实现土壤中更多PAHs 衍生物精准定性和定量.优化前处理技术,实现PAHs 衍生物快速、简便、完全提取.只有将这些技术发展完善,才能准确掌握土壤中PAHs 衍生物赋存形态和浓度.未来还需系统研究各区域、利用方式土壤中PAHs 衍生物污染水平,为土壤PAHs 衍生物污染现状和管控研究提供基础数据. 3.2 PAHs衍生物物化特性多依赖于EPI Suite软件和模型数据,仍缺少实际实验数据.PAHs衍生物在土壤中垂直分布、土壤颗粒和孔隙水间分配行为尚未见报道,需进行土柱实验模拟其在土壤中垂直迁移.除Nap 衍生物外,土壤组分对PAHs 衍生物吸附能力和吸附机理尚不清晰.未来需通过实验方法结合理论计算,更全面、深入地掌握PAHs 衍生物在土壤多界面的迁移过程. 3.3 PAHs 衍生物在土壤及组分界面降解研究仍然匮乏.降解数据以萘衍生物为主,其他PAH 的衍生物降解研究相对较少.受PAHs 疏水性影响,PAHs 转化研究多集中于干燥土壤矿物,未来可关注土壤活性自由基介导下水相中PAHs 衍生物转化机制.土壤组分和环境条件对降解的影响规律仍不清晰,未来需关注Cl 源和N 源存在下ClPAHs 和NPAHs 转化和形成机制.Cl/N 同位素标记、傅里叶变换回旋共振质谱等技术对探究PAHs 转化机制也有重要帮助.
3 结论和展望

