类风湿关节炎生物标志物开发及潜在治疗中药预测*
张 琳,毛 伟,刘 芳,枉 前,吕 军△
(1. 中国人民解放军陆军军医大学第一附属医院,重庆 400038; 2. 重庆市南岸区人民医院,重庆 400060)
类风湿关节炎(RA)属全身性难治性自身免疫性疾病[1],最终可导致关节畸形和功能丧失[2],可并发肺部疾病[3]、心血管疾病[4]、恶性肿瘤、抑郁症等[5]。不仅会造成患者身体机能、生活质量和社会参与度下降,也给患者家庭和社会带来了巨大的经济负担。迄今为止,其病因及具体发病机制尚未完全明确。故RA 早期的诊断具有重要意义。部分生物标志物已被常规用于RA 的诊断和治疗[6],但仍不能满足临床实践和药物开发的需求。有研究发现,免疫功能紊乱与RA 的发病密切相关[7]。以T 淋巴细胞、B 淋巴细胞、中性粒细胞、巨噬细胞为代表的免疫细胞参与并介导RA 的自身免疫反应,诱导细胞因子、趋化因子扰乱免疫系统平衡,进而加快软骨和骨侵蚀[8]。因此,从免疫细胞浸润的角度研究RA的发病机制是目前RA 研究的热点和发展趋势[9],对于开发新的免疫治疗靶点具有重要价值。基于此,本研究中利用生物信息学的方法探索RA 的生物标志物,并预测可能用于治疗RA 的中药,为今后诊断和治疗RA 提供新思路。现报道如下。
1 材料与方法
1.1 仪器、试药与细胞
仪器:DS-11FX+超微量/荧光分光光度计(美国Denovix公司)。
试药:Trizol 试剂盒(天根生化科技<北京>有限公司,批号为DP424);TaKaRa PrimeScriptTM反转录聚合酶链反应(RT - PCR)试剂盒(日本TaKaRa 株式会社,批号为RR092A);蛋白酶抑制剂(批号为ST506)、RIPA裂解缓冲液(批号为P0013B)、甘油醛-3-磷酸脱氢酶(GAPDH,批号为A0208),均购自美国Beyotime Biotechnology 公司;BCA 试剂盒(广州硕谱生物科技有限公司,批号为BL521A);Dulbecco改良Eagle培养基(美国Gibco公司,批号为C11995500BT);兔抗细胞骨架相关蛋白2(CKAP2)多克隆抗体(英国Abcam 公司,批号为ab227214)。
细胞:人成纤维细胞样滑膜细胞系(MH7A),购自中国科学院上海细胞生物研究所。
1.2 患者(基因)收集
选择GPL96 平台的3 个数据集GSE55235,GSE55457,GSE55584 收集患者滑膜组织基因表达情况。共收集到33例RA患者,20例健康者,分别纳入RA组和HC组。其中3个数据集分别含RA患者、健康者各10例;RA患者13例,健康者10例;RA患者10例。
1.3 基因筛选与分析
数据获取与差异表达基因的筛选:在Gene Expression Omnibus(GEO)数据库以“rheumatoid arthritis”“synovial”为关键词检索人类mRNA 表达谱。以前述3 个数据集联合分析,采用GPL8300 平台的GSE10500 数据集和GPL570 平台的GSE77298 数据集(分别采自滑液的巨噬细胞和滑膜组织分别含RA 患者5 例、健康者3 例和RA 患者16 例、健康者7 例)进行外部验证。利用limma R 包以adjustedP<0.05,|log2FC|>1 为条件筛选差异表达基因(DEGs)。
加权基因共表达网络(WGCNA)的构建:计算整合后的数据集中每个基因的中位数绝对偏差,选取其中最大的5 000 个基因构成表达矩阵。利用WGCNA 包进行层级聚类,计算软阈值,并构建共表达网络。
核心基因与生物标志物的筛选:将与临床症状相关性最高的模块基因导入Cytoscape 3.7.1 软件,利用MCODE 插件筛选得分最高模块。将模块中的基因进行单因素逻辑回归,筛选P<0.05 的基因为核心基因。以数量7∶3随机分为训练集和测试集。训练集使用随机森林递归特征消除(RF-RFE)、支持向量机递归特征消除(SVM-RFE)2种算法进行特征选择,重叠基因即为RA的生物标志物。使用GSE10500 和GSE77298 进行外部验证。
基因集富集分析(GSEA):使用clusterProfiler 包,分别以“c5. go. bp. v7.4. entrez. gmt”“c2. cp. kegg. v7.4.entrez. gmt”为参考基因集对RA 和生物标志物进行GSEA,以P<0.05和adjustedP<0.05筛选显著通路。
免疫细胞浸润的评估:使用CiberSort算法获取22种免疫细胞浸润水平,比较RA 组与HC 组免疫细胞浸润的差异;从InnateDB数据库(https://www.innatedb.ca/)中获取先天免疫基因,进行相关性分析。
1.4 mRNA 表达水平检测
采用RT-PCR 法。取对数生长期的MH7A 细胞,用含10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的Dulbecco 改良Eagle 培养基,于37 ℃、5% CO2条件下培养,4 ℃下12 000 r/min 离心15 min,提取总RNA,并测定RNA 的浓度和纯度。反转录得到cDNA,反应体系20 μL,循环程序:94 ℃5 min,94 ℃30 s,57 ℃30 s,40 个循环;72 ℃30 s。引物序列:CKAP2为5'-AGGCTGTTACAACATAAGAG - 3'和5'- GAAACTGACAAGGTACGATTAG - 3';GAPDH为5' - CACCCACTCCTCCACCTTTG-3'和5'-CCACCACCCTGTTGCTGTAG -3'。以GAPDH 为内参,通过2-ΔΔCT分析mRNA 的相对表达水平。所有样品重复3次。
1.5 蛋白表达水平检测
采用Western blot 法。收集MH7A 细胞,裂解得上清液,使用BCA 试剂盒测定蛋白质浓度。将20 μL 上清液与5 × loading buffer 混合,98 ℃煮沸,12 000 r / min离心1 min,12% SDS - PAGE 凝胶电泳,转移至PVDF膜,5%脱脂乳(以含吐温-20的Tris缓冲盐溶液为溶剂)封闭1 h,4 ℃兔抗CKAP2多克隆抗体(1∶1 000,V/V)孵育过夜,二抗孵育2 h,检测。
1.6 相关中药预测
从TCMSP 数据库(https:// tcmspw. com/)中获取所有中药的活性成分及其对应基因,将其与DEGs的重叠基因作为中药治疗RA的靶基因,统计中药对应的靶基因数量。筛选类药性(DL)>0.18的活性成分,以及靶基因数量大于上四分位数的中药,利用Cytoscape 3.7.1 构建中药-活性成分-靶基因网络图,使用MCODE 插件筛选评分最高的模块,其包含的中药可能是用于治疗RA的中药。
1.7 数据分析
采用GraphPad Prism 5.0 软件进行统计学分析。计量资料以X±s表示,行t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 差异表达基因分析
共有706个差异表达基因,其中包括上调基因410个,下调基因296个。详见图1(火山图中,红色表示上调,蓝色表示下调,灰色表示不显著)。

A. 主成分分析聚类图 B. 差异表达基因火山图 C. 显著差异表达基因热图图1 差异表达基因分析A.Cluster diagram of principal component analysis B.Volcano plot of differentially - expressed genes C.Heatmap of significantly differentially -expressed genesFig.1 Analysis of differentially - expressed genes
2.2 GSEA
基因本体论(GO)功能富集中的生物过程(BP)分析显示,RA主要富集在B淋巴细胞受体信号通路、抗原受体介导的信号通路、免疫反应调节细胞表面受体信号通路、免疫球蛋白的产生等生物学途径;京都基因与基因组百科全书(KEGG)通路富集分析显示,RA 主要富集在原发性免疫缺陷、免疫球蛋白A(IgA)产生的肠道免疫网络、抗原加工和呈递、自身免疫性甲状腺疾病等信号通路。详见图2。
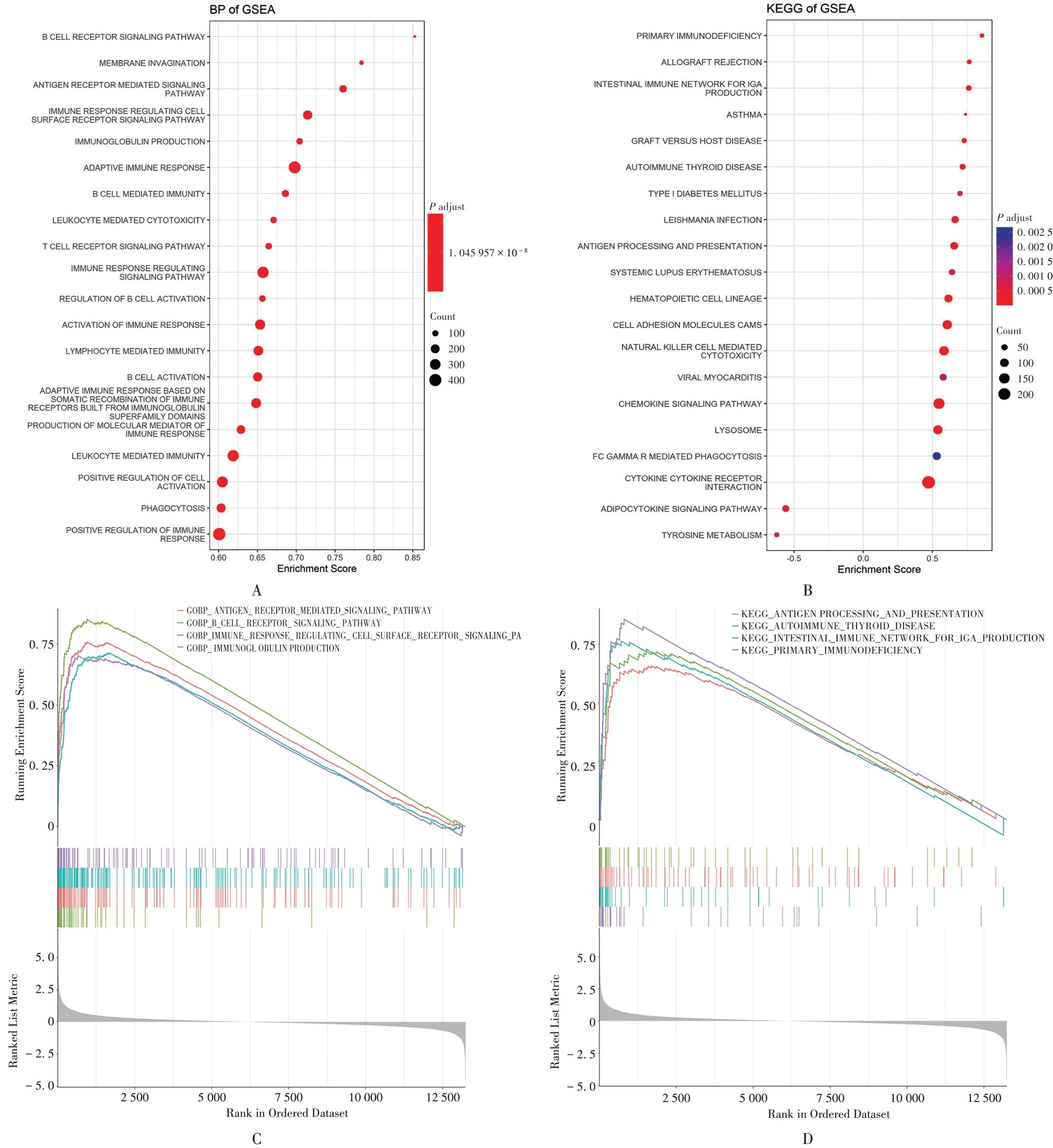
A,C. 生物学过程 B,D.KEGG通路图2 基因集富集分析A,C.Biological processes B,D.KEGG pathwaysFig.2 Analysis of gene set enrichment
2.3 WGCNA
共得到5 个模块。模块与临床症状相关性分析显示,绿松石(颜色)模块中的基因不仅与模块相关度高,而且与RA也高度相关(r=0.87,P<0.001)。详见图3。
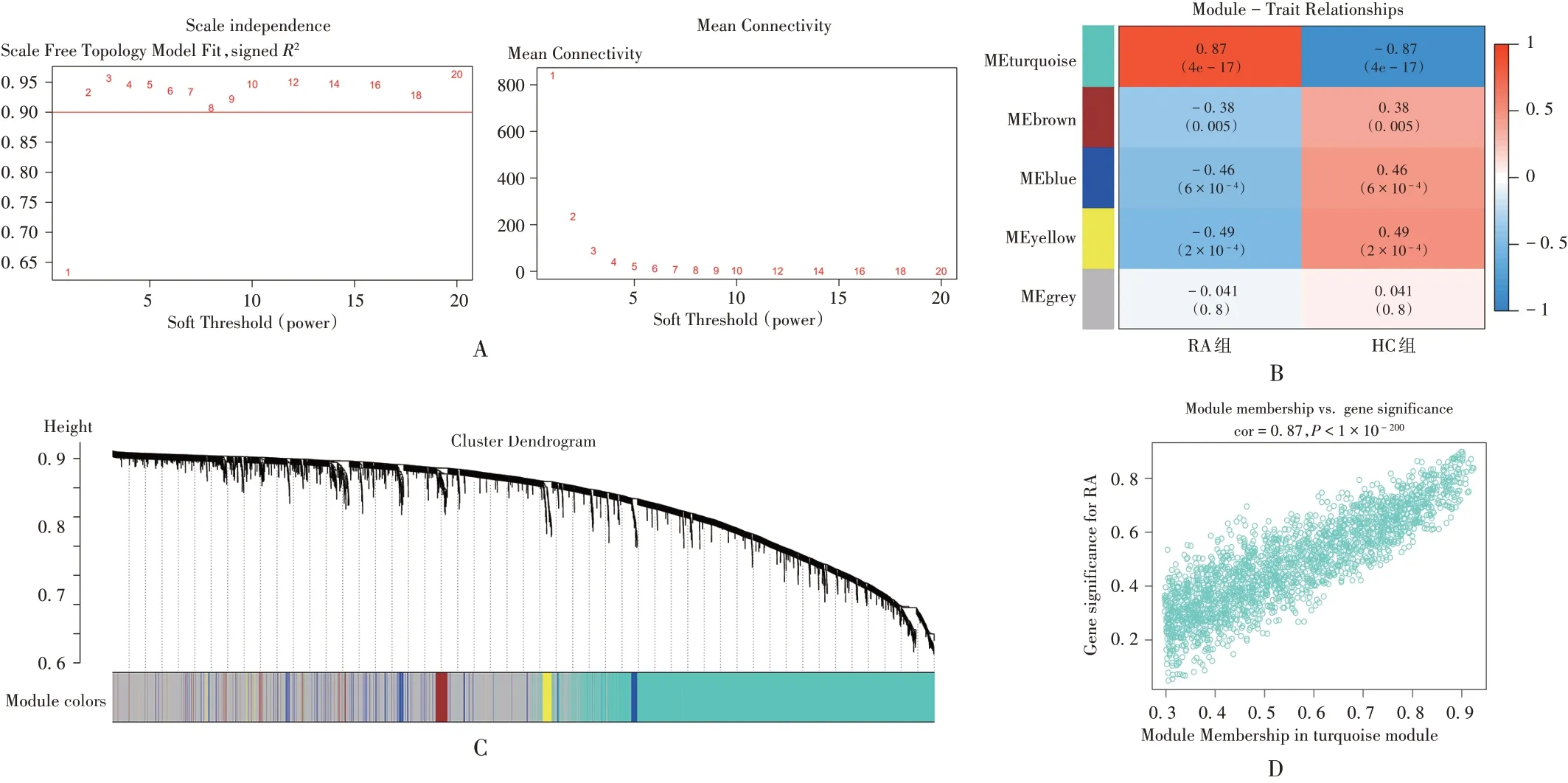
A. 不同软阈值下的拟合优度 B. 模块与RA相关性热图 C. 聚类分析树状图 D. 绿松石模块特征散点图图3 加权基因共表达网络分析A.Goodness of fit under different soft thresholds B.Heatmap of correlation between module and RA C.Tree diagram of cluster analysis D.Characteristic scatter diagram of turquoise moduleFig.3 Analysis of weighted gene co - expression network
2.4 核心基因与潜在生物标志物的筛选与验证
获得32 个核心基因。通过2 种算法筛选得到重叠基因CKAP2(见图4)。使用受试者操作特征(ROC)曲线检验CKAP2的诊断效能。训练集中CKAP2的药- 时曲线下面积(AUC)为0.994,测试集中为0.963。与HC 组比较,RA 组患者CKAP2表达水平显著上调(见图5)。外部验证其AUC分别为0.933 和0.866,表明CKAP2具有较高的诊断价值。BP 的GSEA 分析显示,CKAP2主要富集于T 淋巴细胞选择、B 淋巴细胞受体信号通路、肽抗原的抗原加工和呈递等生物途径;KEGG 的GSEA 分析显示,CKAP2主要富集于同种异体排斥、原发性免疫缺陷、IgA 产生的肠道免疫网络、抗原加工和呈递、系统性红斑狼疮和细胞黏附分子(CAM)等信号通路。
2.5 免疫浸润分析
与HC 组比较,RA 组患者M1 巨噬细胞、浆细胞、活化的记忆T淋巴细胞CD4+、T淋巴细胞CD8+、滤泡辅助T 淋巴细胞等浸润较多,而在静息的树状细胞、活化的自然杀伤(NK)细胞、活化的肥大细胞、静息的记忆T 淋巴细胞CD4+等浸润较少。详见图6。CKAP2表达量与免疫细胞相关性分析显示,CKAP2的表达与浆细胞、T 淋巴细胞CD8+呈显著正相关(r= 0.84,P= 5.0 × 10-15;r= 0.70,P= 4.1 × 10-9),与静息的记忆T 淋巴细胞CD4+、活化的肥大细胞呈显著负相关(r= - 0.69,P=1.5×10-8;r=-0.56,P=1.2×10-5)。详见图7。
从InnateDB数据库获取先天免疫基因,分析CKAP2与先天免疫基因的相关性。结果显示,CKAP2的表达与CD27,PLCG2,UCP2呈显著正相关,与IL1R1,EGFR,PARD3呈显著负相关(P<0.05)。其中,CKAP2与CD27表达的相关性最高(r=0.92,P<0.001)。
2.6 CKAP2 体外表达水平的验证
与不含白细胞介素1β(IL - 1β)的MH7A 细胞比较,含IL-1β的MH7A 细胞中CKAP2的mRNA、蛋白表达水平均显著升高(P<0.05)。详见图8。与前述分析结果一致,表明数据分析中鉴定出的RA 潜在生物标志物CKAP2在MH7A细胞中变化显著。
2.7 相关中药预测
共筛选出108种中药,构建中药-活性成分-靶基因网络图,使用MCODE插件筛选高得分模块后得到11种中药(包括苍耳子、黄芩、党参等)。详见图9。

A. 中药筛选 B. 中药- 活性成分- 靶基因网络 C.MCODE得分最高的模块图9 中药预测A.Screening of TCMs B.Network of TCMs - active components - targets C.Modules with the highest score of MCODEFig.9 Prediction of TCMs
3 讨论
RA 病因复杂,由于关节破坏的不可逆性,早期诊断对于预防RA 进展有重要作用。目前已有的生物标志物不能满足临床需求,仍有部分RA患者漏诊[10],因此,寻找新的、更有效的生物标志物,分析RA 免疫细胞浸润情况,预测RA 新的治疗药物,对于RA 患者的诊断与治疗具有重要意义。
本研究中发现,CKAP2 可能为RA 的潜在生物标志物,且筛选出的CKAP2在内外部验证中均可靠,表明本研究的整合策略是可行的。CKAP2 为微管结合蛋白,具有稳定微管的作用,可调节非整倍体、细胞周期和细胞凋亡[11]。既往研究表明,CKAP2 在乳腺癌[12]、卵巢癌[13]、胃癌[14]及其他恶性肿瘤[15]中可通过各种机制缩短患者的总生存期。然而,其在RA中的表达水平与作用尚无研究报道。有文献报道,肝癌细胞中CKAP2基因沉默显著降低了其细胞内JAK2 和STAT3 的磷酸化水平,抑制了JAK/STAT 信号通路的激活[16]。动物实验表明,磷酸化JAK2 和STAT3 的表达与RA 模型大鼠损伤程度高度相关[17]。此外,RA中JAK/STAT信号通路持续激活可导致基质金属蛋白酶(MMP)基因表达水平升高,而MMP 可降解关节细胞外基质成分,导致关节软骨病变[18]。且激活JAK/STAT信号通路可阻碍成纤维样滑膜细胞(FLS)生长而促进其凋亡,导致滑膜细胞增生[19]。
本研究中发现,CKAP2在RA 患者中的表达上调,推测其可能参与了RA 的病理过程。GSEA 分析显示,RA 的发生及CKAP2高表达主要与T 淋巴细胞、树状细胞迁移与趋化、B淋巴细胞、抗原加工、CAM及肠道分泌型IgA 免疫作用有关。既往研究表明,树突状细胞、B 淋巴细胞可介导T 淋巴细胞活化,活化的T 淋巴细胞分泌促炎细胞因子引起滑膜炎症,导致关节病理性损伤,促进RA 疾病的进展[20]。CAM 在RA 的发病中起关键作用,其随白细胞浸润到滑膜室中,滑膜微血管中的内皮细胞激活,CAM表达量增加[21]。这些研究结果进一步表明CKAP2 与RA 进展有关,且可能作为其潜在的生物标志物。
通过分析CKAP2与免疫细胞和先天免疫基因的相关性,发现CKAP2的表达与浆细胞、T 淋巴细胞CD8+和CD27呈显著正相关,而与静息记忆T 淋巴细胞CD4+、活化的肥大细胞呈显著负相关。既往研究表明,浆细胞、T 淋巴细胞、肥大细胞和自然杀伤细胞在RA 中起重要作用[20,22]。此外,CD27已被证明可防止T 淋巴细胞凋亡,并在RA 的发生和发展中发挥重要作用[23]。本研究结果表明,CKAP2 与CD27呈强相关,因此推测CKAP2通过上调浆细胞、T 淋巴细胞CD8+、CD27或下调静息的记忆T 淋巴细胞CD4+、活化的肥大细胞来参与RA 的发生、发展。并验证了CKAP2 在MH7A 细胞中的mRNA 和蛋白表达水平与生物信息学分析结果一致,进一步证明了本次分析的可靠性和CKAP2对RA发展的重要性。此外,为寻找治疗RA 的潜在中药,本研究中利用TCMSP 数据库获得了DEGs 相关的中药11 种。这些中药未来均可能被开发为治疗RA的新药。
但本研究也存在一定不足,如初步筛选的所有数据均来源于公共数据库,属回溯性研究,缺乏对其在RA中的作用及其他基因间详细关系的具体研究。
综上所述,CKAP2 可作为RA 早期诊断的候选生物标志物,苍耳子、黄芩、党参等11 种中药对RA 具有潜在治疗作用。本研究可为治疗RA 中药的研发提供新思路。

