基于VEGF/PI3K/AKT 通路探讨消岩汤联合阿帕替尼抑制胃癌MGC-803细胞增殖的作用机制研究*
牟睿宇,,牛潇菲,廖洋,贾春鑫,孔凡铭,郭姗琦,贾英杰
(1.天津中医药大学第一附属医院肿瘤科,天津 300381;2.国家中医针灸临床医学研究中心,天津 300381)
近年来,胃癌的发病率和病死率一直居高不下,中国胃癌发病率与病死率远超过美国[1]。据2020 年全球癌症报告[2]显示,中国胃癌发病率占全球的43.9%,病死率占全球的48.6%,几乎达到了全球胃癌患者的半数。胃癌往往早期症状不显著,多数患者确诊时即为晚期,治疗效果差,预后不佳,手术、放化疗、靶向治疗以及免疫治疗等西医治疗手段虽然能在一定程度上改善患者的生存预后,但仍存在不良反应以及耐药等一系列问题,如何打破目前胃癌临床治疗的瓶颈,提高患者的生存预后是越来越多学者密切关注的问题。中医药作为中华民族的文化瑰宝,在治疗胃癌方面显现出良好的临床疗效及发展前景,中西医相辅相成的综合治疗方式被视为打破胃癌治疗困境的一个突破口。
消岩汤作为天津中医药大学第一附属医院贾英杰教授的经验方,已在临床应用十余年,长期的临床实践显示其治疗气虚毒瘀的恶性肿瘤患者疗效显著。现代药理学研究[3-6]表明,其可有效抑制多种肿瘤细胞的增殖,诱导其凋亡,逆转铂类耐药,从而发挥抗肿瘤疗效。本研究团队前期临床研究[7]显示消岩汤联合阿帕替尼治疗晚期胃癌患者中位生存时间可达6.0 个月,较对照组中位生存时间延长了0.3 个月,在胃癌治疗中显现出良好疗效。但消岩汤的抗胃癌作用机制尚未明确,本研究基于血管内皮生长因子(VEGF)/磷脂酰肌醇3 激酶(PI3K)/丝苏氨酸蛋白激酶(AKT)通路探讨消岩汤联合阿帕替尼治疗胃癌的作用机制研究,为下一步消岩汤在胃癌领域的应用提供了依据和参考。
1 实验材料
1.1 实验细胞 人胃癌MGC-803 细胞,由天津中医药大学第一附属医院肿瘤科实验室冻存。
1.2 实验药品 消岩汤(药物组成:黄芪30 g,郁金10 g,姜黄10 g,太子参15 g,白花蛇舌草10 g,夏枯草10 g,牡蛎15 g)购自天津中医药大学第一附属医院国药堂,严格按照回流提取法进行提取,将其浓缩至生药浓度为1 g/mL 的水煎液,并依次运用0.45 μm和0.22 μm 的无菌微孔滤膜进行过滤除菌;甲磺酸阿帕替尼购自江苏恒瑞医药股份有限公司。
1.3 实验试剂 RPMI 1640 培养基、胎牛血清、胰蛋白酶[不含乙二胺四乙酸(EDTA)],均购自以色列BI 公司;双抗、磷酸盐缓冲液(PBS)、二甲基亚砜(DMSO)、脱氧核糖核酸(DNA)含量检测试剂盒、蛋白上样缓冲液、彩虹180 广谱蛋白Marker、TBST,均购自北京索莱宝科技有限公司;胰蛋白酶(0.25%EDTA),购自美国Gibco 公司;CCK-8 检测试剂盒,购自日本同仁化学研究所;AnnexinV-FITC 细胞凋亡检测试剂盒,购自美国BD 公司;RAPI 裂解液、蛋白酶抑制剂、磷酸酶抑制剂、电泳液、转膜液、封闭液、一抗二抗稀释液、一抗二抗去除液,均购自上海碧云天生物技术有限公司;聚丙烯酰胺凝胶电泳(SDS-PAGE) 凝胶制备试剂盒、BCA 蛋白浓度测定试剂盒、辣根过氧化物酶(HRP)羊抗兔免疫球蛋白G[(IgG),H+L]、HRP 羊抗鼠IgG(H+L)、超特敏ECL化学发光即用型底物,均购自武汉博士德生物工程有限公司;p-PI3K 抗体、p-AKT 抗体,均购自美国CST 公司;血管内皮生长因子A(VEGFA)抗体、血管内皮细胞生长因子受体2 (VEGFR-2) 抗体、Cleaved Caspase -9 抗体、Bcl -2 抗体、Bax 抗体、GAPDH 抗体,均购自Affinity 公司。
1.4 实验仪器 超净工作台(苏州净化设备有限公司);CO2恒温培养箱(美国Thermo 公司);光学显微镜(日本Olympus 公司);台式离心机(长沙湘仪离心机仪器有限公司);台式恒温摇床(天津欧诺仪器股份有限公司);电子天平(上海海康电子仪器厂);多功能酶标仪(美国Thermo 公司);台式高速冷冻离心机(美国Thermo 公司);流式细胞仪(美国BD公司);干式恒温金属浴(美国Thermo 公司);小型垂直电泳槽、小型转印槽、电泳仪电源(美国Bio-Rad 公司);凝胶成像分析系统(德国Jena 公司)。
2 实验方法
2.1 细胞培养 人胃癌MGC-803 细胞使用RPMI 1640 完全培养基[RPMI 1640 培养基+10%胎牛血清(FBS)+1%双抗],5%CO2,37 ℃恒温条件下进行细胞培养,待细胞生长至80%密度时,使用胰酶进行消化,并按1∶4 进行细胞传代。
2.2 CCK-8 检测细胞增殖 消化收集对数生长期的人胃癌MGC-803 细胞并进行细胞计数,将细胞悬液浓度调整为4×104/mL,并将其按4 000 个细胞/孔接种至96 孔板中,静置培养24 h 后分别加入浓度为0、20、40、60、80、100、120 mg/mL 的含药培养基,每个浓度设置4 个复孔,继续静置培养24 h 后加入CCK-8 检测试剂避光孵育1~4 h,使用酶标仪检测每孔在450 nm 处的吸光度,并计算不同浓度消岩汤对人胃癌MGC-803 细胞的生长抑制率:细胞抑制率=[(对照孔吸光度-实验孔吸光度)/(空白对照组吸光度-空白孔吸光度)]×100%。
2.3 流式细胞术检测细胞凋亡 消化收集对数生长期的人胃癌MGC-803 细胞并制备细胞悬液,将其按2×105个细胞/孔接种至六孔板中,静置培养24 h 后分别加入浓度为0、20、40、60 mg/mL 的含药培养基,每个浓度设置3 个复孔,继续静置培养24 h,使用不含EDTA 的胰蛋白酶消化收集细胞,1 000 r/min,离心半径10 cm,离心3 min,PBS 洗2 次,加入1×Binding Buffer 缓冲液将其制备成1×106个细胞/mL 的细胞悬液。在流式管中加入100 μL 的细胞悬液,加入5 μL 的AnnexinV-FITC 染料和5 μL的PI 染料,混匀,避光反应15 min,加入400 μL 1×Binding Buffer 缓冲液,混匀,30 min 内上流式细胞仪进行检测,并使用FlowJo 软件对凋亡数据进行分析。
2.4 流式细胞术检测细胞周期 消化收集对数生长期的人胃癌MGC-803 细胞并制备细胞悬液,将其按2×105个细胞/孔接种至6 孔板中,静置培养24 h 后分别加入浓度为0、20、40、60 mg/mL 的含药培养基,每个浓度设置3 个复孔,继续静置培养24 h 后消化收集细胞,1 000 r/min,离心半径10 cm,离心3 min,PBS 洗2 次,加入预冷的70%乙醇,置于-20 ℃冰箱中固定过夜,4 ℃下1 500 r/min,离心半径20 mm,离心5 min,弃上清液,PBS 洗2 次,彻底去除乙醇,加入100 μL RNaseA 溶液,置于37 ℃恒温水浴锅中30 min,再加入400 μL PI 染色液,4 ℃避光染色30 min。将待测样品转移至流式管中,使用300 目细胞筛网进行过滤,上流式细胞仪进行检测,并使用ModFit 软件对细胞周期数据进行分析。
2.5 蛋白免疫印迹(Western Blot)检测细胞蛋白表达 分别设置空白对照组、消岩汤组(XYT 组,60 mg/mL)、阿帕替尼组(Apatinib 组,40 μmol/L)以及联合用药组(XYT,60 mg/mL+Apatinib,40 μmol/L),加药处理24 h 后收集细胞,每管中加入200 μL 配制好的裂解液(RIPA 裂解液∶蛋白酶抑制剂∶磷酸酶抑制剂=100∶1∶1),置于冰上裂解30 min,4 ℃离心10 min,取上清液,利用BCA 法对蛋白浓度进行检测,并将各组蛋白样本调整为相同浓度,加入等体积的2×蛋白上样缓冲液,混匀,95 ℃变性5 min。将蛋白Maker及各组样品(上样量为40 μg/孔)进行蛋白上样,80 V恒压电泳20~30 min,待溴酚蓝染料跑至分离胶后调整电压为120 V 恒压电泳1.5 h,待溴酚蓝染料跑至凝胶最下缘处停止电泳。按照“三明治”法进行转膜,设置恒流200 mA,1~2 h,转膜完成后,取出PVDF 膜,根据目的蛋白的分子量范围进行剪膜,加入封闭液,封闭30~60 min,1×TBST 洗3 次,加入一抗4 ℃孵育过夜,1×TBST 洗3 次,加入二抗室温孵育1 h,1×TBST 洗3 次。利用凝胶成像系统曝光显影,并使用Image J 软件对不同条带进行光密度分析。对于分子量重合的蛋白条带可利用去除液进行抗体洗脱。
2.6 统计学分析 运用SPSS Statistics 21.0 软件对实验结果进行分析,计量资料数据结果用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD 法。P<0.05 为差异具有统计学意义。
3 实验结果
3.1 消岩汤对人胃癌MGC-803细胞增殖的影响CCK-8的检测结果显示,消岩汤对人胃癌MGC-803 细胞活力具有明显抑制作用,差异具有统计学意义(P<0.05)。不同浓度消岩汤对MGC-803 细胞的抑制率显示,消岩汤呈剂量依赖性抑制MGC-803 细胞的增殖,通过计算得出消岩汤作用于MGC-803 细胞的半抑制浓度(IC50)为63.56 mg/mL。见表1。
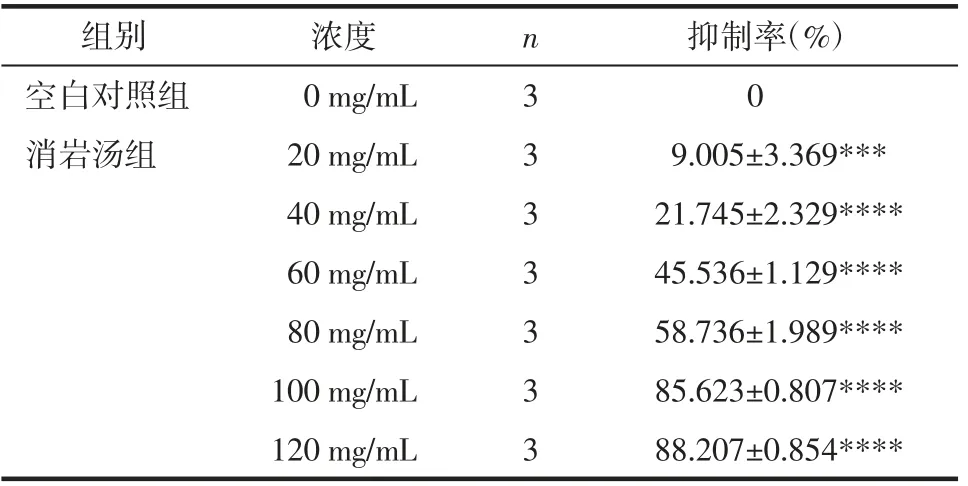
表1 不同浓度消岩汤对MGC-803 细胞影响抑制率Tab.1 Effect of inhibition rate of different concentration of Xiaoyan Decoction on MGC-803 cells
3.2 消岩汤对人胃癌MGC-803 细胞凋亡的影响 细胞凋亡的流式检测结果显示,随着消岩汤浓度的增加,人胃癌MGC-803 细胞的总凋亡率逐渐升高,差异具有统计学意义(P<0.05)。当消岩汤浓度为0、20、40 和60 mg/mL 时,MGC-803 细胞的总凋亡率分别为(4.49 ±0.26)%、(10.26 ±1.32)%、(20.15 ±2.29)% 和(30.01±1.35)%。检测结果表明,消岩汤可显著诱导人胃癌MGC-803 细胞发生凋亡。见图1。
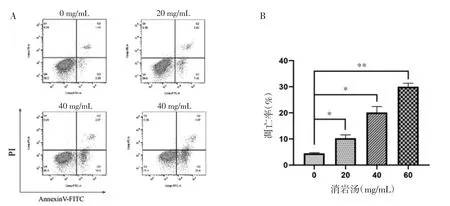
图1 消岩汤对MGC-803 细胞凋亡的影响Fig.1 Effect of Xiaoyan Decoction on apoptosis of MGC-803 cells
3.3 消岩汤对人胃癌MGC-803 细胞周期的影响 细胞周期的流式检测结果显示,随着消岩汤浓度的增加,MGC-803 细胞的G0/G1 期细胞所占百分比逐渐降低,S 期细胞所占百分比逐渐升高,差异均具有统计学意义(P<0.05),G2/M 期细胞所占百分比变化不大,差异无统计学意义(P>0.05)。检测结果表明,消岩汤可诱导人胃癌MGC-803 细胞发生S 期阻滞。见图2。

图2 消岩汤对MGC-803 细胞周期分布的影响Fig.2 Effect of Xiaoyan Decoction on cell cycle distribution of MGC-803
3.4 消岩汤联合阿帕替尼对MGC-803 细胞活力的影响 CCK-8 的结果显示,与空白对照组比较,消岩汤单药组、阿帕替尼单药组以及联合用药组均可明显抑制MGC-803 细胞的活力,差异有统计学意义(P<0.000 1),抑制率分别为(44.918±1.469)%、(37.585±1.869)%和(66.651±1.599)%。与消岩汤单药组和阿帕替尼单药组比较,联合用药组对MGC-803 细胞活力的抑制作用更为明显,且差异有统计学意义(P<0.000 1)。由此可见,消岩汤、阿帕替尼均可有效抑制MGC-803 细胞的生长增殖,与单独用药比较,二者联用的效果更好。见表2。
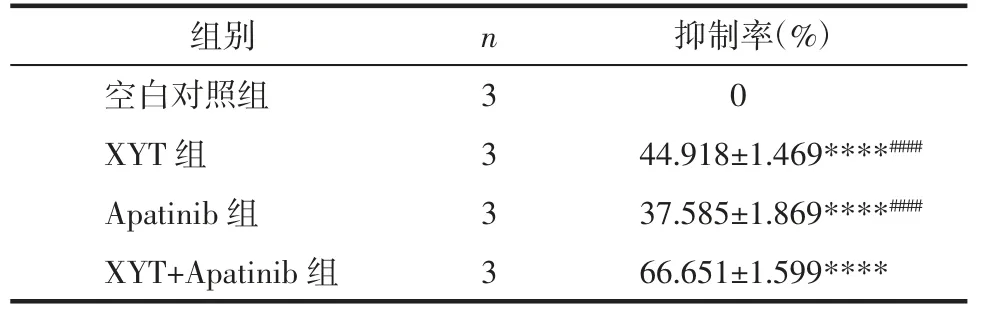
表2 消岩汤联合阿帕替尼对MGC-803 细胞抑制率的影响Tab.2 Effect of inhibition rate of Xiaoyan Decoction combined with apatinib on MGC-803 cells
3.5 消岩汤联合阿帕替尼对人胃癌MGC-803 细胞PI3K/AKT 信号通路蛋白表达的影响 利用Western Blot 检测不同药物组作用于MGC -803 细胞后PI3K/AKT 信号通路蛋白表达的情况,实验结果显示,与空白对照组比较,消岩汤、阿帕替尼及其联合用药组的p-PI3K、p-AKT 以及Bcl-2 蛋白的表达量显著下调,Cleaved Caspase-9 以及Bax 蛋白的表达量显著上调,差异均具有统计学意义(P<0.05)。与消岩汤单药组和阿帕替尼单药组比较,联合用药组对p-PI3K、p-AKT、Bcl-2 蛋白的表达下调更为明显,差异均具有统计学意义(P<0.05);对CleavedCaspase-9蛋白的表达上调也更为显著,差异具有统计学意义(P<0.05)。联合用药组较消岩汤单药组的Bax 蛋白表达有所上调,但差异无统计学意义(P>0.05);较阿帕替尼单药组的Bax 蛋白表达上调显著,且差异具有统计学意义(P<0.05)。见图3。
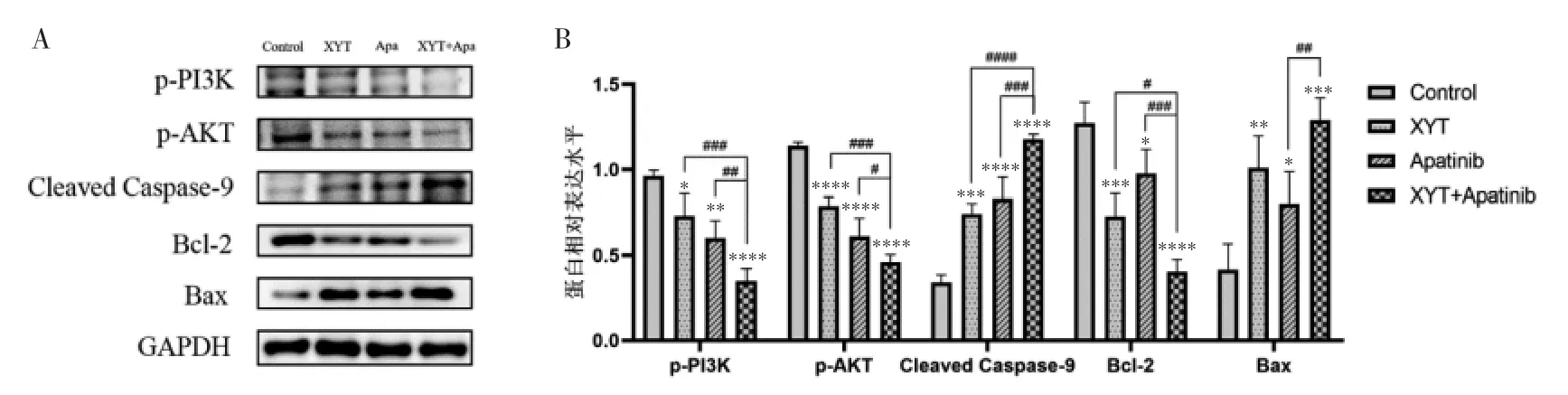
图3 各药物组对MGC-803 细胞PI3K/Akt 通路相关蛋白表达情况的影响Fig.3 Effects of different drug groups on PI3K/Akt pathway related protein expression in MGC-803 cells
3.6 消岩汤联合阿帕替尼对人胃癌MGC-803 细胞血管生成相关指标蛋白表达的影响 利用Western Blot 检测不同药物组作用于MGC-803 细胞血管生成相关指标的蛋白表达情况。结果显示,与空白对照组的VEGFR-2 比较,消岩汤单药组、阿帕替尼单药组以及联合用药组的VEGFA 和VEGFR-2 表达均显著下调,差异均具有统计学意义(P<0.05)。联合用药组较消岩汤单药组的VEGFA 下调水平有统计学差异(P<0.05),较阿帕替尼单药组的VEGFA 下调水平无统计学差异(P>0.05)。相较于两个单药组,联合用药组的VEGFR-2 表达量更低,但差异无统计学意义(P>0.05)。见图4。

图4 各药物组对MGC-803 细胞VEGFA/VEGFR-2 蛋白表达情况的影响Fig.4 Effects of different drug groups on VEGFA/VEGFR-2 protein expression in MGC-803 cells
4 讨论
贾英杰教授认为恶性肿瘤的根本病机为“本元亏虚,癌浊丛生”,其中“正虚”为内因,“癌浊”为诱因,二者贯穿病程始终。基于此,贾英杰教授提出“黜浊培本”[8-9]大法治疗恶性肿瘤,并在“黜浊培本”的理论基础之上,结合现代药理学研究成果以及数年临证经验,自拟经验方“消岩汤”用于治疗气虚毒瘀的恶性肿瘤患者。方中黄芪、太子参益气养阴,扶正抗癌;白花蛇舌草、夏枯草、生牡蛎清热解毒、软坚散结;姜黄、郁金化瘀消癥,疏肝行气,诸药配伍,共奏黜浊培本之效。本团队的前期实验研究发现,消岩汤具有明确的抗肿瘤疗效,可以通过多通路、多靶点、多途径发挥抗肿瘤作用。
胃癌可归属于中医学 “积聚”“反胃”“胃脘痛”“胃痞”等病范畴。现代药理学研究发现,多种中药具有抗肿瘤作用,其中白花蛇舌草[10]可以降低人胃癌MNK-45 细胞线粒体膜电位,从而诱导细胞凋亡;夏枯草[11]可以通过HMGB1 抑制胃癌BGC-823细胞增殖、侵袭与迁移,并诱导其发生凋亡。前期的网络药理学研究表明,消岩汤中的多种活性成分均具有抗胃癌作用,黄芪、白花蛇舌草、夏枯草中含有的活性成分槲皮素[12]可以通过诱导ROS 生成,降低线粒体膜电位,从而诱导人胃癌AGS 细胞发生凋亡。黄芪和夏枯草中含有的活性成分山柰酚[13-14]能有效抑制胃癌MKN-28 和SGC-7901 细胞的增殖,诱导胃癌细胞凋亡,并可以通过IRE1-JNK-CHOP途径诱导胃癌细胞自噬。太子参中含有的活性成分木犀草素[15-16]可以通过调控PI3K-Akt、MAPK、mTOR等多条信号通路,抑制胃癌细胞增殖、侵袭、迁移以及血管生成,促进胃癌细胞凋亡。
本研究以VEGF/PI3K/AKT 信号通路为切入点,从体外层面探究了消岩汤治疗胃癌的机制,研究结果显示,消岩汤能有效下调VEGF/PI3K/AKT信号通路中VEGFA、VEGFR-2、p-PI3K、p-AKT 和Bcl-2 的表达,上调Cleaved Caspase-9 和Bax 的表达,从而诱导胃癌MGC-803 细胞凋亡,抑制血管新生,起到抗肿瘤效果。其中VEGFA[17]是常见的血管生成调控因子,其可与VEGFR-2 受体相结合,从而激活下游多条信号通路介导血管新生,PI3K/AKT 信号通路[18]就是其中之一。PI3K/AKT 信号通路是肿瘤发生发展过程中一条重要的信号通路,其可介导多种肿瘤细胞的增殖、凋亡、周期、侵袭、迁移、免疫微环境以及血管新生等[19-21],本研究对其通路介导的凋亡相关蛋白进行了检测,发现其可抑制Bcl-2 的蛋白表达,促进Cleaved Caspase-9 和Bax 的蛋白表达,从而诱导MGC-803 细胞凋亡。阿帕替尼作为VEGFR-2靶向药物,与消岩汤联用能增加对VEGF/PI3K/AKT信号通路的抑制作用,更好地发挥抗肿瘤效果。此外,本研究对消岩汤对胃癌MGC-803 细胞的增殖和周期还进行了检测,发现消岩汤能有效抑制MGC-803 细胞增殖,诱导S 期阻滞,其具体的作用机制还有待进一步挖掘。中药复方发挥抗肿瘤效果的过程往往是通过多通路、多靶点实现的,本研究仅对VEGF/PI3K/AKT 信号通路进行了探讨,消岩汤是否可以通过其他信号通路发挥抗胃癌效果,同样值得进一步深入研究。