市场鸡沙门氏菌分离鉴定及致病性研究
陈小娇,张 妹,蔡晓庆,康翠翠,郝再翠,毛东有,李滨洲,王全武,陈文平,2*
(1.北京市华都峪口禽业有限责任公司,北京 平谷 101206;2.国家蛋鸡产业技术体系平谷综合试验站,北京 平谷)
沙门氏菌是公共卫生学上具有重要意义的人畜共患病原菌。鸡是沙门氏菌主要的宿主,鸡群感染沙门氏菌后其死亡率高达80%[1]。在家禽养殖场中,常见的鸡沙门氏菌为鸡白痢沙门氏菌、鸡伤寒沙门氏菌和鸡副伤寒沙门氏菌。鸡群一旦感染终身带菌,且会导致鸡群生产性能下降、死亡率增加,种蛋孵化率降低,其危害贯穿于整个饲养周期,给养殖户带来严重的经济损失。临床上广泛应用抗生素治疗沙门氏菌病,然而抗生素的滥用导致细菌对抗生素药物的耐药性越趋严重化,药物选择压力不断增大,已成为严重的公共卫生问题[2]。试验对不同沙门氏菌对鸡的致病性及药物敏感性进行研究,对分离到的菌株进行分离培养和鉴定,同时将分离到的3株菌株接种于1日龄雏鸡,观察鸡只临床发病情况、死亡情况等,探讨不同菌株致病力强弱。同时对鸡沙门氏菌进行体外药敏试验,从而测定该鸡场沙门氏菌的耐药情况,同时筛选出一种效果较好的药物,为鸡沙门氏菌病的合理用药提供参考。
1 材料与方法
1.1 材料
1.1.1 病料来源 病料来源于市场3个不同场区发病鸡只。
1.1.2 试剂和仪器 亚硒酸盐胱氨酸增菌液(SC)、胆硫乳琼脂(DHL)购自北京陆桥技术有限责任公司;病毒基因组DNA/RNA提取试剂盒购自宝生物工程(大连)有限公司;沙门氏菌引物由生工生物工程(上海)股份有限公司合成;电热恒温培养箱购自上海一恒科学仪器有限公司;超净工作台购自北京亚泰科隆仪器技术有限公司;PCR扩增仪购自美国Eppendorf公司;DYY-6C型电泳仪购自北京市六一仪器厂;凝胶电泳成像系统购自上海勤翔科学仪器有限公司。
1.1.3 试验动物 试验鸡群为京红1号商品代1日龄雏鸡,由北京市华都峪口禽业有限责任公司无沙门氏菌发病史和免疫史场区提供。
1.2 方法
1.2.1 沙门氏菌的分离鉴定 将送检的病料分别接种于普通肉汤中,置于36±1 ℃恒温培养箱中培养16~18 h;从中吸取1 mL接种于亚硒酸盐胱氨酸增菌液中,置于36±1 ℃ 恒温培养箱中培养18~24 h;用接种环从亚硒酸盐胱氨酸增菌液中蘸取菌液划线接种于胆硫乳琼脂(DHL)培养基中,置于36±1 ℃ 恒温培养箱中培养16~18 h,观察菌落形态。
1.2.2 分子鉴定 根据沙门氏菌stn基因核苷酸序列设计引物[3],由上海生工生物工程公司合成。扩增产物长度为260 bp,引物如下:stn-F: 5'-CTTTGGTCGTAAAATAAG GCG- 3 ',stn-R: 5 '-TGCCCAAAGCAGAGAGATTC-3'。
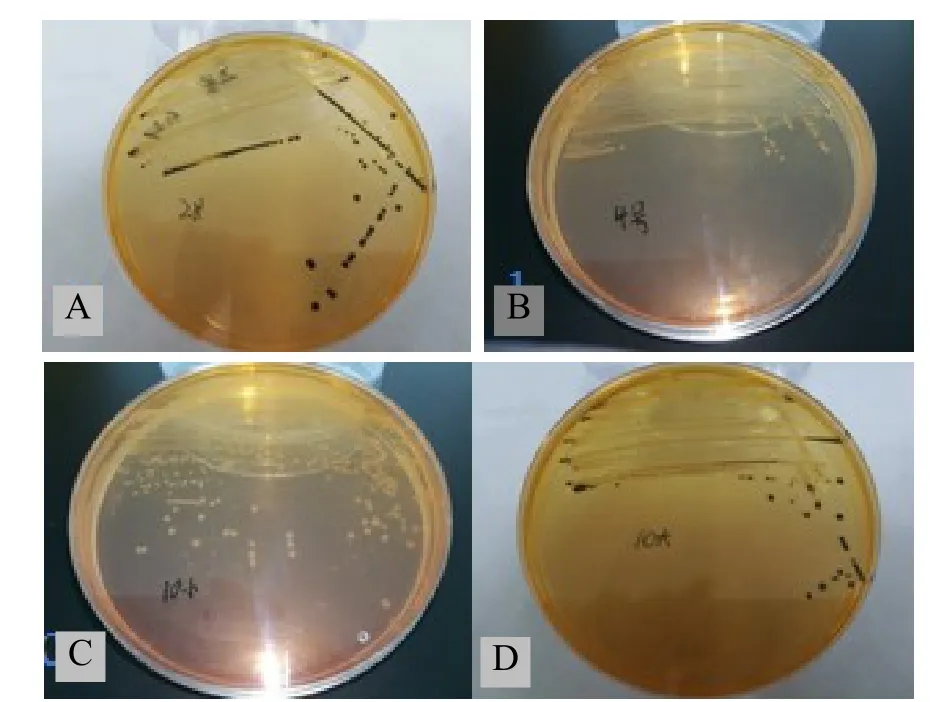
图1 细菌分离图A. 病料1纯化菌落;B. 病料2纯化菌落;C、D. 病料3纯化菌落。
参照大连宝生物病毒基因组DNA/RNA提取试剂盒方法提取核酸,用上述引物进行PCR鉴定,反应体系为25 μL:2×Taq Plus Master Mix(Dye Plus)12.5 μL,Forward primer(25 mmol/L)5×0.5 μL,Reverse primer(25 mmol/L)5×0.5 μL,DNA模板2 μL,超纯水5.5 μL。反应条件:94 ℃ 预变性5 min;94 ℃ 变性1 min;55 ℃ 退火1 min;72 ℃ 延伸1 min;共25个循环,最后72 ℃ 延伸10 min;4 ℃ 保存。取 PCR产物7 μL置于1%琼脂糖凝胶中进行电泳,结束后置于凝胶成像系统中观察结果。将阳性扩增产物送至北京生工生物工程技术服务有限公司进行测序,测序结果提交NCBI BLAST进行比对分析。
1.2.3 动物感染试验 为更好地模拟发病鸡群症状,将1日龄健康雏鸡80只随机分为4组,每组20只。试验1~3组鸡群分别灌胃从各组发病鸡群中分离出的菌液0.1 mL(4×107CFU/mL)。对照组灌胃0.1 mL生理盐水。鸡群自由饮水、采食,观察其发病及死亡情况,对死亡雏鸡立即进行剖检,观察各脏器变化。
1.2.4 药敏实验 将分离的菌株按照CLSI[4]推荐的K-B法对6种抗生素进行药物敏感性检测,丁胺卡那、恩诺沙星、强力霉素、氧氟沙星、林可霉素、新霉素。将上述分离菌株接于营养肉汤中,37 ℃ 培养24 h后,用无菌棉签蘸取菌液均匀涂布于营养琼脂平板上,将制备好的药敏片贴于营养琼脂平板上,36±1 ℃ 恒温培养18~24 h后用直尺测量抑菌圈直径。
2 结果
2.1 沙门氏菌的分离培养结果 选择性增菌培养后,挑取疑似沙门氏菌菌落纯化于DHL培养基中,病料1分离菌株为无色半透明菌落,菌落中心几乎全黑,将其命名为A菌;病料2分离菌株为无色半透明菌落,将其命名为B菌;病料3分离菌株出现两种疑似沙门氏菌形态的菌落,分别挑取纯化,发现均为无色半透明菌落,一种菌落中心几乎全黑,将其命名为C菌;一种菌落无黑色,其命名为D菌(图1)。
2.2 分子鉴定及基因测序检测结果
将分离到的4株菌进行DNA提取后进行普通PCR鉴定,如图2所示,4株菌均为沙门氏菌。将扩增产物送检至生工生物进行测序,经对比后确定4种菌株均为沙门氏菌,其中菌株B和C1为鸡白痢沙门氏菌,菌株A和C2为非鸡白痢沙门氏菌。
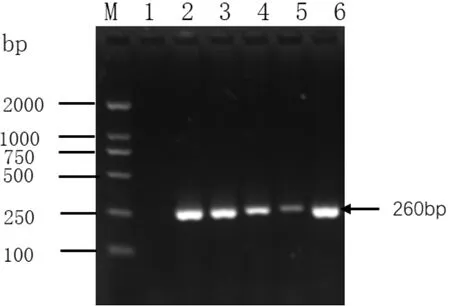
图2 各分离菌株沙门氏菌PCR扩增电泳图M为DL2000 DNA Marker;1.阴性对照;2. 阳性对照;3. 病料1纯化菌落;4. 病料2纯化菌落;5、6. 病料3纯化菌落。
2.3 动物感染试验结果
选择同批次试验鸡群剖检后采集肝脏进行病原分离,无沙门氏菌检出。试验1组鸡群灌胃A菌,试验2组鸡只灌胃B菌,试验3组鸡只灌胃C1和C2混合菌,比例为1:1。
2.3.1 感染后鸡群临床现象及死亡情况 从临床现象看,鸡只感染后24 h,试验组鸡群均出现精神沉郁现象,与对照组相比,攻毒后48~72 h试验组鸡群粪便稀薄;感染后72~96 h后试验鸡只排血便。
从感染后鸡群各时间段累计死亡率结果看,鸡白痢标准菌株死亡率达50%~55%,非鸡白痢标准菌株死亡率达到30%;攻毒后120 h鸡白痢菌株死亡率达到100%,非鸡白痢标准菌株死亡率达到60%,120~264 h非鸡白痢标准菌株死亡率达到70%,见表1。
2.3.2 死亡鸡只剖检症状 对死亡鸡只进行剖检,试验1组鸡只剖检心尖有不同程度白色硬化,肝脏为土黄色,肝脏、脾脏有坏死点,脾脏和胆囊肿大、直肠胀气、有出血点;试验2组鸡只肝脏有出血点,脾脏肿大,肾肿大,胆囊充血;试验3组鸡只剖检情况与试验1组相似,心尖有不同程度白色硬化,肝脏呈土黄色,肝脏和脾脏有坏死点,胆囊及直肠充血。心尖不同程度白色硬化、脾脏肿大、肝脏有坏死点、肠道胀气及有出血点,剖检图片见图3。
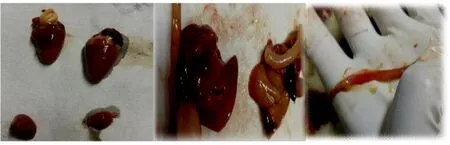
图3 临床剖检图
2.4 药敏实验
药敏试验结果显示,3组分离菌株均对丁胺卡那、林可霉素类抗生素药物敏感,对氧氟沙星、强力霉素、恩诺沙星耐药(表2)。
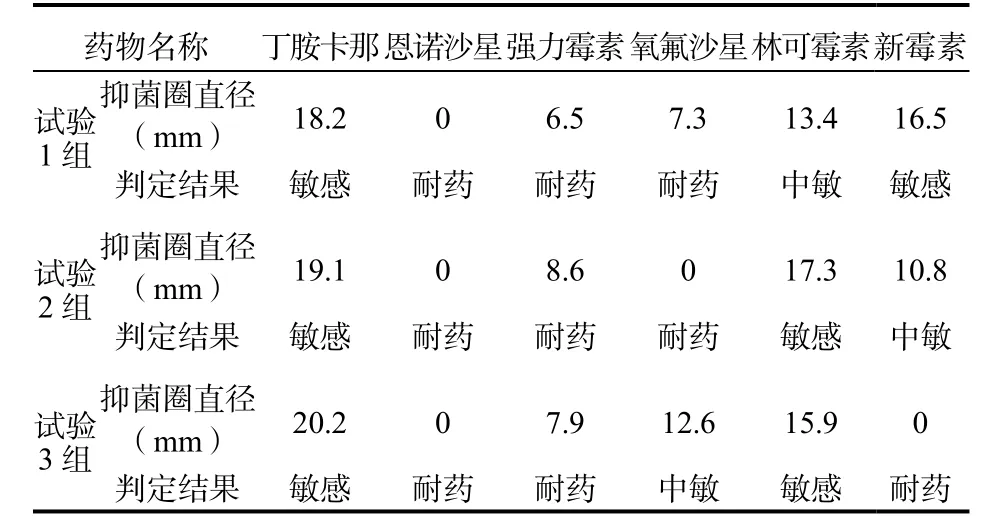
表2 分离株药敏结果
3 讨论
沙门氏菌的致病能力取决于细菌的致病力和宿主的易感性[5]。沙门氏菌均有致病性,该菌感染不同畜禽可导致多种不同疾病,每种疾病的临床症状表现出多样性,受到许多因素的影响,如菌株毒力、品种、日龄、环境刺激等。本实验模拟鸡只发病情况,发现鸡白痢标准菌株致死率较高,鸡群感染后集中死亡,死亡速度较快,而非鸡白痢标准菌株致死率低于鸡白痢标准菌株,死亡时间比鸡白痢标准菌株晚。本实验结果表明,鸡白痢标准菌株对鸡的致病力强,而其他沙门氏属对鸡的致病力相对较弱,与市场反馈情况一致。如果鸡群发生沙门氏菌疾病,建议使用丁胺卡那、林可霉素药物治疗效果较好。
沙门氏菌是鸡肠道菌群中的传染病病原菌之一,养鸡行业处于广泛使用抗菌药物和不规范使用的现状,导致其耐药性变得越来越严重,导致耐药和多重耐药问题的出现和传播,严重限制了鸡沙门氏菌的有效治疗。本试验分离的3株沙门氏菌对丁胺卡那、林可霉素类抗生素药物敏感,对氧氟沙星、恩诺沙星抗生素药物低敏感或不敏感,后续可利用敏感药物对商品代雏鸡沙门氏菌病进行防控。耐药性的常规监测,不仅有助于沙门氏菌的防控措施的实施,且对于细菌耐药性的问题具有重要的意义。该试验为鸡沙门氏菌病临诊药物的选择提供参考,用药应依据药敏试验结果确定首选药物,为避免耐药性的发生或延长药物使用的有效性,建议选择2~3种敏感药物进行预防与治疗。
4 结论
动物沙门氏菌病是长期以来危害我国畜牧业的重要疫病,是国家中长期动物疫病防治规划优先防治的病种。沙门氏菌均有致病性,而鸡沙门氏菌病的临床症状差异较大,这取决于感染鸡的细菌的血清型,其中鸡白痢沙门氏菌和鸡伤寒沙门氏菌具有专嗜性,仅使鸡和火鸡发病。本研究进一步验证,标准鸡白痢标准菌株比非鸡白痢沙门氏菌对鸡的致病力强,鸡群攻毒后非鸡白痢鸡伤寒沙门氏菌比标准鸡白痢鸡伤寒沙门氏菌发病时间、感染时间要推迟1天。通过药敏试验进一步扩展了对于鸡沙门氏菌耐药谱以及耐药严重程度的认识,同时筛选出对其不同菌株有效的药物,对于鸡沙门氏菌起到治疗效果,为疾病的防控与治疗提供参考。

