基于网络药理学方法、分子对接技术及动物实验验证探讨通塞颗粒治疗慢性阻塞性肺疾病急性加重期的作用机制
付子坚,李建生,田燕歌,赵鹏,燕苗苗,芦晓帆
1. 河南中医药大学第二临床医学院,河南 郑州 450011
2. 河南中医药大学呼吸系统疾病重点实验室,河南 郑州 450046
3. 河南中医药大学第一临床医学院,河南 郑州 450046
慢性阻塞性肺疾病(COPD)是一种以呼吸道持续气流受限为特征的进行性发展的肺部疾病,其肺部症状急性恶化阶段又被称为COPD 急性加重期(AECOPD)。感染是AECOPD 最主要的诱因,是造成COPD 患者肺功能恶化和气道重塑的关键因素,也是导致患者死亡的重要原因。AECOPD 归属于中医学肺胀范畴。有学者对AECOPD 中医证候分布规律进行文献研究与临床调查研究,得出痰热壅肺型为AECOPD 的最常见证型[1-2]。通塞颗粒是河南中医药大学第一附属医院的院内制剂,由葶苈子、地龙、浙贝母等组成,具有清热涤痰活血、宣肺降气平喘等作用。经临床研究证实,该药物治疗痰热壅肺型AECOPD 具有良好疗效,可以有效改善患者的通气功能和血气分析结果,减少肺部炎症,促进炎性分泌物的吸收[3-4]。团队前期研究表明,通塞颗粒-补肺益肾方序贯治疗AECOPD 可有效减轻急性炎症渗出、改善AECOPD 大鼠肺组织病理损伤,且其作用机制与调控Toll 样受体4(TLR4)/核因子-κB(NF-κB)信号通路有关[5-6]。本研究在此基础上运用网络药理学和分子对接技术,通过构建中药复方调控网络,筛选出通塞颗粒治疗AECOPD 的潜在靶标,并对富集分析出的通路及关键蛋白加以实验验证,为后续研究提供新思路。具体研究流程如图1 所示。
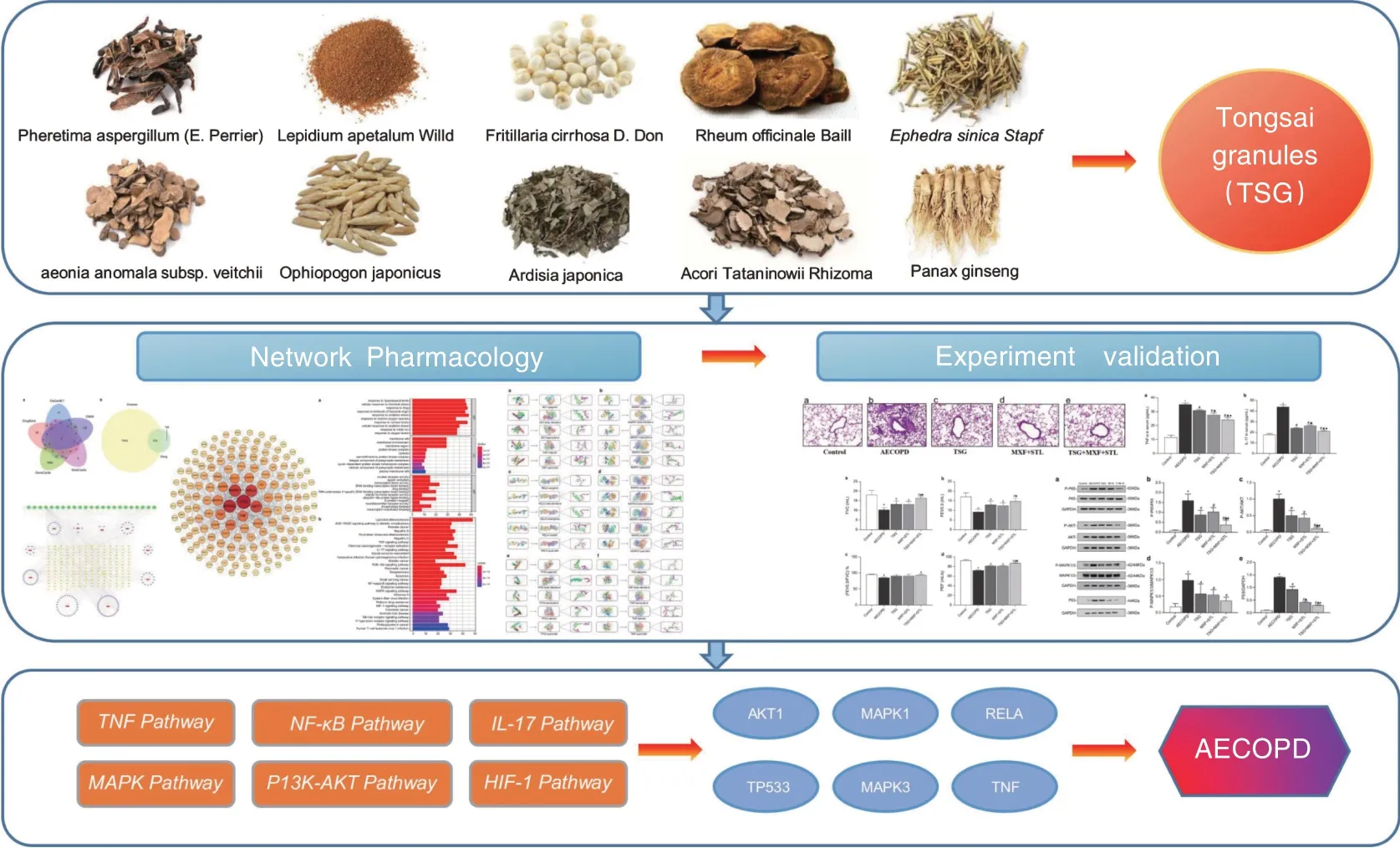
图1 研究流程示意图
1 实验材料
1.1 实验动物SPF 级SD 大鼠50 只,雄性,6~8 周龄,体质量(200±20)g,动物质量合格证号:110011211105823815,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0011。动物饲养于河南中医药大学动物实验室[SYXK(豫)2020-0004]。本研究通过河南中医药大学实验动物福利伦理审查委员会审查批准(伦理审查批号为YFYDW2021028)。
1.2 药物、试剂及仪器
1.2.1 药物通塞颗粒(河南中医药大学第一附属医院院内制剂),盐酸莫西沙星片(拜耳医药保健有限公司,国药准字J20150015,规格:0.4 g×3 片),硫酸沙丁胺醇片(江苏亚邦爱普森药业有限公司,国药准字H32024535,规格:2mg×100 片)。
1.2.2 试剂肺炎克雷伯杆菌(46117-5a1),购于中国医学细菌保藏管理中心(CMCC);红旗渠过滤嘴烤烟型香烟(河南中烟工业有限责任公司);苏木素-伊红(HE)染液套装(Servicebio 武汉赛维尔生物科技有限公司);大鼠肿瘤坏死因子-α(TNF-α)酶联免疫吸附法(ELISA)试剂盒(ELISA Kit)、大鼠白细胞介素-17A(IL-17A)ELISA Kit 均购自武汉伊莱瑞特生物科技股份有限公司;NF-κB P65 抗体(以下简写为P65)(货号:GTX102090)、NF-κB P65(phospho Ser536)抗体(以下简写为 P -P65)(货号:GTX133899),丝氨酸/苏氨酸蛋白激酶B(AKT)抗体[N3C2], Internal(以下简写为 AKT)(货号:GTX121937),AKT(phospho Ser473)抗体(以下简写为P-AKT)(货号:GTX128414)、兔抗丝裂原活化蛋白激酶1(MAPK1)/丝裂原活化蛋白激酶3(MAPK3)多克隆抗体[细胞外调节蛋白激酶(ERK1/2),以下简写为MAPK1/3](货号:GTX134462)、ERK1(phospho Thr202/Tyr204)+ERK2(phospho Thr185/Tyr187)抗体[HL173](以下简写为P-MAPK1/3)(货号:GTX635617)、甘油醛-3-磷酸脱氢酶(GAPDH)抗体(货号:GTX28245)均购自美国GENETEX,INC.;肿瘤抑制蛋白53(TP53)抗体(货号:YT3528)购自美国ImmunoWay Biotechnology Company;辣根过氧化物酶(HRP)标记山羊抗鼠二抗(货号:SA00001-1)、HRP 标记山羊抗兔二抗(货号:SA00001-2)均购于武汉三鹰技术有限公司。RIPA 裂解液(货号:20-188)购自美国EMD MILLIPORE CORPORATION;BCA 试剂盒(货号:PC0020)购自北京索莱宝科技有限公司;10%SDS-PAGE 电泳凝胶试剂盒(货号:PG112)购自上海雅酶生物医药科技有限公司。
1.2.3 仪器DSI Buxco 非束缚小动物肺功能测量仪及FinePointe 动物肺功能检测系统(DATA SCIENCES INTERNATIONAL,INC.,美国);Multiskan GO 全波长酶标仪及D-37520 台式高速冷冻离心机(赛默飞科技中国有限公司);TissueLyser Ⅱ样品破碎系统(QIAGEN,德国);DM6000 B 光学显微镜及LAS V4.7 照相系统(Leica,德国);Image-pro plus(IPP)6.0 专业图像分析系统(Media Cybernetics,美国)。
2 研究方法
2.1 数据库与软件①数据库:中药系统药理学数据库和分析平台(TCMSP)(https://old.tcmsp-e.com/tcmsp.php)、中药化学数据库(http://www.organchem.csdb.cn/scdb/default.htm)、蛋白质数据库(UniProt)(https://www.uniprot.org/)、人类基因(GeneCards)数据库(https://www.genecards.org/)、在线人类孟德尔遗传数据系统(OMIM)数据库(https://www.omim.org/)、人类疾病相关基因(DisGeNET)数据库(https://www.disgenet.org/)、人类疾病(MalaCards)数据库(https://www.malacards. org/)、 DrugBank 数据库(https://go.drugbank.com/)、微生信在线生物信息学分析、可视化云平台(http://www. bioinformatics. com. cn/)、STRING 数据库(https://cn.string-db.org/)、蛋白质结构数据库(RSCB PDB)(https://www.rcsb.org/)、有机小分子生物活性数据(Pub-chem)数据库(https://pubchem.ncbi.nlm.nih.gov/)。②软件:Cytoscape 3.8.1软件,R 4.1.3 软件,ChemoBio 3D Ultra 17.0 软件;Pymol 软件,AutoDockTool 1.5.6 软件,Vina 软件。
2.2 通塞颗粒活性成分和其对应靶点筛选将通塞颗粒中的10 味中药(矮地茶、赤芍、大黄、地龙、麻黄、麦冬、人参、石菖蒲、葶苈子、浙贝母)分别录入TCMSP 数据库,根据TCMSP 参数信息,将口服利用度(OB)≥20% 且类药性质(DL)≥0.1 作为筛选标准,获取各中药活性成分及其对应靶点,并从Uniprot 数据库对靶点名称进行注释,转换为基因编号ID(Gene Symbol ID)。其中地龙、麦冬2 味中药并未被TCMSP 数据库收录,将其录入中药化学数据库,获得2 味中药的化学成分物质数字识别号码(CAS 号),再从TCMSP 数据库根据参数信息,将OB≥20%且DL≥0.1%作为筛选标准,进一步筛选。
2.3 疾病基因筛选以“acute exacerbation of chronic obstructive pulmonary disease”为关键词,通过GeneCards、 OMIM、 DisGeNET、 MalaCards、 Drug-Bank 5 个数据库,检索获取与AECOPD 相关的基因。
2.4 共同靶点获取和网络图的绘制通过微生信在线生物信息学分析、可视化云平台绘制韦恩图(Venn图),获得通塞颗粒治疗AECOPD 的交集靶点。将相关数据导入Cytoscape 3.8.1 软件构建中药-有效成分-靶点-疾病网络图,并根据网络图平均度值(degree值)筛选出核心活性成分。
2.5 蛋白质相互作用(PPI)网络构建及核心靶点筛选将2.4 项中筛选得到的交集靶点信息导入STRING 数据库,从多种蛋白质(multiple proteins)中导入选中靶点,有机体(organism)选为“智人(homo sapiens)”,以最高置信度(highest confidence)>0.900作为筛选条件,下载交集靶点的PPI 网络TSV 文件。将下载文件导入Cytoscape 3.8.1 软件构建PPI 网络图,根据平均度值(degree 值)和平均中介中心度值(betweenness 值)筛选核心靶点。
2.6 相关通路富集分析运用R 语言软件中的“org.Hs.eg.db”数据包将核心靶点转化为基因ID,导入R 4.1.3 软件,设定P-value<0.05、Q-value<0.05,利用“BiocManager”等软件包对关键节点进行基因本体(GO)富集分析和京都基因与基因组百科全书(KEGG)通路富集分析,取前30 项构建柱状图。并将KEGG 通路富集分析得到的数据导入Cytoscape 3.8.1软件进一步构建靶点-通路网络图。
2.7 关键活性成分与核心靶点分子对接将2.4、2.5 项中degree 值排在前5 的活性成分和degree 值排在前6 的核心靶点分别进行对接。将活性成分的英文名称导入Pub-chem 数据库,下载其相应的小分子配体(2D 结构,sdf 格式),使用ChemoBio 3D Ultra 17.0 软件转格式(3D 结构,mol2 格式);将核心靶点导入Uniport 数据库,限定物质来源设定为homo sapiens,将得到的条目导入RSCB PDB 数据库,下载其相应的基因蛋白(3D 结构,pdb 格式),利用AutoDockTool 1.5.6 软件去水加氢转格式(3D 结构,pdbqt 格式),并设置保存活性口袋的数据参数(grid.gpf 格式)。运用Vina 软件对活性成分和核心靶点进行分子对接,结果通过Pymol 软件进行可视化展示。
2.8 通塞颗粒治疗AECOPD 网络药理学实验验证
2.8.1 模型制备与分组干预采用随机数字表法将50 只大鼠随机分为对照组、模型组、中药组、西药组、联合组。每组10 只。除对照组外,其余各组通过香烟和肺炎克雷伯杆菌刺激诱导制备AECOPD大鼠模型[7-8]。并于急性加重前2 d(Day-1、0)及其后4 d(Day 2~5)给予灌胃治疗,每天2 次。药物灌胃剂量采用等效剂量系数换算公式计算,具体公式为:D大鼠=D人×(HI大鼠/HI人)×(W大鼠/W人)2/3(其中D:剂量;HI:体型系数;W:体质量),具体给药方案见表1。对照组、模型组均予同体积0.9%氯化钠溶液。

表1 各组大鼠给药方案
2.8.2 肺功能检测治疗结束后,用DSI Buxco 非束缚小动物肺功能测量仪以及FinePointe 动物肺功能检测系统检测大鼠的肺功能指标,包括0.3 s 用力呼气容积(FEV0.3)、用力肺活量(FVC)、0.3 s 用力呼气容积与用力肺活量的比值(FEV0.3/FVC)、呼气流量峰值(PEF)。
2.8.3 血清TNF-α、IL-17 含量麻醉大鼠,腹主动脉取血。取上清,采用ELISA 法检测血清中TNF-α、IL-17 的含量。
2.8.4 肺组织病理形态学观察处死大鼠后,结扎未灌洗的左肺,取肺组织,经脱水、透明、浸蜡、包埋、切片后进行HE 染色并封片,在光学显微镜100 倍及200 倍光镜下观察切片。
2.8.5 肺组织中P-P65、P65、P-AKT、AKT、PMAPK1/3、MAPK1/3 以及TP53 的蛋白表达在肺组织中加入RIPA 裂解液,剪碎打成匀浆,用离心机离心后提取蛋白质,通过BCA 试剂盒经全波长酶标仪进行蛋白质定量,经10% SDS-PAGE 电泳凝胶分离,转膜、封闭、抗体孵育后,用IPP 6.0 专业图像分析系统进行条带扫描,测定各目的条带及内参GAPDH 的灰度值,计算比值,求得目的蛋白的相对表达含量。
3 统计学方法
应用SPSS 22.0 软件统计数据。计量资料数据服从正态分布,以均数±标准差(±s)表示,多组间比较采用单因素方差分析。方差齐时,多重比较采用LSD 法;方差不齐时,多重比较采用Dunnett T3 法。计量资料数据不服从正态分布,则采用非参数检验进行比较。P<0.05 表示差异有统计学意义。
4 研究结果
4.1 通塞颗粒活性成分及其预测靶点筛选通过TCMSP 数据库收集、基于药物代谢动力学(ADME)参数(OB≥20%、DL≥0.1)筛选出通塞颗粒的活性成分共219 个,对应预测靶点1 351 个,删去在UniProt 数据库中不能匹配基因名的靶点,去重后,获得通塞颗粒有效成分172 个,对应预测靶点306 个。各中药的活性成分个数和其对应的靶点个数见表2。部分中药活性成分名称见表3。

表2 通塞颗粒活性成分个数和靶点个数(去重)
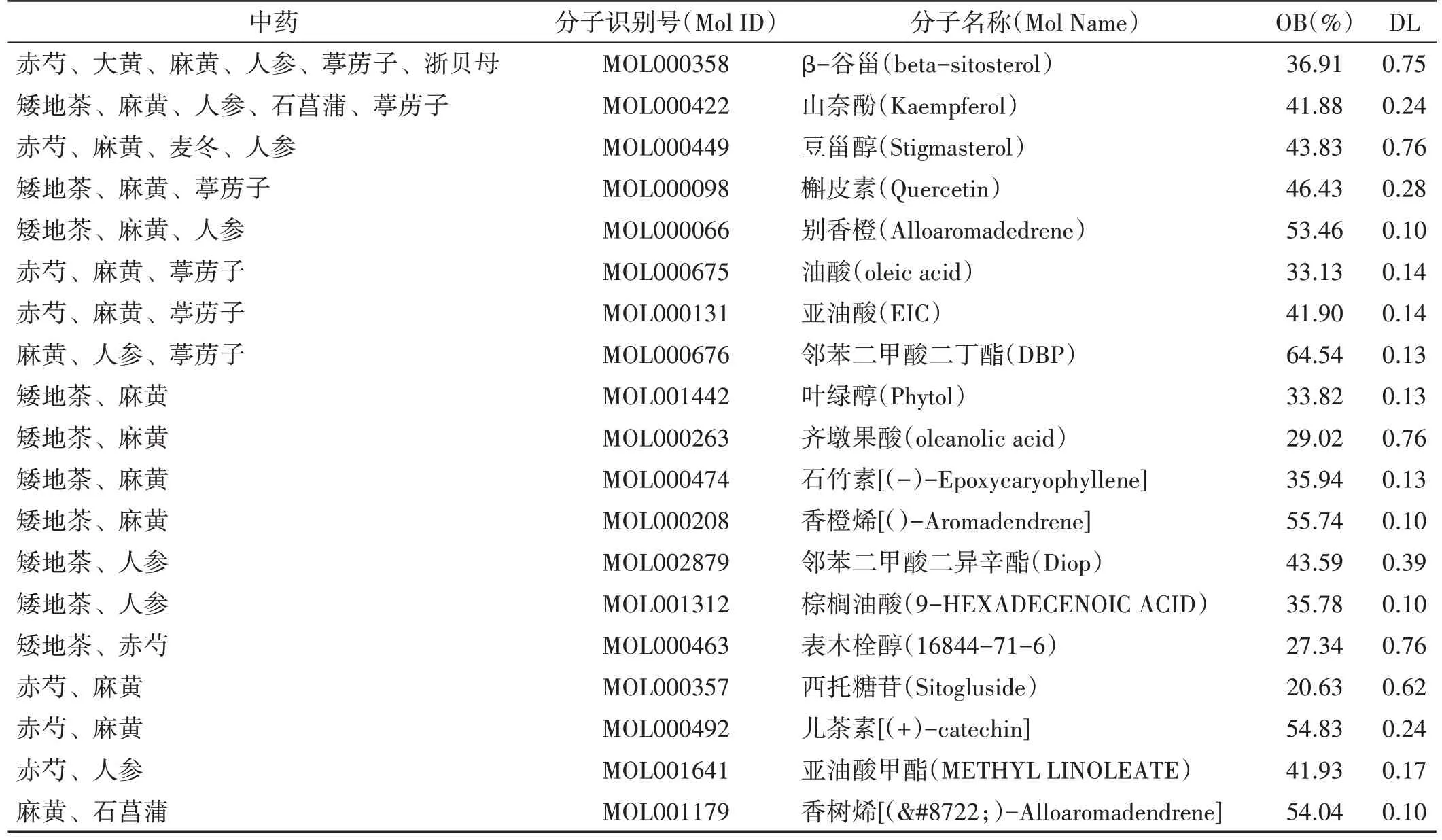
表3 通塞颗粒治疗AECOPD 的活性成分名称
4.2 AECOPD 疾病靶点收集将从各数据库检索AECOPD 英文全称获取的疾病相关靶点与通塞颗粒的预测靶点结合,基于微生信在线生物学分析、可视化平台制图分析。数据库疾病靶点个数:GeneCard 数据库1 993 个,OMIM 数据库173 个,DrugBank 数据库42 个,DisGeNET 数据库63 个,MalaCards 数据库97 个,见图2。通塞颗粒与AECOPD 的交集靶点共200 个,见图3。
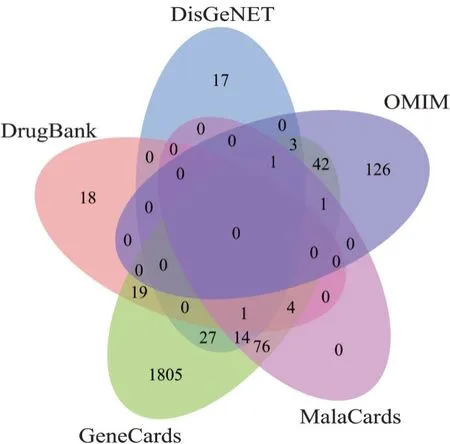
图2 AECOPD 疾病相关靶点Venn 图
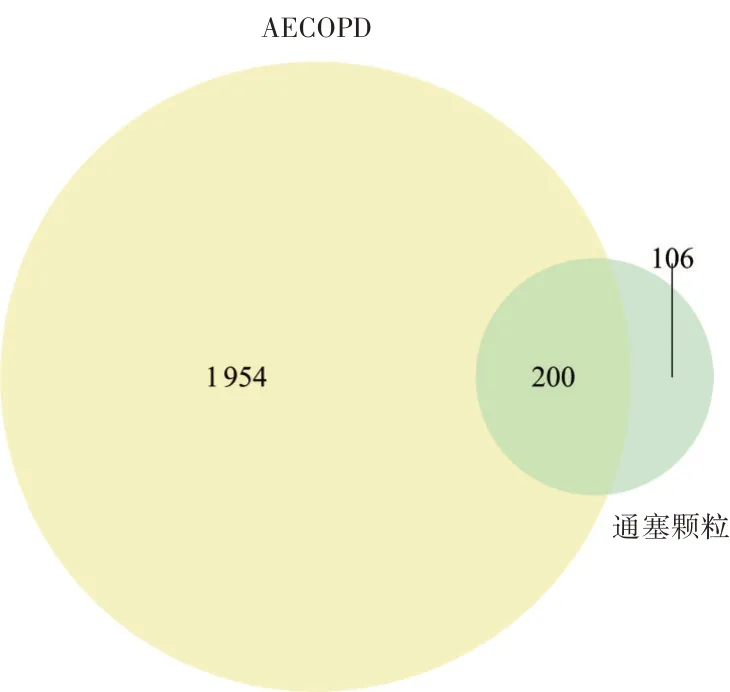
图3 通塞颗粒-AECOPD 靶点交集Venn 图
4.3 通塞颗粒活性成分与AECOPD 交集靶点网络构建使用Cytoscape 3.8.1 软件构建通塞颗粒的活性成分与AECOPD 交集靶点的关系网络图(见图4)。在网络中通过degree 值和betweenness 值筛选得到前5 名关键活性成分,分别为槲皮素、芹菜素、木犀草素、山奈酚、β-谷甾醇,见表4。
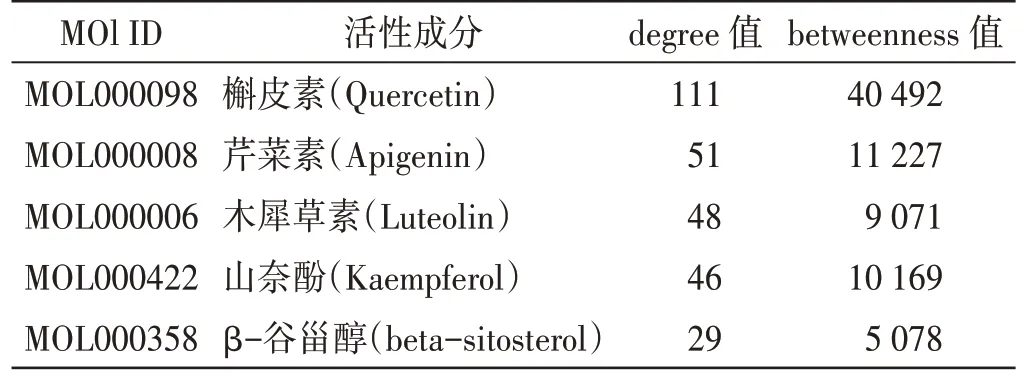
表4 关键活性成分筛选

图4 通塞颗粒活性成分-AECOPD 交集靶点网络图
4.4 核心靶点筛选将从STRING 数据库筛选得到的162 个交集靶点信息导入Cytoscape 3.8.1 软件进行处理,其PPI 关系见图5。将靶点根据degree 值和betweenness 值的大小进行排列,最终筛选得到前6 名核心靶点,分别为TP53、MAPK3、MAPK1、RELA 原癌基因(RELA)、丝氨酸/苏氨酸蛋白激酶1(AKT1)、肿瘤坏死因子(TNF),见表5。

表5 核心靶点筛选

图5 中药-疾病共同靶点PPI 网络图
4.5 GO 富集分析及KEGG 通路富集分析将交集靶点进行GO 富集分析和KEGG 通路富集分析。GO富集分析:将“P-value<0.05、Q-value<0.05”作为筛选条件,得到总条目2 883 个,其中生物过程(BP)2 566 条,细胞组成(CC)108 条,分子功能(MF)209条,每组选取前10 条生成可视化三合一柱状图,见图6。

图6 GO 富集分析柱状图
KEGG 通路富集分析:关键靶点富集在178 条通路上,根据P值和Q值排序,选取前30 条绘制柱状图,见图7。查阅文献并结合P值和Q值,筛选出与AECOPD 密切相关的TNF、IL-17、MAPK、NF-κB、磷脂酰肌醇3-激酶(P13K)-AKT、缺氧诱导因子1(HIF-1)通路,见图8。

图8 交集靶点-信号通路图
4.6 分子对接将关键活性成分槲皮素、芹菜素、木犀草素、山奈酚、β-谷甾醇与核心靶点TP53、MAPK3、MAPK1、RELA、AKT1、TNF 进行分子对接。结合能(Binding energy)体现配体与受体之间结合的可能性,能值越低表示配体与受体之间亲和力越高,构象越稳定,在自然状态下更易结合。结合能<-5.0 kcal/mol 表明有较好的结合活性;结合能<-7.0 kcal/mol 表明具有强烈的结合活性[9]。结果显示,对接均具有较好的结合活性,见图9。具体分子对接见图10。

图9 分子对接自由结合能热图

图10 中药关键活性成分与核心靶点对接图
4.7 动物实验验证结果
4.7.1 各组大鼠肺组织病理表现对照组大鼠:支气管结构基本完整,肺血管壁未见明显增厚,肺泡结构基本完整,少量散在的炎性细胞浸润。模型组大鼠:支气管上皮细胞脱落,杯状细胞增生,大量炎性细胞浸润,肺血管壁增厚,肺泡间隔变窄并断裂,融合成较大的囊腔。中药组大鼠:支气管结构的破坏、炎性细胞的浸润、肺泡间的融合均较用药前改善,但肺血管壁仍可见明显增厚。西药组大鼠:支气管病理学变化与中药组相当。联合组大鼠:支气管上皮细胞的破坏程度较模型组明显减轻,肺血管壁轻微增厚,炎性细胞的浸润及肺泡融合扩张明显改善,治疗效果最好。见图11。
4.7.2 各组大鼠肺功能指标比较见表6。模型组FVC、FEV0.3、FEV0.3/FVC、PEF 值均较对照组降低(P<0.05)。中药组、西药组以及联合组的FVC、FEV0.3、PEF 值均较模型组升高(P<0.05);联合组FEV0.3/FVC 值较模型组升高(P<0.05)。中药组FVC、FEV0.3、FEV0.3/FVC、PEF 值与西药组比较,差异均无统计学意义(P>0.05)。联合组FVC、PEF 值均较中药组及西药组升高(P<0.05);联合组FEV0.3较西药组升高(P<0.05)。
表6 各组大鼠肺功能指标比较(±s)
注:①与对照组比较,P<0.05;②与模型组比较,P<0.05;③与中药组比较,P<0.05;④与西药组比较,P<0.05
样本量组 别对照组模型组中药组西药组联合组6 6 6 6 6 FVC(mL)18.03±2.24 10.23±1.40①13.07±1.86①②13.10±1.38①②16.28±0.97②③④FEV0.3(mL)17.13±1.96 9.16±1.40①12.83±1.98①②12.47±1.46①②14.71±1.80①②④FEV0.3/FVC(%)95.55±1.01 85.08±1.61①90.77±4.03 90.44±5.94 93.50±2.82②PEF(mL/s)92.10±2.77 71.59±1.19①81.19±0.89①②80.96±1.05①②86.94±0.80①②③④
4.7.3 各组大鼠血清TNF-α、IL-17 含量比较见表7。模型组、中药组、西药组、联合组的血清TNF-α、IL-17 含量均高于对照组(P<0.05);中药组、西药组及联合组的TNF-α、IL-17 含量均低于模型组(P<0.05);联合组血清TNF-α、IL-17 含量均低于中药组、西药组(P<0.05)。中药组TNF-α 含量高于西药组(P<0.05),IL-17 含量低于西药组(P<0.05)。
表7 各组大鼠血清TNF-α、IL-17 含量比较(±s) pg/mL

表7 各组大鼠血清TNF-α、IL-17 含量比较(±s) pg/mL
注:①与对照组比较,P<0.05;②与模型组比较,P<0.05;③与中药组比较,P<0.05;④与西药组比较,P<0.05
样本量组 别对照组模型组中药组西药组联合组6 6 6 6 6 TNF-α 11.84± 1.37 35.63± 0.76①31.26± 0.45①②27.92± 1.42①②③24.50± 1.23①②③④IL-17 17.67± 1.09 44.10± 2.17①23.84± 0.75①②26.29± 0.71①②③21.08± 0.62①②③④
4.7.4 各组大鼠肺组织蛋白表达含量比较见表8、图12。模型组肺组织P-P65/P65、P-AKT/AKT、P-MAPK1/3/MAPK1/3 和TP53/GAPDH 蛋白表达含量均高于对照组(P<0.05);中药组、西药组以及联合组上述蛋白的表达含量均低于模型组(P<0.05);联合组上述蛋白的表达含量均低于中药组、西药组(P<0.05)。注:“P”代表磷酸化,“非P”代表非磷酸化。前者代表该蛋白的磷酸化水平,后者代表该蛋白的含量。因很多信号通路的蛋白在受到刺激后,均是通过其磷酸化水平的改变而引起一系列细胞反应,所以用磷酸化与非磷酸化的比值来体现各组检测蛋白的实际表达含量。P65、MAPK1/3 及AKT 均是通过磷酸化表达来证明通路的激活,但TP53 不是此类型,所以用TP53 与内参GAPDH 的比值来体现蛋白的表达含量。
表8 各组大鼠肺组织蛋白表达比较(±s)

表8 各组大鼠肺组织蛋白表达比较(±s)
注:①与对照组比较,P<0.05;②与模型组比较,P<0.05;③与中药组比较,P<0.05;④与西药组比较,P<0.05
样本量组 别对照组模型组中药组西药组联合组6 6 6 6 6 P-AKT/AKT 0.05±0.02 1.01±0.14①0.50±0.15①②0.43±0.12①②0.11±0.04②③④P-MAPK1/3/MAPK1/3 0.18±0.10 0.98±0.20①0.57±0.30①②0.54±0.16①②0.36±0.11②P-P65/P65 0.08±0.36 1.59±0.34①0.88±0.23①②1.02±0.24①②0.37±0.24①②③④TP53/GAPDH 0.09±0.01 1.41±0.03①0.92±0.12①②0.42±0.03①②③0.29±0.02①②③④
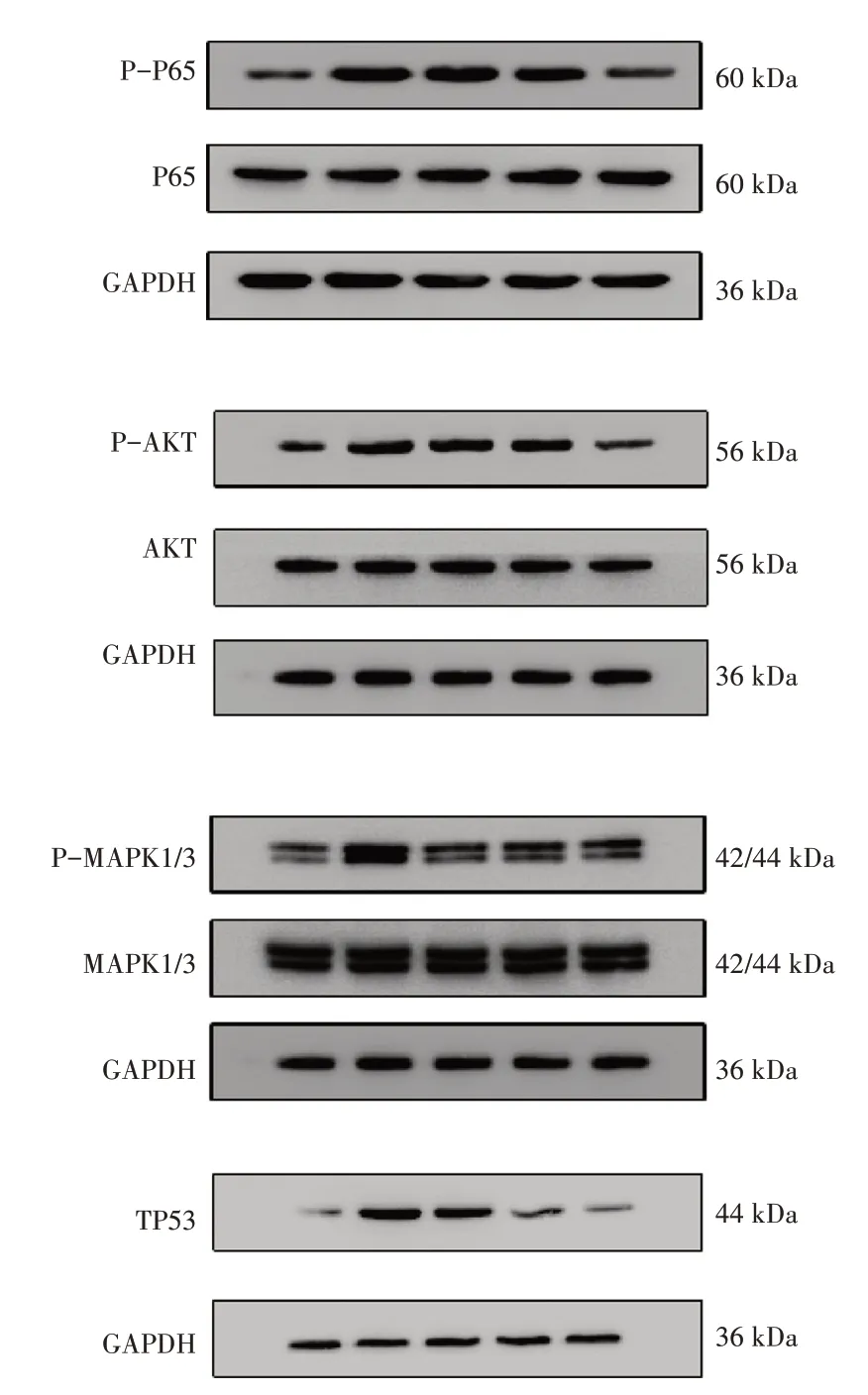
图12 各组大鼠肺组织中相关蛋白条带图
5 讨论
本研究通过网络药理学对通塞颗粒治疗AECOPD 的作用机制进行了分析,并进行了动物实验验证。动物实验病理学及肺功能检测结果显示通塞颗粒可有效改善AECOPD 肺泡融合、血管壁增厚,减轻肺损伤并有助于恢复呼吸功能。
网络药理学研究结果显示,通塞颗粒的关键活性成分是槲皮素、山柰酚、芹菜素、木犀草素和β-谷甾醇,除β-谷甾醇外,其余成分均为天然黄酮。黄酮类化合物具有抗氧化、抗炎、抗菌、调节免疫等药理作用,而抗炎、抗氧化特性使其成为治疗肺部炎症疾病的潜在药物[10]。有研究表明,槲皮素能通过抑制磷酸二酯酶4(PED-4)、激活cAMP/PKA 信号通路,抑制NF-κB 活化,并可有效减轻气道炎症[11-12];在COPD 鼠体模型中,槲皮素可显著降低TNF-α 表达水平,抑制肺泡细胞凋亡,减少肺部损伤,预防COPD 的急性加重[13]。Chung MJ 等[14]通过实验证明,山奈酚可以显著减少哮喘模型小鼠肺泡灌洗液中的炎症细胞数量,改善肺泡充血及气道壁增厚等急性肺损伤的病理特征;另外,山奈酚还可通过调节Nrf2 和NF-κB 信号通路来减少氧化应激、炎症和细胞凋亡[15]。木犀草素可以通过抑制内毒素刺激导致的巨噬细胞磷酸化,降低IL-6 等炎症因子的表达水平,提高肺血管通透性,减轻COPD 患者的肺水肿症状,改善肺功能[16-17]。芹菜素碳苷可通过抑制TLR4/瞬时受体电位通道蛋白6(TRPC6)信号通路的激活,减轻脂多糖(LPS)诱导的BALB/c 小鼠急性肺损伤模型的肺部炎症和免疫毒性[18]。β-谷甾醇是一种天然甾醇,临床上应用以它为主要成分的中药球兰治疗呼吸道疾病有很好的消炎作用[19];有实验证明,β-谷甾醇可通过下调硫氧还蛋白(Trx)/硫氧还蛋白-1(Trx1)激活TP53 表达,诱导A549 肺癌细胞的凋亡,起到抗癌作用[20]。
通过中药-疾疾共同靶点PPI 网络图发现,通塞颗粒治疗AECOPD 的核心靶点涉及TP53、MAPK1、MAPK3、TNF、AKT1、RELA。TP53 是人体重要的抑癌因子,其功能为调控细胞增殖和凋亡[21];目前有研究已证实TP53 可通过外源性和内源性凋亡途径,调控细胞凋亡[22];TP53 能通过下调B 淋巴细胞瘤-2(Bcl-2)及上调细胞凋亡促进基因Bax 的表达水平来促进细胞凋亡过程[23];TP53 抑制剂可有效减少COPD大鼠肺泡上皮细胞的凋亡,减轻肺组织损伤[24-25]。MAPK 作为一种丝裂原活化蛋白激酶,负责在细胞内传递信号,参与多种炎症细胞因子和应激信号的传导[26];MAPK1、MAPK3 均属于MAPK 家族,可以通过介导炎症、免疫应答、气道结构、细胞反应等途径参与哮喘和COPD 的发生与发展[27-29]。文献[30]报道MAPK1、MAPK3 的激活可以抑制细胞凋亡。有研究结果显示,香烟烟雾提取物(cCSE)诱导的A549 肺癌细胞MAPK1、MAPK3 磷酸化水平显著升高,并且增加了肺泡上皮细胞的凋亡[31]。RELA 是NF-κB 家族的重要成员,RELA/p65 具有激活NF-κB 转录的功能,当NF-κB 被激活,将出现核转位过程,结合于相关基因上游的转录活性调控元件,促进相关基因mRNA 的转录,诱导对应分子的表达[32-33]。近年越来越多的研究表明,通过对RELA/P65 翻译后修饰可以对NF-κB 通路进行精准和复杂的调控[34]。临床研究表明,抑制RELA/P65 的过度活化可以减轻COPD 患者的气道炎症反应,改善肺功能和血气指标[35]。本研究的GO 富集分析结果显示,通塞颗粒可能通过调控LPS 反应、氧化应激反应、丝/苏氨酸蛋白激酶复合物、转录因子活性、DNA-转录因子结合等BP 而发挥治疗AECOPD 的功效。KEGG 通路富集分析结果表明,通塞颗粒治疗AECOPD 主要涉及TNF、IL-17、MAPK、NF-κB、P13K、HIF-1 等多条信号通路。TNF 信号通路是COPD 疾病病理过程中的关键通路,参与多种信号转导,主要通过上调MAPK、ERK、NF-κB 等信号通路来诱导细胞凋亡及促进炎症反应[36]。TNF 信号通路通过释放TNF-α 等促炎因子,产生大量炎性介质,促进气道炎性浸润,增加血管通透性,形成肺水肿,加重肺损伤[37-38]。有研究证实,TNF-α 广泛存在于COPD 患者的肺组织中,其升高会引起炎性介质的瀑布样连锁反应,从而加重COPD 的病情发展[39-40]。辅助性T 细胞17(Th17)是人类辅助性T 细胞分化出的一类细胞亚群,主要通过分泌IL-17A 导致炎性因子释放,促使气道黏液腺分泌大量黏液,与肺气肿的形成、气流阻塞密切相关[41]。有研究发现,IL-17 可诱导中性粒细胞的募集,增加COPD 患者支气管上皮细胞细胞间黏附分子-1(ICAM-1)的表达,增强ICAM-1 的黏附作用,并加剧气道炎症反应[42-43]。HIF-1 信号通路在细胞代谢、氧化应激、损伤修复等环节中发挥重要作用[44];其由HIF-1α 和HIF-1β 两种亚基组成异源二聚体,HIF-1α 是内源性保护机制的始动因子,也是P13KAKT 信号通路的下游因子[45]。COPD 患者普遍存在缺氧的临床表现,在缺氧条件下,P13K-AKT 通路被激活,AKT 活化,下游蛋白mTOR 磷酸化,促使HIF-1α蛋白合成,以应对低氧环境,改善气道缺血、缺氧状态[46]。在PI3K-AKT 经典信号通路中,AKT 是处于PI3K 下游的关键蛋白,在激活后,可以通过各种下游因子的磷酸化来进行细胞调控[47];该通路上调会激活NF-κB 上游抑制蛋白κB 抑制因子激酶(IKK)及NF-κB 抑制蛋白(IKB),使后者被泛素化降解,继而激活NF-κB 信号通路,引起TNF-α 和IL-17 等多种炎症因子的释放[48-49]。另外,NF-κB 信号通路通过调节呼吸道细胞因子活性,增强促炎分子分泌,从而加重COPD[50]。因此许多药物通过抑制NF-κB 信号通路的转导,从而起到抗炎作用,延缓COPD 的发展[51-52]。本研究动物实验验证结果显示,通塞颗粒可有效下调TP53、P-P65、P-AKT、P-MAPK1/3 蛋白表达,减轻炎症反应和氧化应激反应,减少细胞凋亡,起到保护肺黏膜的作用。
综上所述,通塞颗粒治疗AECOPD 是一个涉及多成分、多靶点、多通路的过程。动物实验验证结果显示相较于模型组,通塞颗粒可显著下调网络药理学中筛选出的核心靶点蛋白表达,减轻炎症反应,缓解肺损伤,起到治疗AECOPD 的功效。本研究系统地阐释了通塞颗粒治疗AECOPD 的潜在活性成分、核心靶点以及相关通路,为后续深入验证和探讨通塞颗粒治疗AECOPD 的分子机制提供了基础和思路。

