基于转录组学探讨益肾清利活血方对马兜铃酸Ⅰ诱导肾损伤的作用机制
赵思,何伟明,张傲雪,温开智,顾丽娜,贺怡宁
(1. 南京中医药大学第一临床医学院,江苏 南京 210023;2. 南京中医药大学附属医院,江苏省中医院,江苏 南京 210029)
慢性肾脏病(chronic kidney disease, CKD)指不可逆的结构或功能性肾损伤,随着高血压、糖尿病及老龄化人口的增多,其全球发病率迅速上升,已成为最受关注的健康问题之一[1-2]。CKD 以进行性肾脏炎症和纤维化为主要特征,炎症参与发生及发展全过程,间质炎症会导致细胞外基质(ECM)沉积和胶原蛋白生成,最终导致纤维化,而持续的纤维化会破坏组织结构和器官功能,最终导致肾衰竭[3-4]。目前CKD的治疗方法主要是干预其发展和并发症,发展至终末期需采取透析或移植措施[2],考虑到经济压力、不良反应和激素依赖等问题,从疾病早期使用有效安全的方法来延缓CKD进展非常重要。
益肾清利活血方是在邹燕勤国医大师提出“肾虚湿瘀”为基本病机指导下,形成的临床有效经验方,由黄芪、丹参、黄蜀葵花和甘草组成。课题组前期研究表明,黄芪甲苷能显著抑制Wnt/β-catenin 蛋白通路从而拮抗腹膜间皮细胞纤维化能[5]。黄蜀葵花提取物可以调节TGF-β1/Smad7 通路拮抗肾纤维化[6-7]。黄蜀葵花的主要成分金丝桃苷可以通过抑制AMPKULK1 介导的自噬来减轻肾脏损伤[8]。丹参酮ⅡA 具有明显的抗氧化、抗肾纤维化作用。甘草次酸抑制间隙连接,通过调控TXNIP-AKT、JNK、Thioredoxin 等,发挥抗氧化作用[9]。
转录组学具有全面检测、综合分析的特点,与中药复方的治疗特点相符合,在复方药效物质基础上得到了广泛的运用[10]。马兜铃酸肾病是一种快速进展的肾小管间质纤维化,诱发的肾脏疾病的机制包括氧化应激、细胞凋亡和炎症反应等[11]。课题组前期研究表明,马兜铃酸Ⅰ可诱导肾小管上皮细胞损伤[12]。因此,本研究采用马兜铃酸Ⅰ(AAⅠ)诱导的小鼠模型分析益肾清利活血小复方(YSQLHX)治疗后肾脏的转录组谱,为临床应用提供依据。
1 材料与方法
1.1 试验药物
益肾清利活血方组方:黄芪30 g,黄蜀葵花15 g,丹参20 g 和甘草6 g。制备方法:组方分别加10、8 倍水,连续回流提纯两次,浓缩后冷冻干燥,最终得率为13.3%。马兜铃酸AAⅠ(纯度98%,成都植标化纯生物技术有限公司,批号:PCS-190415)。
1.2 动物
雄性7~8 周龄C57BL/6 小鼠,由南京青龙山动物中心提供,实验动物许可证号:SCXK(浙)2019-0002,实验已获得南京中医药大学实验动物伦理委员会批准(审批号:012071001432),饲养于SPF 级实验室,室温18~22 ℃,相对湿度45%~70%,自由摄食饮水,12 h昼夜节律。
1.3 试剂
血清肌酐(Scr)、尿酸(UA)、尿蛋白(Pro)定量测试盒(南京建成生物,批号:C011-2-1、C012-2-1、C035-2-1);艾科瑞RNA 提取试剂盒(湖南艾科瑞生物有限公司,批号:A4A1520);翌圣逆转录和Hieff®qPCR SYBR Green Master Mix(Low Rox Plus)试剂盒(翌圣生物科技有限公司,批号:H8216980)。
1.4 仪器
多功能酶标仪( 美国 Thermo,型号:MULTISKANFC);光学显微镜(日本Olympus 公司,型号:BX53P);低温高速离心机(美国Thermo 公司,型号:Fresc017);安捷伦2100生物分析仪(安捷伦科技公司,型号:G2939B)。
1.5 方法
1.5.1 分组及给药方法
小鼠适应性喂养7 d 后,随机分为正常对照组(Control)、模型组(AAⅠ)、低剂量组(YSQLHX-L)和高剂量组(YSQLHX-H),每组各12 只。具体干预措施如下:①除正常对照组外,其余组小鼠均腹腔注射马兜铃酸Ⅰ 0.1 mL[5 mg/(kg·3d),AAⅠ溶解在0.5%羧甲基纤维素钠中]诱导肾损伤,剂量参考课题组前期研究[12],共干预30 d;②低剂量组给予益肾清利活血方冻干粉1.463 g/(kg·d),即11 g/(kg·d),高剂量组给予益肾清利活血方冻干粉2.926 g/(kg·d),即22 g/(kg·d),共灌胃30 d;③正常对照组和模型组每天灌胃0.3 mL 含0.5%羧甲基纤维素钠的PBS溶液,共灌胃30 d。
连续给药30 d后,将各组小鼠置于代谢笼内,禁食不禁水,留取各组小鼠尿液。并于6 h后从每组动物眶后窦采集血液,采血后处死各组小鼠,留取各组小鼠肾脏,-80 ℃或液氮保存。
1.5.2 生化指标测定
禁食6 h 后,通过眶后窦收集血液,4 ℃低温离心机以3 000 r/min 离心15 min,分离血清,留取上清液后根据血清肌酐、尿酸、尿蛋白定量测试盒的说明书检测相应指标。
1.5.3 肾脏组织病理学检查
为了评估肾组织中的组织病理学变化,用冷磷酸盐缓冲盐水(PBS)溶液洗涤组织三次并固定在4%多聚甲醛中,嵌入石蜡中切成4 μm 切片,并用HE 和Masson 染色,用光学显微镜进行图像采集,每组随机挑选6个染色视野进行统计分析。
1.5.4 RNA制备与转录组
实验结束时,正常对照组、模型组和低剂量组组各取4 个肾组织,根据产品手册说明,使用Tizol(美国加利福尼亚州Invitrogen)从肾组织中提取总RNA,使用安捷伦2 100生物分析仪评估完整性和浓度,然后基于Illumina HiSeq 测序平台进行二代测序获得转录本表达量矩阵。以测序得到的mRNA的原始数据为研究对象,进行FastQC 质量控制,得到Clean Data,参考GRCm39(mm39)基因组序列,通过每千个碱基的转录每百万(TPM)映射来量化每个基因的表达水平。
1.5.5 数据规范化与分析
通过R 软件使用“DESeq2”包分析[12],计算正常对照组(Control)与模型组(AAⅠ)、模型组(AAⅠ)与低剂量组(YSQLHX-L)之间基因的差异情况,以|log2FC| >0.5,Pvalue < 0.05 为阈值筛选显著性差异基因(DEGs),得到名为“diff”的文件为显著的DEGs。使用Metascape 在线平台对差异基因进行GO 功能和KEGG通路富集分析。P< 0.05为差异具有统计学意义。
1.5.6 筛选核心靶点
将两组间的DEGs通过Venny在线平台取交集,得到的交集基因导入STRING 数据库中进行分析,再将结果文件导入Cytoscape 中用CytoNCA 插件筛选出DC、BC 和CC 均大于中位数的核心基因,并根据度值从大到小顺序进行作图。
1.5.7 实时荧光定量PCR检测
根据制造商的说明书,使用一步法提取分离总RNA,将总RNA 反向转录为cDNA,用于2 μg 样品,qPCR 以反应体系20 μL 体积进行。采用2-ΔΔCT方法计算,GAPDH 为内参,本实验使用小鼠引物购自上海生工,引物序列见表1,实验重复3次。

表1 引物序列表
1.6 统计学方法
使用Graphpad Prism 8.0.2软件进行分析,采用均数 ± 标准差(±s)进行表示。每份数据进行正态分布检验(以Shaprio-wilk 为准),符合正态分布的数据使用单因素方差分析,样本不符合正态分布时使用非参数检验。P< 0.05代表差异具有统计学意义。
2 结果
2.1 各组小鼠肾功能比较
与正常对照组比较,模型组小鼠的尿酸、尿蛋白与血肌酐水平显著升高,AAⅠ明显损伤小鼠肾功能,与预期结果一致。与模型组比较,低剂量和高剂量组尿酸、血肌酐的水平均显著降低,并以高剂量组效果最好(P< 0.001,P< 0.000 1)。结果见图1和表2。
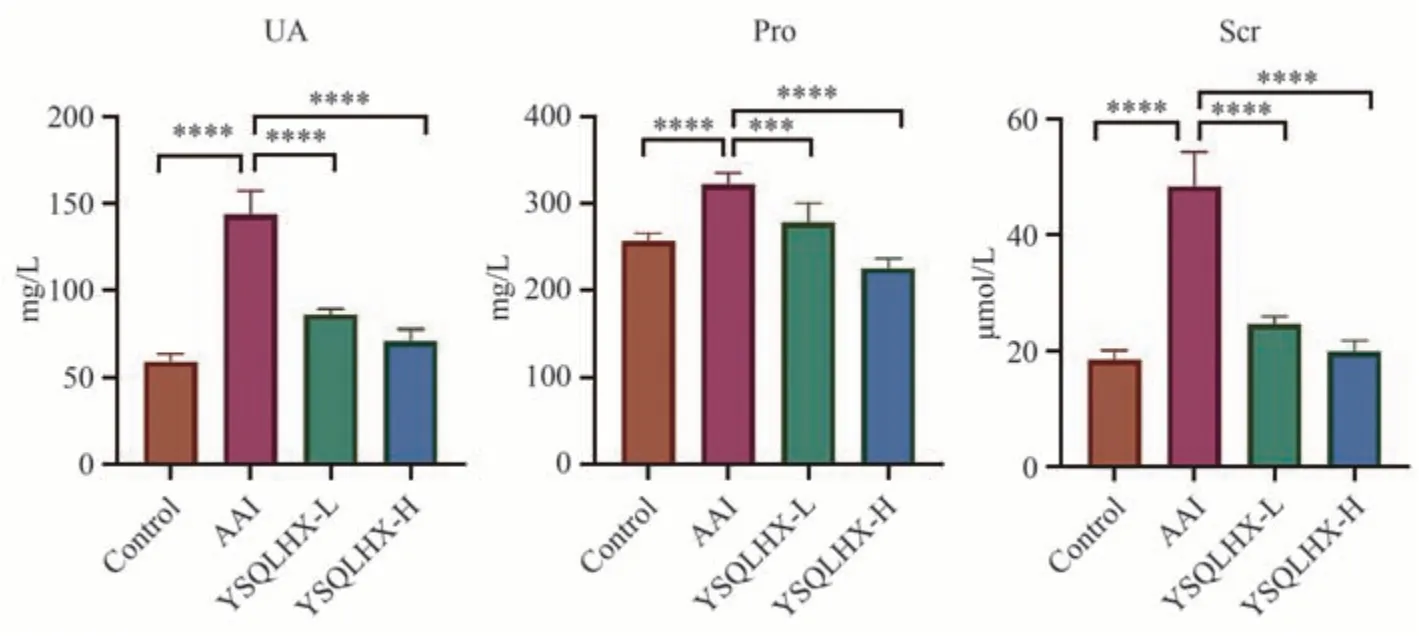
图1 各组小鼠肾功能情况比较
表2 各组小鼠肾功能情况比较(±s)
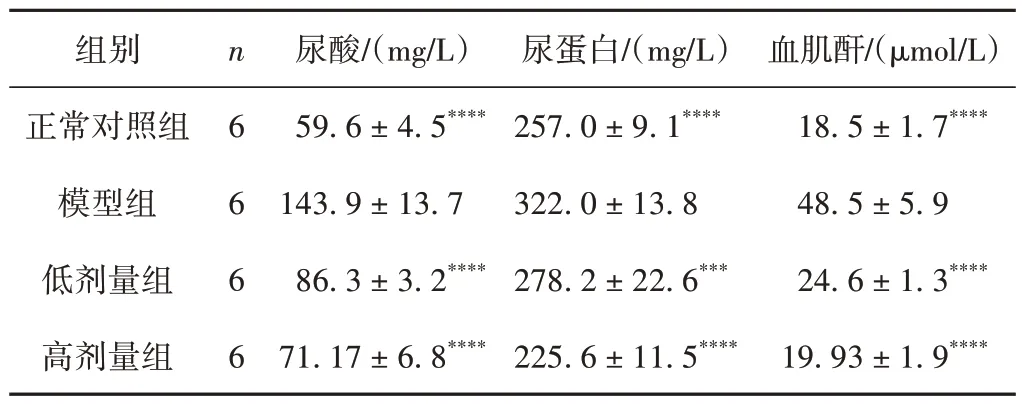
表2 各组小鼠肾功能情况比较(±s)
注:与模型组比较,****P < 0.000 1,***P < 0.001。
组别正常对照组模型组低剂量组高剂量组血肌酐/(μmol/L)18.5 ± 1.7****48.5 ± 5.9 24.6 ± 1.3****19.93 ± 1.9****n6 6 6 6尿酸/(mg/L)59.6 ± 4.5****143.9 ± 13.7 86.3 ± 3.2****71.17 ± 6.8****尿蛋白/(mg/L)257.0 ± 9.1****322.0 ± 13.8 278.2 ± 22.6***225.6 ± 11.5****
2.2 各组小鼠肾脏组织病理情况比较
HE染色显示,正常对照组肾小球及肾小管结构完整、清晰、排列有序、细胞形态完整,未见异常;与正常对照组比较,模型组镜下可见大量的炎症细胞浸润、肾小球萎缩、肾小管管腔扩大、肾小管上皮细胞变性、细胞核外露;而低剂量组和高剂量组肾小管结构较完整,上皮细胞死亡与空泡化减轻,炎症细胞明显减少。Masson 的三色染色可见,模型组肾间质大量胶原纤维沉积,而经益肾清利活血方处理后纤维化面积显著降低。结果见图2和图3。
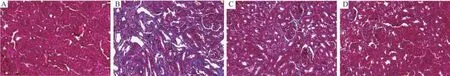
图3 各组小鼠肾组织Masson染色图(× 400)
2.3 肾脏转录组分析
为了阐明益肾清利活血方对肾脏保护的潜在机制,本实验将正常对照组(Control)、模型组(AAⅠ)、低剂量组(YSQLHX-L)的小鼠肾组织进行转录组测序分析(n= 4)。
2.3.1 差异表达基因分析
通过火山图直观得到,红点标注差异表达上调1 倍以上的mRNA,蓝点标注下调1 倍以上的mRNA,纵坐标代表Pvalue 值,横坐标代表logFC 值,因此离横坐标和纵坐标越远越高代表该基因表达越显著。与正常对照组比较,模型组有2 615 个差异基因,其中有1 409 个上调,1 206 个下调;在低剂量组与模型组中共鉴定出368 个差异基因,其中有180 个上调,188 个下调。结果见图4。
2.3.2 功能富集分析
通过对模型组与低剂量组分析得到的368 个差异基因进行功能富集分析发现,前5 个富集数的分子功能包括氧化还原酶活性、泛素样蛋白连接酶结合、核受体结合、异构酶活性,生物过程有单羧酸代谢过程、激素反应、分泌调节、脂质定位、小分子生物合成,细胞成分有线粒体内膜、脂滴、过氧化物酶体、高密度脂蛋白颗粒、内质网伴侣复合体。KEGG 通路注释显示这些差异基因主要参与PPAR 信号通路,类固醇激素生物合成,甘氨酸、丝氨酸和苏氨酸代谢,谷胱甘肽代谢,脂肪酸降解,IL-17信号通路等。结果见图5。
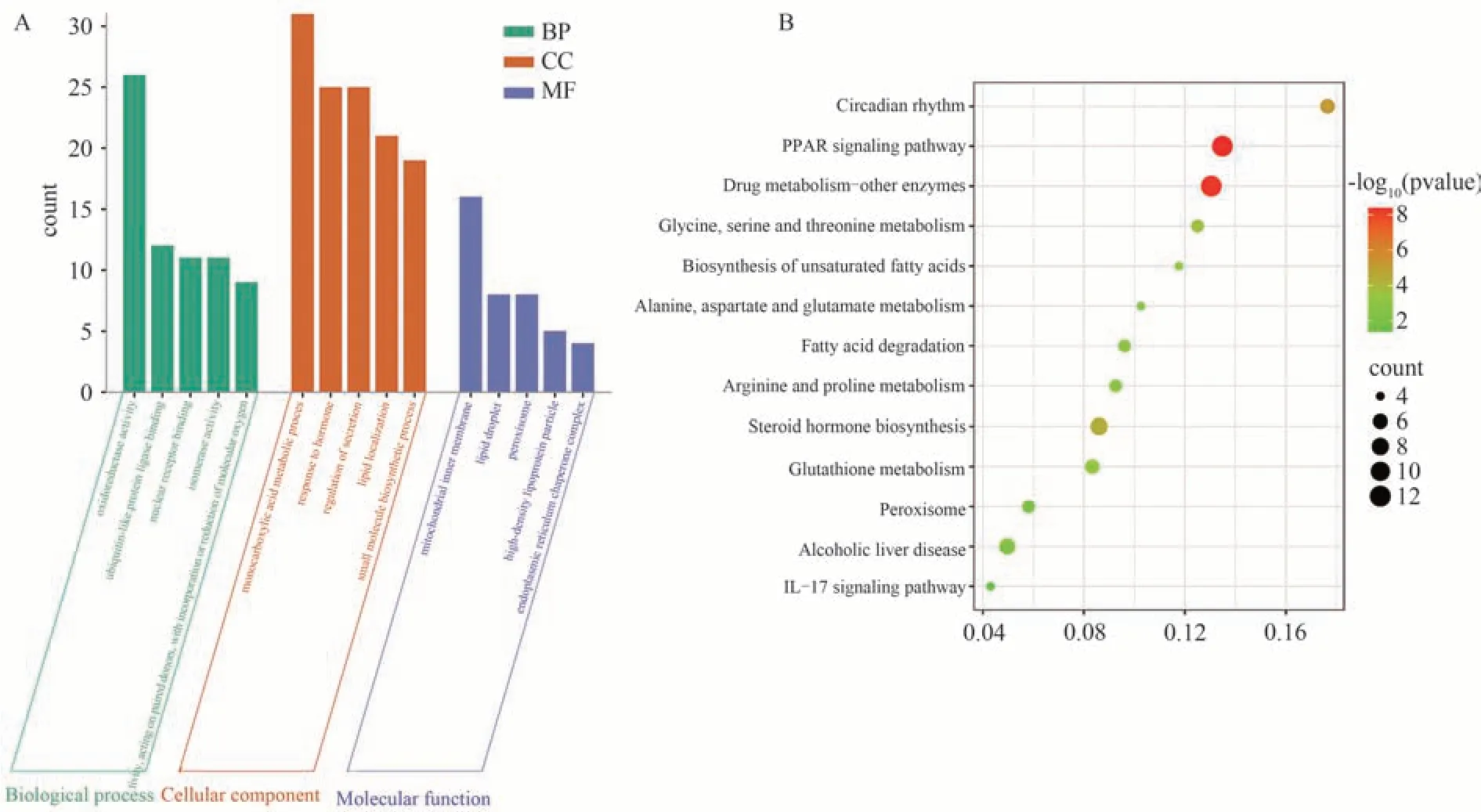
图5 模型组与低剂量组差异基因
2.3.3 蛋白互作网络与核心靶点筛选
使用Venny软件分析显示,低剂量组治疗有反应的368个差异基因中有179个与马兜铃酸引起的差异基因重叠,将交集基因导入STRING 数据库中分析,将结果文件导入Cytoscape 中用CytoNCA 插件进行分析,筛选出DC、BC 和CC 均大于中位数的核心基因37 个,并根据度值从大到小排名进行作图。枢纽基因中Ppara、Fabp1、Apoa2、Acox1、Ugt2b34 和Hspa5 都与纤维化密切相关,表明其可能是益肾清利活血方的潜在治疗靶点。结果见图6,前8个核心靶点的拓扑参数见表3。
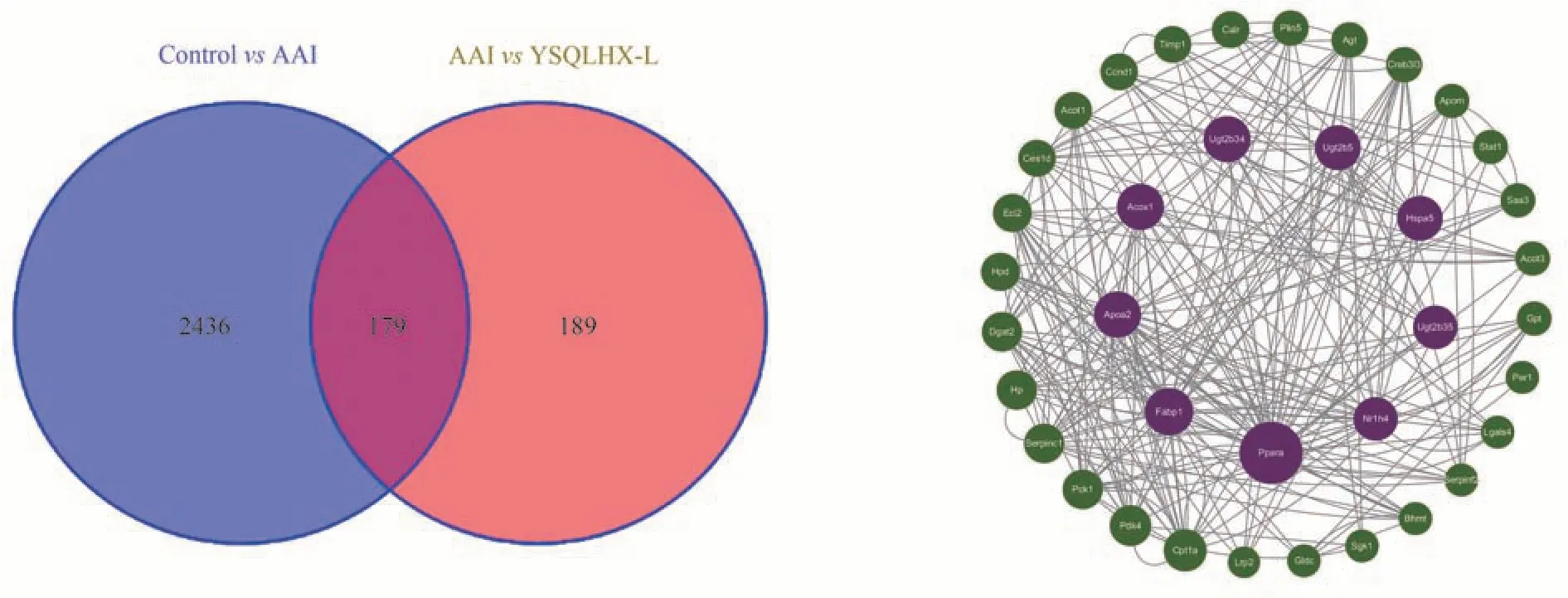
图6 两组间差异基因的韦恩图及核心靶点PPI图

表3 前8个核心靶点的拓扑参数
2.3.4 核心靶点基因的PCR验证
对前8 个核心基因的小鼠肾脏组织进行qPCR 验证。与正常对照组比较,模型组Ppara、Fabp1、Apoa2、Acox1、Nr1h4 mRNA 水平显著降低,Ugt2b34、Hspa5、Ugt2b5 mRNA 明显升高,而经益肾清利活血方处理后的低、高剂量组调节了AAⅠ诱导的转录本水平的变化。结果见表4和图7。

图7 qPCR检测各组小鼠肾脏组织中的mRNA表达水平
表4 各组小鼠肾脏组织中的mRNA表达水平(±s)
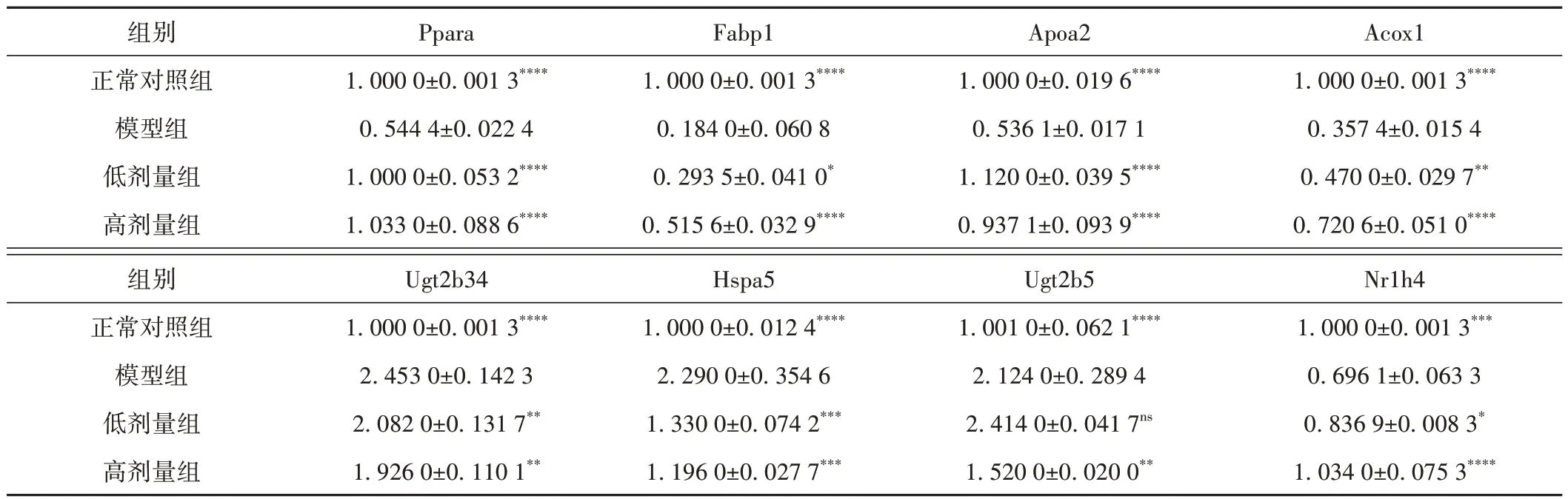
表4 各组小鼠肾脏组织中的mRNA表达水平(±s)
注:模型组比较,****P < 0.000 1,***P < 0.001,**P < 0.01,*P < 0.05,nsP > 0.05。
组别正常对照组模型组低剂量组高剂量组Ppara 1.000 0±0.001 3****0.544 4±0.022 4 1.000 0±0.053 2****1.033 0±0.088 6****Fabp1 1.000 0±0.001 3****0.184 0±0.060 8 0.293 5±0.041 0*0.515 6±0.032 9****Apoa2 1.000 0±0.019 6****0.536 1±0.017 1 1.120 0±0.039 5****0.937 1±0.093 9****Acox1 1.000 0±0.001 3****0.357 4±0.015 4 0.470 0±0.029 7**0.720 6±0.051 0****Nr1h4 1.000 0±0.001 3***0.696 1±0.063 3 0.836 9±0.008 3*1.034 0±0.075 3****组别正常对照组模型组低剂量组高剂量组Ugt2b34 1.000 0±0.001 3****2.453 0±0.142 3 2.082 0±0.131 7**1.926 0±0.110 1**Hspa5 1.000 0±0.012 4****2.290 0±0.354 6 1.330 0±0.074 2***1.196 0±0.027 7***Ugt2b5 1.001 0±0.062 1****2.124 0±0.289 4 2.414 0±0.041 7ns 1.520 0±0.020 0**
3 讨论
中药配方的多组分、多靶点提供了多样化的治疗,通过许多药理活性化合物的协同作用发挥治疗作用。转录组阵列可靠且新颖,可用于搜索具有多种活性成分的中药影响的多个靶点和途径。
本实验研究结果表明,益肾清利活血方可以降低AAⅠ小鼠的尿酸、尿蛋白、血肌酐水平,保护肾功能,显著降低小鼠肾脏的炎症细胞和胶原沉积。通过对小鼠肾脏的mRNA 转录谱分析,可见益肾清利活血方能显著改变生物过程、细胞组分和分子功能的许多基因的转录,特别是炎症反应。KEGG 分析显示益肾清利活血方治疗改变了各种途径,主要参与PPAR 信号通路,类固醇激素生物合成,甘氨酸、丝氨酸和苏氨酸代谢,谷胱甘肽代谢,脂肪酸降解,IL-17信号通路等。核心基因中PPARα[13-14]是PPAR 信号通路中的转录因子,Fabp1、Acox1 是该通路中的下游重要靶基因,可调节脂肪酸细胞摄取、运输和代谢,与凋亡、纤维化相关。脂质代谢[15]的改变与各种代谢疾病有关,虽然肾脏没有被归类为代谢器官,但肾小管细胞具有较高的基线能量消耗水平,主要的能量来源是脂肪酸氧化。在肾损伤后,TECs 的脂肪酸氧化能力受损,糖酵解增加,导致活性氧(ROS)以及促炎和促纤维化因子产生增加,并增加TECs凋亡,还可以导致溶酶体功能障碍和自噬增加,加重CKD 进程[15]。HSPA5 可结合并稳定谷胱甘肽过氧化物酶4,铁死亡的发生与GPX4 消耗以及ROS和其他氧化物的产量增加有关[16]。Ugt2b34、Ugt2b5主要在胃肠道、肝脏、肾脏中表达,其中亲脂性底物与葡萄糖醛酸偶联,在体内将亲水性葡糖苷酸转运出细胞,主要参与机体代谢反应[17]。Nr1h4 是在肝脏、肠道和肾脏中高度表达是一种主要的核胆汁酸受体,可通过抗炎、抗氧化应激、抗纤维化等发挥保护肾脏疾病的作用,它还在肾脏的葡萄糖和脂质代谢中发挥作用[18-19]。核心靶点还显示出现了多种载脂蛋白的失调,如APOA2 等,还有趋化因子、生长因子等,这些蛋白大多数与巨噬细胞功能相关,并在CKD 患者中表达下调。
4 结论
益肾清利活血方可以保护肾功能,降低肾脏组织中炎症和胶原沉积,转录组分析发现其与脂肪酸代谢、铁死亡、IL-17信号通路等密切相关。

