miR-10b介导NKG2D调节脑胶质瘤细胞免疫效应的实验研究
袁岗 巨虎 肖宗宇 李文辉 曹立新 惠超杰 (青海大学附属医院神经外科,西宁 810001)
脑胶质瘤是最常见的神经上皮性肿瘤之一,平均每10万人中有10~20人患病,其发病率占全身恶性肿瘤的1%~3%,晚期患者的五年生存率不足5%[1]。目前临床上主要通过手术切除并辅以放化疗等手段对该病进行治疗,但这些传统治疗方法均在不同程度上存在治愈率低、复发率高、预后差等问题[2]。因此寻找其他辅助治疗方案以延长患者生存期,改善预后是目前亟待解决的难题。自然杀伤细胞激活受体(NK cell activated receptor,NKG2D)是一种主要表达于NK细胞、CD8+T细胞以及γδ T细胞等免疫效应细胞表面的活化性受体[3]。NKG2D受体可识别一系列亲和力不同、结构多样的配体,包括主要组织相容性复合物Ⅰ链相关基因A/B(major histocompatibility complex classⅠchain-related gene A/B,MICA/B)以及6种UL16结合蛋白(UL16 binding protein 1~6,ULBP1~6)。NKG2D通过与位于靶细胞表面的配体结合活化NK细胞使其分泌细胞因子并发挥杀伤作用。当机体细胞发生恶性病变时会反应性增加其表面MICA等配体的表达,从而诱发NK等免疫效应细胞对肿瘤细胞的攻击[4]。微小核糖核酸-10b(micro ribonucleic acid 10b,miR-10b)是位于2号染色体短臂3区的miR-10家族的主要成员,被发现在多种恶性肿瘤组织中促进肿瘤细胞的增殖、侵袭和转移[5]。有报道指出,miR-10b在人正常脑组织中表达水平较低,而在胶质瘤组织中呈高表达水平,其表达水平与肿瘤的病理分级呈正相关,且miR-10b高表达患者的预后差、生存时间短,但miR-10b在脑胶质瘤的细胞免疫效应和作用机制尚不清楚[6]。本研究利用体外实验探究miR-10b介导NKG2D对脑胶质瘤的细胞免疫效应和作用机制,为深入研究miR-10b对脑胶质瘤的细胞免疫效应和作用机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞 人脑胶质瘤细胞U251(北京协和细胞资源中心,批号:191226);外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)由健康志愿者提供,经青海大学附属医院伦理委员会审批通过,伦理审批号:院伦审2021第15号。
1.1.2 药物与试剂 RPMI164完全培养基(北京雅安达生物技术有限公司,批号:C11875500BT);TRIzol试剂(上海联迈生物工程有限公司,批号:LM-81027);逆转录试剂盒(上海康朗生物科技有限公司,批号:KL-TERT-Ra);免疫磁珠分选(magneticactivated cell sorting,MACS)试剂盒(北京百奥莱博科技有限公司,批号:CZ020);四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)溶液(上海创赛科技有限公司,批号:PM10053);NC inhibitor、miR-10b mimics、miR-10b inhibitor均由美国Cellecta公司设计合成;异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/藻红蛋白(phycoerythrin,PE)(德国Miltenyi Biotec公司,批号:130-096-158);鼠抗人NKG2D、MICA、ULBP2和ULBP3,免疫球蛋白G1(immunoglobulin G1,IgG1)抗体(美国Invitrogen公司,批号:191002、191224、200415、200323、191117);阴性对照(NC inhibitor)、miR-10b模拟物(miR-10b mimics)、miR-10b抑制剂(miR-10b inhibitor)均由美国Cellecta公司设计合成;实时逆转录酶聚合酶链反应(RTqPCR)引物均由(克拉玛尔)上海谱振生物科技有限公司设计合成。
1.1.3 仪器 Galaxy 48 R型CO2培养箱(德国Eppendorf公司);Axioscope 5型普通光学显微镜(德国Zeiss公司);LumascopeTM620型绿色荧光显微镜(美国Etaluma公司);S1000TMDual 48 Well型聚合酶链式反应(polymerase chain reaction,PCR)仪(美国Bio-Rad公司);NovoCyte型流式细胞仪(美国Agilent Technologies公司);SuPerMax 3100型多功能酶标仪(上海闪谱生物科技有限公司);HSC-2015L型高速冷冻离心机(宁波新芝生物科技股份有限公司)。
1.2 方法
1.2.1 人脑胶质瘤细胞U251的培养、传代和分组 将人脑胶质瘤细胞U251培养于含10%胎牛血清(fetal bovine serum,FBS)、100 μg/ml链霉素和100 U/ml青霉素RPMI1640完全培养基中,置于37 ℃、5%CO2的培养箱内。每2~3 d传代1次,获得处于对数生长期的细胞,按照1.0×105个/ml制备细胞悬液,并设置对照组、过表达组、低表达组、空白组,每组6个复孔。对照组、过表达组、低表达组分别采用脂质体转染法转染阴性对照(NC inhibitor)、miR-10b模拟物(miR-10b mimics)、miR-10b抑制剂(miR-10b inhibitor),NC inhibitor正向5'-TCGATCGTAAGCACGC-3',反向5'-CATGTCAGTACGTACG-3';miR-10b mimics正向5'-GTCGTACGTACGAATGCA-3',反向5'-CCTAGACGTAAGTCAGAC-3';miR-10b inhibitor正向5'-CGTACGTACGATCAGTA-3',反向5'-TACGTACGATAACGTAG-3'。空白组予以等量无菌生理盐水。继续培养24 h后换培养液,分别在普通光学显微镜和绿色荧光显微镜下拍照计数,计算各组细胞转染效率,转染效率(%)=绿色荧光镜下发光细胞数/普通光镜下细胞数×100%。
1.2.2 RT-qPCR检测miR-10b表达 采用TRIzol试剂分别抽提各组细胞总RNA,利用逆转录试剂盒逆转录合成互补脱氧核糖核酸(cDNA),以cDNA为模板进行RT-qPCR扩增。miR-10b正向引物5'-TTAGCGTCAGTACCCGTA-3',负向引物5'-CGTACGTACGTACGTACG-3',产物长度260 bp;β-actin正向引物5'-GGCGTACGAATAGATA-3',反向引物5'-ATTCGATGCATGATCC-3',产物长度298 bp。PCR循环参数:95 ℃ 15 min,95 ℃ 15 s,60 ℃ 60 s,重复40个循环。以β-actin为内参,采用2-ΔΔCt法计算miR-10b相对表达量,ΔΔCt=实验组(Ct样本-Ct内参)-对照组(Ct样本-Ct内参)。
1.2.3 健康志愿者外周血NK细胞的分离、培养、鉴定 采用密度梯度区带离心法分离1例健康志愿者的PBMC,通过MACS法分选NK细胞,将得到的NK细胞培养于含10%FBS的RPMI1640培养基(含IL-2 1 000 U/ml,青霉素和链霉素各100 U/ml)中,按照2×105个/cm2细胞密度接种于细胞培养瓶中,于37 ℃、5%CO2培养箱中培养24 h后即为效应细胞,流式细胞仪检测NK细胞表面标志物CD56。
1.2.4 MTT法检测不同效靶比时NK细胞杀伤活性 将效靶比分别为10∶1、20∶1、50∶1和100∶1的NK细胞和人脑胶质瘤细胞U251加入96孔板,以10%TritonX-100破坏靶细胞为最大释放,以RPMI-1640维持液代替效应(或靶)细胞为自然释放,同时设置效应细胞(NK细胞)孔和靶细胞(人脑胶质瘤细胞U251)孔作为对照孔,于37 ℃、5%CO2培养箱中培养4 h后每孔加入10 μl 5 mg/ml MTT溶液继续培养4 h,弃去上清液,每孔加50 μl二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,10 min内上多功能酶标仪(492 nm)检测各孔吸光度(optical density,OD)值。NK细胞杀伤活性(%)=(实验组OD值-靶细胞自然释放组OD值-效应细胞自然释放组OD值)/(靶细胞最大释放组OD值-靶细胞自然释放组OD值)×100%。
1.2.5 检测各组NK细胞表面NKG2D表达 取NK细胞杀伤活性最高时的效靶比的NK细胞和人脑胶质瘤细胞U251混合液,以3 000 r/min(离心半径6 cm)转速离心10 min,用PBS冲洗3次,按每1×106个NK细胞1 μg抗体量加入鼠抗人NKG2D抗体,对照管加入鼠抗人抗体IgG1。4 ℃下标记30 min,流式细胞仪检测NK细胞表面NKG2D表达情况。
1.2.6 检测组人脑胶质瘤细胞U251表面MICA、ULBP2、ULBP3表达 取处于对数生长期的人脑胶质瘤细胞U251,3 000 r/min(离心半径6 cm)离心10 min,PBS冲洗3次,按每1×106个人脑胶质瘤细胞U251分别加入1 μg鼠抗人MICA、ULBP2和ULBP3抗体,对照管加入鼠抗人抗体IgG1。4 ℃条件下标记30 min,流式细胞仪检测各组NK细胞表面MICA、ULBP2、ULBP3表达情况。
1.3 统计学分析 采用SPSS26.0软件进行统计学检验,以单因素方差分析多样本计量资料±s,每两样本差异采用SNK-q检验分析。P<0.05表示差异有统计学意义。
2 结果
2.1 各组细胞转染效率 各组细胞转染效率均在85%以上,其中对照组、过表达组、低表达组转染效率分别为(93.55±2.05)%、(95.67±3.14)%、(94.18±3.26)%。见图1。

图1 各组细胞转染效率图(×100)Fig.1 Transfection efficiency diagram of each group (×100)
2.2 RT-qPCR检测miR-10b表达 与对照组和空白组相比,过表达组miR-10b表达升高,低表达组miR-10b表达降低,差异均有统计学意义(P<0.05),且对照组与空白组相比miR-10b表达差异无统计学意义(P>0.05,见表1)。
表1 各组细胞miR-10b表达分析(±s,n=6)Tab.1 Analysis of miR-10b expression in each group (±s,n=6)

表1 各组细胞miR-10b表达分析(±s,n=6)Tab.1 Analysis of miR-10b expression in each group (±s,n=6)
Note:1)P<0.05 vs control group;2)P<0.05 vs blank group;3)P<0.05 vs over-expressed group.
Groups Control Blank Over-expressed Low-expressed miR-10b 1.05±0.17 1.10±0.15 1.67±0.281)2)0.52±0.091)2)3)38.457<0.001 F P
2.3 NK细胞鉴定结果 NK细胞的表型检测显示,CD56阳性和CD56dim阳性T细胞各占98.68%和94.74%。见图2。

图2 NK细胞的表型检测Fig.2 Phenotype detection of NK cells
2.4 NK细胞杀伤活性结果 与对照组、空白组相比,过表达组不同效靶比NK细胞杀伤活性均降低,低表达组不同效靶比NK细胞杀伤活性均增高,差异均有统计学意义(P<0.05),各组NK细胞杀伤活性均随效靶比升高而升高,组内比较差异均有统计学意义(P<0.05),且对照组与空白组相同效靶比的NK细胞杀伤活性比较差异均无统计学意义(P>0.05)。见表2。
表2 NK细胞杀伤活性比较(±s,n=6)Tab.2 Comparison of NK cells killing activity (±s,n=6)
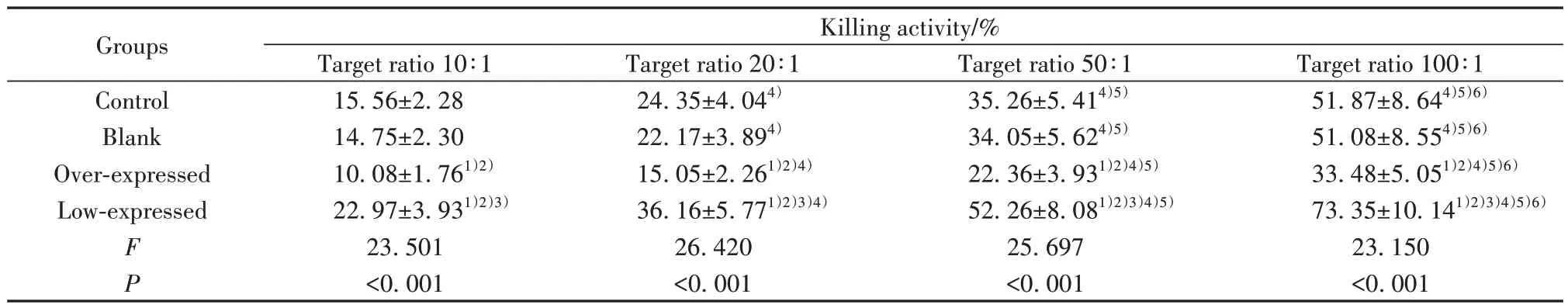
表2 NK细胞杀伤活性比较(±s,n=6)Tab.2 Comparison of NK cells killing activity (±s,n=6)
Note:1)P<0.05 vs control group;2)P<0.05 vs blank group;3)P<0.05 vs over-expressed group;4)P<0.05 vs target ratio 10∶1;5)P<0.05 vs target ratio 20∶1;6)P<0.05 vs target ratio 50∶1.
Groups Control Blank Over-expressed Low-expressed Killing activity/%Target ratio 10∶1 Target ratio 20∶1 Target ratio 50∶1 Target ratio 100∶1 51.87±8.644)5)6)51.08±8.554)5)6)33.48±5.051)2)4)5)6)73.35±10.141)2)3)4)5)6)23.150<0.001 F P 15.56±2.28 14.75±2.30 10.08±1.761)2)22.97±3.931)2)3)23.501<0.001 24.35±4.044)22.17±3.894)15.05±2.261)2)4)36.16±5.771)2)3)4)26.420<0.001 35.26±5.414)5)34.05±5.624)5)22.36±3.931)2)4)5)52.26±8.081)2)3)4)5)25.697<0.001
2.5 各组NK细胞表面NKG2D表达 与对照组和空白组相比,过表达组NK细胞表面NKG2D表达降低,低表达组NK细胞表面NKG2D表达增高,差异均有统计学意义(P<0.05),且对照组与空白组比较NK细胞表面NKG2D表达差异均无统计学意义(P>0.05)。见图3、表3。
表3 各组NK细胞表面NKG2D表达(±s,n=6,%)Tab.3 Expression of NKG2D on surface of NK cells in each group (±s,n=6,%)

表3 各组NK细胞表面NKG2D表达(±s,n=6,%)Tab.3 Expression of NKG2D on surface of NK cells in each group (±s,n=6,%)
Note:1)P<0.05 vs control group;2)P<0.05 vs blank group;3)P<0.05 vs over-expressed group.
Groups Control Blank Over-expressed Low-expressed NKG2D 67.62±10.64 65.85±10.93 44.26±7.741)2)98.85±15.421)2)3)22.850<0.001 F P
2.6 各组人脑胶质瘤细胞U251表面MICA、ULBP2、ULBP3表达 与对照组和空白组相比,过表达组人脑胶质瘤细胞U251表面MICA、ULBP2、ULBP3表达均降低,低表达组人脑胶质瘤细胞U251表面MICA、ULBP2、ULBP3表达均增高,差异均有统计学意义(P<0.05),且对照组与空白组比较人脑胶质瘤细胞U251表面MICA、ULBP2、ULBP3表达差异均无统计学意义(P>0.05)。见图4、表4。
表4 各组人脑胶质瘤细胞U251表面MICA、ULBP2、ULBP3表达(±s, n=6,%)Tab.4 Expressions of MICA, ULBP2 and ULBP3 on surface of human glioma cells U251 in each group(±s,n=6,%)

表4 各组人脑胶质瘤细胞U251表面MICA、ULBP2、ULBP3表达(±s, n=6,%)Tab.4 Expressions of MICA, ULBP2 and ULBP3 on surface of human glioma cells U251 in each group(±s,n=6,%)
Note:1)P<0.05 vs control group;2)P<0.05 vs blank group;3)P<0.05 vs over-expressed group.
Groups Control Blank Overexpressed Lowexpressed MICA 55.62±9.14 53.67±8.84 34.13±5.221)2)ULBP2 57.06±9.35 55.16±8.92 37.43±5.311)2)UMBP3 51.18±8.34 54.40±8.72 34.53±5.151)2)75.87±11.541)2)3)22.680<0.001 F P 79.45±10.871)2)3)26.922<0.001 82.87±12.151)2)3)24.516<0.001

图4 各组人脑胶质瘤细胞U251表面MICA、ULBP2、ULBP3表达Fig.4 Expressions of MICA, ULBP2 and ULBP3 on surface of human glioma cells U251 in each group
3 讨论
脑胶质瘤的发生发展是一个原癌基因和抑癌基因共同参与的多因素协同作用的过程,其具体发病机制尚不十分清晰。由于脑胶质瘤与脑组织无明显界限,传统的手术治疗难以完全切除,且血脑屏障对化疗药物渗透的限制作用使脑胶质瘤对化疗敏感性仅为中度,使得手术结合化疗治疗的模式具有复发率高、预后差等问题[7],因此寻求更加有效的治疗方法已成为脑胶质瘤治疗迫切需要解决的问题。
本研究中,各组细胞转染效率均在85%以上,说明成功转染人脑胶质瘤细胞U251。与对照组和空白组相比,过表达组miR-10b表达升高、NK细胞表面NKG2D表达和NK细胞杀伤活性降低,低表达组miR-10b表达降低、NK细胞表面NKG2D表达和NK细胞杀伤活性升高,且各组NK细胞杀伤活性均随效靶比升高而升高,推测miR-10b过表达是通过抑制NKG2D的表达降低NK细胞杀伤活性,而miR-10b低表达则是通过促进NKG2D的表达提高NK细胞杀伤活性。有报道指出,miR-10b在90%以上的脑胶质瘤细胞中呈高表达,且miR-10b高表达患者存在生存期短、预后差的问题,本研究结果与上述研究相一致[6]。NK细胞是机体重要的天然免疫细胞,在机体抗病毒感染及抗肿瘤过程中发挥免疫监视作用,被医学界认为是人体免疫的第一道防线。NK细胞不依赖于抗原的激活即具备对肿瘤细胞的杀伤作用,其不仅能有效监视并控制肿瘤的发生,而且对抑制肿瘤转移发挥重要作用[8]。NK细胞的杀伤活性与其表面的杀伤受体的表达密切相关,杀伤受体又分为杀伤活化受体和杀伤抑制受体[9]。NKG2D是NK细胞表面的主要杀伤活化受体,NKG2D的高表达能够诱导增加NK细胞的杀伤活性[10]。有研究显示,在垂体瘤患者中,由于NK细胞表面NKG2D表达受到抑制,导致NK细胞的杀伤活性明显降低[11]。
本研究中,与对照组、空白组相比,过表达组人脑胶质瘤细胞U251表面MICA、ULBP2、ULBP3表达均降低,低表达组人脑胶质瘤细胞U251表面MICA、ULBP2、ULBP3表达均升高,说明miR-10b过表达能明显降低人脑胶质瘤U251表面MICA、ULBP2和ULBP3的表达,miR-10b低表达会提高人脑胶质瘤细胞U251表面MICA、ULBP2、ULBP3的表达。人NKG2D配体主要分为MIC和ULBP家族2大类,MIC包括MICA和MICB,ULBP家族包括ULBP1-6共6个成员[12]。MIC多表达于上皮性肿瘤细胞表面,在正常组织细胞中几乎不表达,其表达水平的高低直接关系到NK细胞的抗肿瘤活性[13]。MICA是NKG2D受体的一种杀伤活化性配体,MICA的高表达同时能够上调NK细胞表面NKG2D的表达[14]。有报道指出NKG2D/MICA介导的免疫监视功能可激活NK细胞对肿瘤细胞的杀伤效应[15]。ULBP表达较广泛,在多种细胞、组织和肿瘤均有表达[16]。病毒尤其是巨细胞病毒能够下调肿瘤特异主要组织相容性复合物Ⅰ(major histocompatibility complex classⅠ,MHC-Ⅰ)的表达,诱导NK细胞表面的NKG2D受体与病毒感染细胞表面的ULBP结合,使NK细胞表面的活化分子表达显著上调,并刺激NK细胞产生干扰素-γ(interferon-γ,IFN-γ)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、巨噬细胞炎症蛋白-1β(macrophage inflammatory protein-1β,MIP-1β)等细胞因子,提高NK细胞对靶细胞的杀伤活性[17]。有研究发现,在人脑胶质瘤细胞表面MICA、ULBP2和ULBP3存在高表达,且NKG2D通过与人脑胶质瘤细胞表面的MICA、ULBP2和ULBP3结合激活NK细胞的杀伤活化效应[18],本研究结果与上述报道相一致,但本研究在上述研究基础上进一步探讨了miR-10b对人脑胶质瘤细胞免疫效应的调节作用及其机制。
综上所述,抑制miR-10b能明显增加人脑胶质瘤U251表面MICA、ULBP2和ULBP3的表达和NK细胞表面NKG2D表达从而提高NK的细胞杀伤活性,增强人脑胶质瘤细胞的免疫效应。本研究进一步阐释了miR-10b对人脑胶质瘤细胞免疫效应的调节作用及其机制,为临床治疗人脑胶质瘤药物的研发提供了理论依据。

