转录因子SP1调控MAP3K1表达影响糖尿病视网膜病变细胞凋亡和炎症反应
黄丹 邓芳祝 谢功泽 李巧莲
(1.郴州市第四人民医院眼科,郴州 423000;2.郴州市第一人民医院北院眼科,郴州 423000)
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病主要并发症,糖尿病仍是工作年龄人群视力丧失的主要原因[1-2]。研究表明糖尿病诱发的高血糖会增加冠心病、卒中和糖尿病微血管疾病等风险[3]。DR血管损伤的特征为血液-视网膜屏障破坏、毛细血管基底膜增厚和内皮细胞损伤引起的视网膜血流自动调节功能失调[4-5]。因此,人类视网膜微血管内皮细胞(human retinal microvascular endothelial cells,hRMECs)功能障碍的确切机制有待阐明,以便为DR患者制定有效治疗策略。
特异性蛋白1(SP1)是一种普遍表达的核转录因子,属于C2H2型锌指蛋白家族成员,介导基因表达并响应各种细胞外和细胞内信号调节基因表达,包括参与细胞生长及分化、细胞凋亡、纤维化和炎症[6]。敲低SP1可提高视网膜色素上皮细胞活力,降低高血糖或低氧条件下增加的细胞通透性和限制细胞迁移[7]。高血糖增加SP1在视网膜微血管中与MALAT1启动子的结合以提升lncRNA MALAT1水平,lncRNA MALAT1通常与炎症、血管生成和视网膜神经变性有关,在DR中发挥重要作用[8]。研究报道,DR中MAP3K1表达上调,激活NF-κB信号通路p65磷酸化,加剧视网膜微血管内皮细胞凋亡,加剧促炎因子释放[9]。干扰MAP3K1表达可抑制细胞凋亡[10]。因此,本实验旨在研究SP1对DR细胞凋亡和炎症反应的影响及其分子机制是否与MAP3K1有关。
1 材料与方法
1.1 材料 hRMECs购自广州吉妮欧生物科技有限公司;胎牛血清购自美国Hyclone公司;内皮细胞培养基购自美国ScienCell公司;si-NC、si-SP1、oe-NC和oe-MAP3K1均购自上海吉玛公司;LipofectamineTM2000购自北京科展生物科技有限公司;TRIzol试剂、逆转录试剂盒、RT-qPCR 试剂盒购自日本TaKaRa公司;细胞凋亡检测试剂盒购自美国Thermo Fisher scientific公司;TNF-α、IL-1β和IL-6 ELISA试剂盒购自上海酶联生物公司;Anti-IgG和Anti-SP1购自美国Abcam公司。
1.2 方法
1.2.1 细胞培养 hRMECs在含10%胎牛血清的内皮细胞培养基中于37 ℃、5%CO2、适宜湿度下培养,每周更新培养基2~3次。hRMECs分为高葡萄糖(HG)组和正常葡萄糖(Control)组。HG组用30 mmol/L D-葡萄糖培养,Control组用5 mmol/L D-葡萄糖处理,均在37 ℃培养48 h(5%CO2)。
1.2.2 细胞转染 HG组hRMECs使用LipofectamineTM2000试剂盒转染或共转染si-NC、si-SP1或oe-NC、oe-MAP3K1,将细胞分为si-NC组、si-SP1组、si-SP1+oe-NC组和si-SP1+oe-MAP3K1组,所有操作按照试剂盒说明书进行。转染完成48 h后收集细胞,RT-qPCR检测细胞mRNA表达,以确定是否转染成功。
1.2.3 RT-qPCR检测SP1和MAP3K1表达 TRIzol试剂提取总RNA,将其进行纯化定量,逆转录试剂盒合成cDNA。参照RT-qPCR试剂盒操作步骤进行扩增,检测SP1和MAP3K1表达。以GAPDH为内参,2-ΔΔCt分析其表达。SP1正向引物:5'-ACGCTTCACACGTTCGGATGAG-3',反向引物:5'-TGACAGGTGGTCACTCCTCATG-3';MAP3K1正向引物:5'-CCAGACCAGTATCTCAGGAGATG-3',反向引物:5'-CCGCTAAACTGTGGCAAGGAGT-3';GAPDH正向引物:5'-GTCTCCTCTGACTTCAACAGCG-3',反向引物:5'-ACCACCCTGTTGCTGTAGCCAA-3'。
1.2.4 流式细胞术检测细胞凋亡 转染和HG共处理48 h后,收集hRMECs。根据制造商说明,使用Annexin V-FITC/PI细胞凋亡检测试剂盒检测细胞凋亡。室温下用Annexin V-FITC黑暗培养20 min,加入碘化丙啶(PI),10 min后流式细胞仪检测细胞凋亡率。
1.2.5 ELISA检测细胞TNF-α、IL-1β和IL-6含量各组细胞4 ℃、12 000 r/min离心10 min,收集上清。参照说明书,采用ELISA试剂盒检测TNF-α、IL-1β和IL-6含量。
1.2.6 ChIP-qPCR 稳定生长的hRMECs中加入4%多聚甲醛室温固定10 min,超声处理2 h,将DNA剪成0.2~1.0 kb片段。4 ℃下13 000 r/min离心5 min收集上清。分别用阴性对照抗体Anti-IgG和目的蛋白特异性抗体Anti-SP1对细胞裂解物进行免疫沉淀过夜。qPCR分析沉淀物对MAP3K1启动子的富集能力。
1.3 统计学分析 采用SPSS22.0软件分析数据,数据以±s表示。两组比较使用t检验,多组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 HG处理的hRMECs中SP1和MAP3K1表达上调 与Control组相比较,HG处理的hRMECs中SP1和MAP3K1表达均升高(P<0.05,表1)。
表1 Control组和HG处理的hRMECs中SP1和MAP3K1表达(±s,n=9)Tab.1 Expressions of SP1 and MAP3K1 in control group and HG-treated hRMECs (±s,n=9)

表1 Control组和HG处理的hRMECs中SP1和MAP3K1表达(±s,n=9)Tab.1 Expressions of SP1 and MAP3K1 in control group and HG-treated hRMECs (±s,n=9)
Note:Compared with control group,1)P<0.05.
MAP3K1 1.00±0.08 2.17±0.261)20.54 0.000 Groups Control HG t P SP1 1.00±0.06 1.89±0.211)16.79 0.000
2.2 敲低SP1抑制HG诱导的hRMECs凋亡 在HG诱导的hRMECs中使用干扰技术抑制SP1表达,细胞凋亡能力检测显示,与Control组相比,HG组细胞凋亡率明显升高(P<0.05);与HG组相比,HG+si-NC组细胞凋亡率差异无统计学意义(P>0.05);与HG+si-NC组相比,HG+si-SP1组细胞凋亡率明显降低(P<0.05,图1)。表明敲低SP1可显著抑制HG诱导的hRMECs凋亡。

图1 各组细胞凋亡率比较Fig.1 Comparison of cell apoptosis rate in each group
2.3 敲低SP1抑制HG诱导的hRMECs炎症反应检测敲低SP1的HG诱导的hRMECs中炎症反应,与Control组相比,HG组细胞炎症因子TNF-α、IL-1β、IL-6表达明显增加(P<0.05);与HG组相比,HG+si-NC组细胞TNF-α、IL-1β和IL-6差异无统计学意义(P>0.05);与HG+si-NC组相比,HG+si-SP1组炎症因子TNF-α、IL-1β和IL-6含量明显减少(P<0.05,表2)。表明敲低SP1可抑制HG诱导的hRMECs炎症反应。
表2 各组细胞TNF-α、IL-1β和IL-6含量比较(±s,n=9)Tab.2 Comparison of TNF-α,IL-1β and IL-6 contents of cells in each group (±s,n=9)

表2 各组细胞TNF-α、IL-1β和IL-6含量比较(±s,n=9)Tab.2 Comparison of TNF-α,IL-1β and IL-6 contents of cells in each group (±s,n=9)
Note:Compared with control group,1)P<0.05;compared with HG+si-NC group,2)P<0.05.
IL-6 48.38±3.67 132.55±10.831)137.91±9.74 75.68±6.162)Groups Control HG HG+si-NC HG+si-SP1 TNF-α 35.76±2.87 162.35±12.191)168.43±14.77 69.51±5.252)IL-1β 17.63±1.38 68.28±5.141)72.81±6.14 35.46±2.742)
2.4 抑制SP1降低MAP3K1表达 JASPAR生物信息学网站分析显示,SP1与MAP3K1启动子存在结合位点(附图1,www.immune99.com)。为确定SP1与MAP3K1的启动子序列能够结合,ChIP-qPCR实验发现,在hRMECs中使用SP1特异性抗体沉淀的复合物中MAP3K1富集水平明显高于Anti-IgG(P<0.05,表3),抑制SP1表达后Anti-SP1对MAP3K1的富集水平明显降低(P<0.05,表4)。与HG+si-NC组相比,抑制SP1表达后MAP3K1表达明显降低(P<0.05,表5)。
表3 Anti-IgG和Anti-SP1对MAP3K1启动子序列的富集能力(±s,n=9)Tab.3 Enrichment ability of Anti-IgG and Anti-SP1 for MAP3K1 promoter sequences (±s,n=9)

表3 Anti-IgG和Anti-SP1对MAP3K1启动子序列的富集能力(±s,n=9)Tab.3 Enrichment ability of Anti-IgG and Anti-SP1 for MAP3K1 promoter sequences (±s,n=9)
Note:Compared with Anti-IgG group, 1)P<0.05.
MAP3K1 promoter 1.00±0.14 8.39±0.631)35.83 0.000 Groups Anti-IgG Anti-SP1 t P
表4 Anti-SP1对MAP3K1启动子序列的富集能力(±s,n=9)Tab.4 Enrichment ability of Anti-SP1 for MAP3K1 promoter sequences (±s,n=9)

表4 Anti-SP1对MAP3K1启动子序列的富集能力(±s,n=9)Tab.4 Enrichment ability of Anti-SP1 for MAP3K1 promoter sequences (±s,n=9)
Note:Compared with HG+si-NC group,1)P<0.05.
MAP3K1 promoter Groups 1.00±0.07 0.38±0.031)17.10 0.000 HG+si-NC HG+si-SP1 tP
表5 SP1敲低前后hRMECs中MAP3K1表达(±s,n=9)Tab.5 MAP3K1 expression in hRMECs before and after SP1 knockdown (±s,n=9)

表5 SP1敲低前后hRMECs中MAP3K1表达(±s,n=9)Tab.5 MAP3K1 expression in hRMECs before and after SP1 knockdown (±s,n=9)
Note:Compared with HG+si-NC group,1)P<0.05.
MAP3K1 promoter Groups 1.00±0.11 0.57±0.041)14.51 0.000 HG+si-NC HG+si-SP1 t P
2.5 过表达MAP3K1逆转si-SP1对HG诱导的hRMECs凋亡和炎症反应的抑制作用 在敲低SP1抑制HG诱导的hRMECs中进一步过表达MAP3K1,与HG+si-SP1+oe-NC相比,HG+si-SP1+oe-MAP3K1组MAP3K1表达升高,细胞凋亡率升高,炎症因子TNF-α、IL-1β和IL-6含量增加(P<0.05,图2、表6)。表明SP1通过调控MAP3K1影响HG诱导的hRMECs凋亡和炎症反应。

图2 细胞凋亡率比较Fig.2 Comparison of cell apoptosis rate
表6 干扰MAP3K1表达逆转si-SP1对hRMECs的作用(±s,n=9)Tab.6 Interference with MAP3K1 expression reverses effect of si-SP1 on hRMECs (±s,n=9)
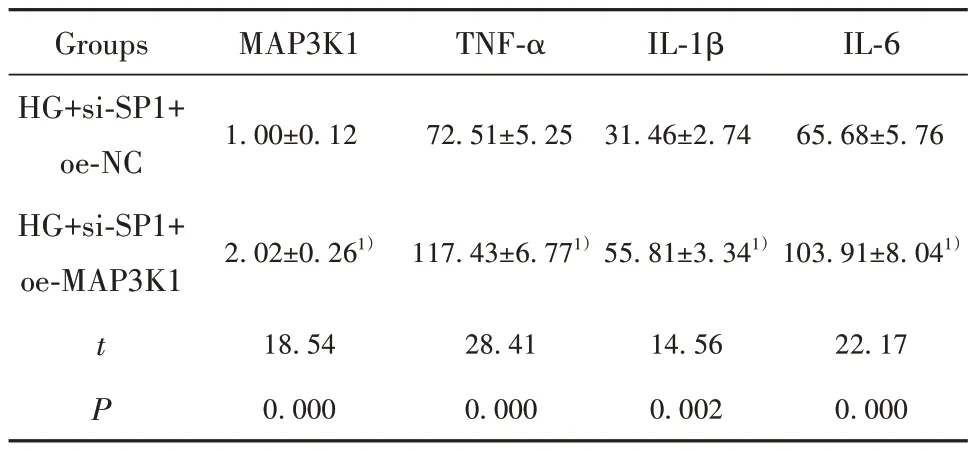
表6 干扰MAP3K1表达逆转si-SP1对hRMECs的作用(±s,n=9)Tab.6 Interference with MAP3K1 expression reverses effect of si-SP1 on hRMECs (±s,n=9)
Note:Compared with HG+si-SP1+oe-NC group, 1)P<0.05.
Groups HG+si-SP1+oe-NC HG+si-SP1+oe-MAP3K1 MAP3K1 TNF-α IL-1β IL-6 1.00±0.12 72.51±5.25 31.46±2.74 65.68±5.76 2.02±0.261)117.43±6.771)55.81±3.341)103.91±8.041)t P 22.17 0.000 18.54 0.000 28.41 0.000 14.56 0.002
3 讨论
全球糖尿病患者中DR总体患病率为35%,发病机制极为复杂[11]。随着糖尿病成为全球流行病,DR作为其严重微血管并发症之一,发病率也在上升[12-13]。视网膜内微血管异常增加了血管通透性和新血管形成,这些异常包括血管基底膜增厚、紧密连接失败、周细胞丧失和无细胞毛细血管形成。因此,毛细血管闭塞和非灌注导致局部缺血并引发病理性血管生成[14]。血管生成涉及现有脉管系统的新血管生长,以响应非灌注和缺血后发生的血液/氧气和营养物质供应减少[15]。DR的另一个重要分类是糖尿病性黄斑水肿,是一种积聚到神经视网膜中的液体导致视网膜异常增厚,且经常出现黄斑囊样水肿,是DR患者视力丧失的最常见原因[16-17]。DR早期高血糖是引起视网膜病理变化的主要诱因,与诱导氧化应激、炎症、增殖、新生血管等有关[18-19]。本研究已证明转录因子SP1参与DR炎症反应和hRMECs凋亡,进一步过表达MAP3K1逆转了si-SP1对HG诱导的hRMECs凋亡和炎症反应的抑制作用。从机制上讲,本研究表明SP1通过促进MAP3K1表达促进hRMECs凋亡及炎症反应。
SP1是锌指家族成员,与含GC-box的DNA结合。除SP1外,锌指蛋白家族成员还包括SP2、SP3和SP4,具有相似的DNA结合特异性,在基因调控中发挥不同作用。其中SP1作为被广泛研究的因子,已被证实可激活许多含GC-box的启动子[20]。SP1能够响应各种细胞外和细胞内信号调节多种基因表达,包括参与增殖、细胞周期、DNA修复和凋亡的基因[21]。研究发现SP1介导高血糖诱导的DR Robo4上调,影响细胞迁移、单层通透性和血管生成,表明SP1可能在DR微血管功能障碍中起重要作用[22]。此外,SP1的O-GlcNAc修饰介导高血糖时ICAM-1上调,导致视网膜损伤和炎症反应[23]。本研究通过构建DR模型,发现SP1在此模型中高表达。随后在hRMECs中干扰SP1表达,通过30 mmol/L D-葡萄糖诱导48 h,发现抑制SP1表达后,DR细胞凋亡率降低,炎症因子TNF-α、IL-1β和IL-6含量也降低,炎症反应被抑制,表明在DR细胞中降低SP1表达减轻了hRMECs凋亡和炎症反应。
为识别SP1的下游靶标mRNA,通过JASPAR生物信息学网站分析发现,SP1与MAP3K1启动子区域存在结合位点。ChIP-qPCR实验发现,SP1的特异性抗体可与MAP3K1结合,抑制SP1表达后MAP3K1表达明显降低,证实SP1可调控MAP3K1表达。文献报道,MAP3K1作为一种全长蛋白具有产生抗凋亡信号的潜力,MAP3K1上调发挥促凋亡作用[10]。此外,AL-SADI等[24]指出MAP3K1通过经典NF-κB通路与肠道炎症密切关联,刺激炎症发生。抑制MAP3K1会减轻HG诱导的hRMECs凋亡和促炎因子释放[9]。M2巨噬细胞可通过抑制MAPK通路FGFR2、MAP3K1、MRAS、BRAF和p-ERK表达,保护肾小球内皮细胞免受糖基化产物损害[25]。本研究显示,MAP3K1在DR细胞模型中高表达,与XU等[9]结果一致。本实验还发现进一步过表达MAP3K1逆转了si-SP1对HG诱导的hRMECs凋亡和炎症反应的抑制作用。
综上,DR中,转录因子SP1通过促进MAP3K1表达,促进细胞凋亡及加剧促炎因子释放。表明SP1参与DR进展,为DR提供了潜在治疗靶点。

