化痰通腑方通过TGF-β1/Smad3信号通路对脓毒症肺损伤患者抗炎反应及预后的作用机制
宋琳琳,齐红松,孔玲玲
1. 河南大学第一附属医院急诊科,河南 开封 475000
2. 河南大学第一附属医院呼吸与危重症医学科,河南 开封475000
3. 河南大学第一附属医院急诊重症医学科,河南 开封 475000
1 临床资料
1.1 诊断标准
1.1.1 脓毒症参考《拯救脓毒症运动:脓毒症与脓毒性休克治疗国际指南2021》诊断标准:体温>38 ℃或<36 ℃;心率>90 次/min;呼吸频率>20 次/min或二氧化碳分压<4.3 kPa;白细胞计数>12.0×109/L或<4.0×109/L,或杆状核粒细胞>0.01。符合2 项以上表现,即可明确感染[5]。
1.1.2 急性肺损伤参考中华医学会重症医学分会发布的《急性肺损伤/急性呼吸窘迫综合征诊断与治疗指南(2006)》[6]中的诊断标准:急性起病;氧合指数[动脉血氧发压(PaO2)/吸入氧浓度(FiO2)]≤300 mm Hg;影像学检查显示双肺有斑片状阴影;肺动脉嵌顿压≤18 mm Hg,或无左心房压力增高的证据。
1.2 辨证标准痰热壅肺证主症:咳嗽喘息,痰黄,腹胀满,大便难。次症:气粗息促,或喉中有痰声,胸胁胀满,面赤,身热,口干欲饮,舌质红或有瘀斑,舌苔黄或黄腻,脉滑数。
1.3 纳入标准符合脓毒症急性肺损伤诊断标准且中医辨证符合痰热壅肺证的患者;年龄18~65 周岁;因重大外伤或急性化脓性阑尾炎、胰腺炎、肠梗阻等急性外科原发病引起急性肺损伤的患者;知情同意参与本次研究并签署名字的患者。
1.4 排除标准有严重的器官系统疾病者,如心血管疾病、肝功能损伤、肾功能障碍、凝血系统损伤等;妊娠期或哺乳期妇女;精神障碍患者;有中医治疗禁忌证的患者。
1.5 一般资料研究对象为80 例脓毒症肺损伤患者,研究时间为2019 年3 月—2022 年12 月。将80 例患者按随机数字表法分为2 组各40 例。对照组男25 例,女15 例;年龄38~62 周岁,平均(50.78±11.25)岁。研究组男24 例,女16 例;年龄40~64 周岁,平均(52.53±11.48)岁。2 组一般资料经统计学处理,差异均无统计学意义(P>0.05),具有可比性。
2 治疗方法
2.1 对照组予基础治疗。积极治疗原发病,包含处理创伤、手术、行胸腔引流等;进行基础对症治疗,包含抗感染、营养支持以及维持水电解质平衡等;提供呼吸支持,包含吸氧、机械通气等。
存在为了保证财政拨给高等院校的运营经费不留余额和下年度运营经费的预算额度考虑,财务部门往往会将项目(课题)报销支出的经费串户从财政零余额账户资金或财政直接支付账户支付,截留了项目(课题)课题经费。
2.2 研究组在对照组基础治疗上加用化痰通腑方。处方:瓜蒌30 g,大黄、胆南星、芒硝、黄芩、枳壳各10 g,川楝子、莱菔子各15 g,甘草3 g。由院内中药制剂室煎煮,每天1 剂,取汁300 mL,分早、晚2 次口服,或鼻饲服药,连续用药5 d。
3 观察指标与统计学方法
3.1 观察指标①疗效性指标。包含入住重症监护室(ICU)时间、机械通气时间以及根据1 个月随访结果记录28 d 病死率。②血气分析。比较2 组用药前和用药5 天后血气分析变化,包含PaO2/FiO2和肺泡动脉氧分压差[Pa(A-a)O2]。③炎症因子。比较2 组用药前和用药5 天后炎症因子水平变化,包含肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-8(IL-8);试剂盒购自上海晶抗生物科技有限公司。④血清转化生长因子-β1(TGF-β1)含量和Smad 3 蛋白表达水平。采集对照组和研究组患者用药前和用药5 天后的外周静脉血并分离血清,采用ELISA 法检测并比较。⑤脓毒症症状评分。其中高热症状分别计0、2、4 分,0 分为体温<37.5 ℃,2 分为体温37.5~38.5 ℃,4 分为体温>38.5 ℃。神昏烦躁症状分别计0、2、4 分,0 分为无症状,2 分为嗜睡或昏睡或轻度烦躁,4 分为昏迷或重度烦躁需应用镇静药物。气喘短促症状分别计0、2、4 分,0 分为无症状,2 分为呼吸频率为30~35 次/min,4 分为呼吸频率>35 次/min。咳嗽、咳痰症状分别计0、2、4 分,0 分为无或偶有咳嗽、咳痰,2 分为时有咳嗽,咳痰色微黄,每天咳痰量<20 mL,4 分为时时咳嗽,痰色黄质黏,每天咳痰量≥20 mL。脘腹疼痛症状分别计0、2、4 分,0 分为无症状,2 分为腹痛可忍,但发作较频繁,4 分为腹痛难忍,持续不断,需服用止痛药。恶心呕吐症状分别计0、2、4 分,0 分为无症状,2 分为时有恶心呕吐,胃残余量≤200 mL/24 h,4 分为频频恶心呕吐,胃残余量>200 mL/24 h。相加即为脓毒症症状评分总分,计算脓毒症症状评分治疗前后降低率为疗效指数。⑥临床疗效。
3.2 统计学方法采用SPSS23.0 软件进行数据整理和分析。计量资料以均数±标准差(±s)表示,若符合正态分布则采用配对t检验比较组内治疗前后数据,采用成组t检验比较组间数据;不符合正态分布则采用非参数检验;计数资料以百分比(%)表示,并采用χ2检验。P<0.05 为差异有统计学意义。
4 疗效标准与治疗结果
4.1 疗效标准治愈:临床症状及体征基本消失,实验室指标明显好转,疗效指数≥95%;显效:临床症状及体征明显好转,实验室指标明显改善,70%≤疗效指数<95%;有效:临床症状及体征改善,实验室指标好转,30%≤疗效指数<70%;无效:临床症状及体征无改善或加重,疗效指数<30%。
4.2 2 组治疗前后脓毒症症状评分比较见表1。治疗前,2 组各项脓毒症症状评分比较,差异均无统计学意义(P>0.05),具有可比性。治疗结束后,2 组各项脓毒症症状评分(恶心呕吐评分除外)均低于治疗前,差异均有统计学意义(P<0.05);研究组各项脓毒症症状评分均低于对照组,差异有统计学意义(P<0.05)。
表1 2组治疗前后脓毒症症状评分比较(±s) 分

表1 2组治疗前后脓毒症症状评分比较(±s) 分
组 别例数P对照组研究组t 值P 值40 40治疗后1.80±0.61 1.15±1.00 3.510 0.001 t 值12.854 16.004组 别例数对照组研究组t 值P 值40 40高热治疗前3.75±0.67 3.85±0.53 0.739 0.462咳嗽咳痰治疗前3.50±0.88 3.60±0.81 0.530 0.598神昏烦躁治疗前3.40±0.93 3.45±0.90 0.244 0.808脘腹疼痛治疗前1.35±0.95 1.40±0.93 0.238 0.812<0.001<0.001治疗后2.00±0.64 1.20±0.99 4.284<0.001 t 值7.851 13.795 P P<0.001<0.001气喘短促治疗前3.95±0.32 4.00±0.64 0.442 0.660恶心呕吐治疗前2.15±0.83 2.05±0.55 0.632 0.529治疗后1.95±0.32 1.10±1.01 5.090<0.001 t 值27.928 18.002<0.001<0.001治疗后1.95±0.32 1.35±0.95 3.795<0.001 t 值10.218 17.598 P<0.001<0.001治疗后0.90±1.01 0.60±0.93 1.385 0.170 t 值3.365 5.099 P 值<0.001 0.002治疗后1.85±0.53 1.35±0.95 2.905 0.005 t 值1.964 4.149 P 值0.057<0.001
4.3 2 组疗效性指标比较见表2。研究组入住ICU时间和机械通气时间均短于对照组,差异均有统计学意义(P<0.05);为期1 个月的随访结果显示,2 组均无28 d 病死病例,差异无统计学意义(P>0.05)。
表2 2 组疗效性指标比较(±s)d

表2 2 组疗效性指标比较(±s)d
例数40 40组 别对照组研究组t 值P 值入住ICU 时间11.74±2.31 9.85±2.46 3.518 0.001机械通气时间7.53±1.42 6.08±1.35 4.696<0.001
4.4 2 组临床疗效比较见表3。总有效率研究组92.50%,对照组75.00%,2 组比较,差异有统计学意义(P<0.05)。

表3 2 组临床疗效比较 例(%)
4.5 2 组治疗前后血气分析比较见表4。治疗前,2 组PaO2/FiO2、Pa(A-a)O2比较,差异均无统计学意义(P>0.05),具有可比性。治疗结束后,2 组PaO2/FiO2均高于治疗前,差异均有统计学意义(P<0.05);研究组PaO2/FiO2高于对照组,差异均有统计学意义(P<0.05)。治疗结束后,2 组Pa(A-a)O2均低于治疗前,差异均有统计学意义(P<0.05);研究组Pa(A-a)O2低于对照组,差异有统计学意义(P<0.05)。
表4 2 组治疗前后血气分析比较(±s) mm Hg
注:1 mm Hg≈0.133 kPa
组 别对照组研究组t 值P 值例数40 40 PaO2/FiO2 Pa(A-a)O2治疗前216.28±21.53 218.38±21.31 0.438 0.662治疗结束后255.23±28.43 278.60±30.38 3.554 0.001 t 值6.867 11.577 P 治疗前125.05±10.83 126.13±10.94 0.442 0.660治疗结束后80.88±7.42 63.33±6.35 11.360<0.001 t 值20.884 31.480 P<0.001<0.001<0.001<0.001
4.6 2 组治疗前后炎症因子水平比较见表5。治疗前,2 组血清TNF-α、IL-6、IL-8 含量比较,差异均无统计学意义(P>0.05),具有可比性。治疗结束后,2 组血清TNF-α、IL-6、IL-8 含量均低于治疗前,差异均有统计学意义(P<0.05);研究组血清TNF-α、IL-6、IL-8 含量均低于对照组,差异均有统计学意义(P<0.05)。
表5 2 组治疗前后炎症因子水平比较(±s)

表5 2 组治疗前后炎症因子水平比较(±s)
组 别例数TNF-α(µg/L)IL-6(ng/L)IL-8(ng/L)P对照组研究组t 值P 值40 40治疗前362.63±35.75 359.86±31.16 0.369 0.713治疗后231.29±35.56 148.32±31.82 10.998<0.001 t 值16.615 27.589治疗前53.16±14.44 54.75±13.44 0.513 0.609治疗后37.88±10.21 25.60±10.93 5.191<0.001 t 值6.386 12.342 P 治疗前39.48±6.74 38.59±6.81 0.594 0.554治疗后31.36±3.87 20.94±2.26 14.727<0.001 t 值6.560 15.986 P<0.001<0.001<0.001<0.001<0.001<0.001
4.7 2 组治疗前后TGF-β1 及Smad3 蛋白表达水平比较见表6。治疗前,2 组血清TGF-β1 含量及Smad 3 蛋白表达水平比较,差异均无统计学意义(P>0.05),具有可比性。治疗结束后,2 组血清TGF-β1含量及Smad 3 蛋白表达水平均低于治疗前,差异均有统计学意义(P<0.05);研究组血清TGF-β1 含量及Smad 3 蛋白表达水平均低于对照组,差异均有统计学意义(P<0.05)。
表6 2 组治疗前后TGF-β1 及Smad3 蛋白表达水平比较(±s)
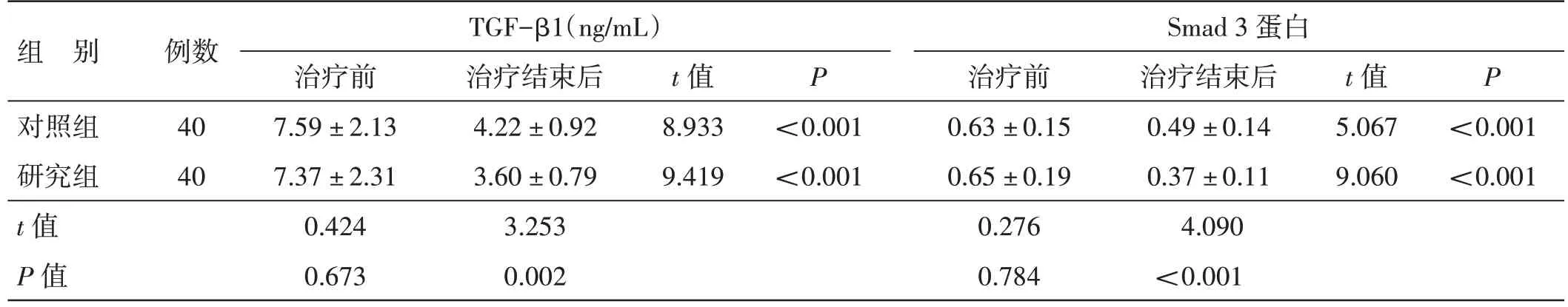
表6 2 组治疗前后TGF-β1 及Smad3 蛋白表达水平比较(±s)
组 别例数TGF-β1(ng/mL)Smad 3 蛋白对照组研究组t 值P 值40 40治疗前7.59±2.13 7.37±2.31 0.424 0.673治疗结束后4.22±0.92 3.60±0.79 3.253 0.002 t 值8.933 9.419 P 治疗前0.63±0.15 0.65±0.19 0.276 0.784治疗结束后0.49±0.14 0.37±0.11 4.090<0.001 t 值5.067 9.060 P<0.001<0.001<0.001<0.001
5 讨论
脓毒症急性肺损伤的发病过程中,在多种炎症细胞的影响作用下机体可释放多种促炎细胞因子引起炎症反应,同时也分泌部分抗炎细胞因子对抗炎症反应,二者之间维持的动态平衡是机体内环境稳定的关键,而促炎因子和抗炎因子的失衡所致的炎症免疫失衡反应则是导致脓毒症并发急性肺损伤的原因之一,同时可引发机体发生免疫紊乱。导致脓毒症患者并发肺损伤的原因除炎症反应外,组织因子介导凝血酶生成导致的凝血功能异常会随着凝血激活直接或间接作用下影响炎症反应,凝血导致的纤维蛋白溶解沉积可刺激纤维细胞聚集,随着聚集和胶原沉积又可导致肺间质纤维化,进一步加重肺损伤。此外,氧自由基释放过多或氧自由基清除能力下降导致体内氧自由基过负荷也可导致肺组织细胞损伤[7-9]。
脓毒症属中医外感热病、温毒等范畴。中医学认为,本病的病因病机在于外科疾病导致的脏腑气血损伤,气机壅滞,郁而化热,痰热进一步阻滞气机。《素问·至真要大论》载:“诸气膹郁,皆属于肺。”肺与大肠相表里,肺气郁结,宣降失司,则可影响胃肠气机,胃肠气机不畅,又加重肺气郁闭[10-11]。因此,通肠腑之气则利肺气,肺气降则腑气通。本研究采用院内所拟方化痰通腑方,方中大黄、黄芩为君,二药清热解毒、攻积逐瘀;臣药为芒硝,可助大黄荡涤之功;佐以莱菔子下气导滞,助通降腑气,川楝子行气活血,瓜蒌清热涤痰、宽胸散结,胆南星清热化痰,枳壳理气宽中、行滞消胀,甘草为使调和诸药。全方共奏清热化痰解毒、通腑理气泻浊之效。现代药理研究表明,瓜蒌皮中脂肪酸类成分具有抗炎活性[12];胆南星中胆汁酸类、黄酮类、酚类、核苷类和糖类成分具有清热、抗炎镇痛、抗惊厥、抗氧化等作用[13]。
本研究结果表明,治疗结束后研究组脓毒症症状评分均低于对照组,研究组入住ICU 时间和机械通气时间短于对照组,2 组均无28 d 病死病例,治疗总有效率研究组92.50%高于对照组75.00%,表明化痰通腑方对脓毒症肺损伤患者疗效较好,患者预后也相对较好。2 组血气分析情况显示,治疗结束后研究组PaO2/FiO2高于对照组,研究组Pa(A-a)O2低于对照组,表明化痰通腑方有助于改善患者肺通气功能。
免疫炎症反应是脓毒症肺损伤最直接的影响机制,内毒素作为全身炎症反应的触发剂,TNF-α、IL-6、IL-8 等在内的多种细胞因子参与了其中的启动。TNF-α 可与肺组织上的TNF 受体结合导致溶酶体损伤,酶蛋白外泄从而引起肺损伤,同时,TNF-α可刺激巨噬细胞产生IL-6、IL-8 等炎性细胞因子并级联放大炎症反应,进一步加重肺组织损伤。IL-6被认为是炎症状态的标志,脓毒症患者肺部组织是产生IL-6 的主要器官。IL-8 是趋化和刺激因子,可诱导细胞变性反应并释放氧自由基和溶酶体酶类物质,破坏血管内皮层的通透性,导致肺组织损伤和肺循环障碍[14-15]。治疗结束后研究组血清TNF-α、IL-6、IL-8 含量均低于对照组,表明化痰通腑方有助于减轻脓毒症肺损伤患者机体炎症反应。
TGF-β1 参与炎症反应的发生、进展和消退。有研究报道TGF-β1 可促进单核巨噬细胞失活,同时抑制TNF-α 以及白细胞介素-1(IL-1)的产生,具有显著的炎症抑制效应[16]。另一项动物研究表明,对于脂多糖诱导的脓毒症小鼠采用TGF-β1 调节可影响小鼠生存率[17]。研究表明,TGF-β1/Smad 信号通路激活可能介导了急性肺损伤大鼠肺纤维化的过程以及炎症反应[18]。TGF-β1 具体的信号通路作用途径首先是通过细胞质膜上的受体被识别后发生磷酸化并将信号传递到细胞内的Smad 家族蛋白。Smad 蛋白分型众多,其中Smad1、2、3、5、8、9 均为受体活化性蛋白。以Smad 3 蛋白为例,Smad 3 磷酸化后可与其他的Smad 家族蛋白形成复合物,转移入核后与DNA结合辅助因子共同参与调控转录反应,由此调控TGF-β1 功能。Smad 3 蛋白可通过调节巨噬细胞、T 淋巴细胞等免疫炎症细胞功能参与调控机体免疫反应,激活后的Smad3 蛋白对巨噬细胞具有抑制效应[19]。一项对敲除Smad3 基因小鼠的研究表明,Smad3 基因缺失会致使T 细胞活化增强以及可能导致自噬增加[20]。治疗结束后研究组血清TGF-β1 含量和Smad3蛋白表达水平均低于对照组,表明化痰通腑方可能通过抑制TGF-β1/Smad 3 信号通路发挥抗炎效应和减轻机体炎症程度的作用。
综上所述,化痰通腑方对于脓毒症肺损伤患者的疗效较好,有助于降低患者血清内TNF-α、IL-6、IL-8 等炎性因子含量,改善机体的抗炎水平,其作用机制可能是通过抑制TGF-β1/Smad 3 信号通路实现。

