基于Au-g-C3N4 NS纳米复合材料的分子印迹电化学发光传感器检测
叶酸 向莉 刘意明 杨敏丽


DOI: 10.3969/J.ISSN.1000-5137.2024.01.003
收稿日期: 2023-11-01
基金項目: 上海师范大学“仪器分析”课程教学团队建设项目(304-AC9103-21-368011523)
作者简介: 向 莉(1998—), 女, 硕士研究生, 主要从事电化学发光传感器等方面的研究. E-mail: xl120421@163.com
* 通信作者: 杨敏丽(1965—), 女, 教授, 主要从事生物传感器及电化学发光分析等方面的研究. E-mail:yml_nx@shnu.edu.cn
引用格式: 向莉, 刘意明, 杨敏丽. 基于Au-g-C3N4 NS纳米复合材料的分子印迹电化学发光传感器检测叶酸 [J]. 上海师范大学学报 (自然科学版中英文), 2024,53(1):17?27.
Citation format: XIANG L, LIU Y M, YANG M L. A molecule-imprinted electrochemiluminescence sensor based on Au-g-C3N4 NS nanocomposite for detection of folic acid [J]. Journal of Shanghai Normal University (Natural Sciences), 2024,53(1):17?27.
摘 要: 近年来,作为一种新型的二维半导体纳米材料,石墨相氮化碳纳米薄片(g-C3N4 NS)因其优异的电化学发光(ECL)性能和良好的成膜特性在ECL传感领域备受关注。然而,g-C3N4 NS在较高的工作电压下产生的ECL信号不稳定,而金纳米粒子(Au NPs)的引入可明显改善其发光稳定性. 基于这个特点,采用原位生长法将Au NPs引入g-C3N4 NS中,制备了一种金-石墨相氮化碳纳米复合材料(Au-g-C3N4 NS),以其作为ECL物质固定在电极上. 同时,引入具有专一识别能力的分子印迹聚合物(MIP),构建了一种检测叶酸(FA)的分子印迹-电化学发光(MIP-ECL)传感器. 该传感器对FA表现出良好的选择性和灵敏响应,在优化的条件下,信号变化与FA物质的量浓度在1.0×10-10~1.0×10-3 mol·L-1的范围内呈良好的线性关系,检出限(LOD)达到0.07 nmol·L-1. 并且探讨了检测机理,考察了传感器的稳定性和重现性,将传感器用于实际样品中FA的检测,获得满意结果.
关键词: 电化学发光(ECL); 金-石墨相氮化碳纳米复合材料(Au-g-C3N4 NS); 分子印迹聚合物(MIP); 叶酸(FA)
中图分类号: O 657.1 文献标志码: A 文章编号: 1000-5137(2024)01-0017-11
Abstract: As a new type of two-dimensional semiconductor nanomaterials, graphite-phase carbon nitride nanosheets(g-C3N4 NS) have attracted much attention in the field of electrochemiluminescence(ECL) sensing due to their excellent ECL performance and excellent film forming properties. However, the ECL signal generated by g-C3N4 NS is unstable at higher operating voltages. The introduction of gold nanoparticles(Au NPs) can significantly improve the luminescence stability. Accordingly, Au NPs were introduced into g-C3N4 NS through in situ growth to obtain Au-g-C3N4 NS which was fixed on the electrode as the ECL substance. Meanwhile, a molecularly imprinted polymer(MIP) with specific recognition ability was introduced to construct a MIP-ECL sensor for detecting folic acid (FA). The sensor showed a high selectivity and sensitivity to FA. The ECL signal showed a good linear relationship with FA concentration in the range of 1.0×10-10-1.0×10-3 mol·L-1, and the limit of detection(LOD) was 0.07 nmol·L-1. The sensor was used to detect folic acid in the samples, and satisfactory results were obtained.
Key words: electrochemiluminescence(ECL); Au-g-C3N4 NS nanocomposite(Au-g-C3N4 NS); molecularly imprinted polymer(MIP); folic acid(FA)
0 引 言
叶酸(FA),又称维生素B9,是一种水溶性维生素,对细胞的生长和分化至关重要[1-2]. 人体内缺乏FA会引发一系列慢性疾病,包括精神病、癌症、中风、巨红细胞性贫血、白细胞减少和智力退化等. 过量的FA会干扰维生素B12和锌的吸收,导致其他健康问题[3-5]. 因此,為了规避这些风险,对临床人体生物样品中FA的定量检测非常必要.
目前,检测FA的方法主要有高效液相色谱法[6-7]、荧光法[8-9]、化学发光法[10-11]、电化学法[12]等. 这些方法都有各自的优点,但是也存在各自的问题,例如高效液相色谱法的样品预处理复杂、分析成本高;荧光法易受到背景和猝灭效应的影响;化学发光法可用体系有限;电化学方法的重复性较差. 电化学发光(ECL)是利用电化学反应诱导产生化学发光的一种检测方法,具有简单、灵敏、快速、高效的优点,受到众多分析工作者的青睐. 但ECL检测存在的一个最大问题是共存物质的干扰. 排除干扰最有效的办法是利用生物亲和反应,通过相应适体[13]或抗原与抗体[14]的特异性反应来提高选择性. 但昂贵的生物试剂使检测成本大大提高,而且操作变得复杂,条件苛刻. 近几年,人们更倾向于分子印迹技术. 分子印迹聚合物(MIP)是一种由功能单体和模板分子聚合产生的人工受体,它对目标分析物具有特异性识别作用,而且MIP 稳定性好、制备简单、成本低,被广泛应用于化学传感领域[15-16].
石墨相氮化碳纳米薄片(g-C3N4 NS)是一种新型的ECL纳米材料,具有制备简单、成本低廉、生物相容性好、性能稳定等优点. 在g-C3N4 NS中引入金纳米粒子(Au NPs),可进一步改善其导电性和发光稳定性. 本文制备了一种Au-g-C3N4 NS纳米复合材料,结合MIP技术,构建了一种测定FA的分子印迹-电化学发光(MIP-ECL)传感器. 传感器对FA的线性响应范围在1.0×10-10~1.0×10-3 mol·L-1,检出限(LOD)为0.07 nmol·L-1.
1 实验部分
1.1 实验试剂
三聚氰胺(C3H6N6)、过硫酸钾(K2S2O8)、FA均购于上海Aladdin工业公司;无水乙醇、四水合氯金酸(HAuCl4·4H2O)购于Sigma-Aladdin;丙烯酰胺(AAM)、硼氢化钠(NaBH4)、柠檬酸钠、磷酸二氢钾(KH2PO4)、磷酸氢二钾(K2HPO4)、氯化钾(KCl)、盐酸(HCl)、氢氧化钠(NaOH)、多巴胺(DA)、酪氨酸(Tyr)、尿酸(UA)、抗坏血酸(AA)、葡萄糖(Glu)均购于上海Adamas试剂公司. 所有药品均为分析纯,溶液用超纯水配制.
1.2 实验仪器
透射电子显微镜(TEM),日本电子公司,JEM-2010;紫外分光光度仪,日本岛津公司,UV-1800;荧光分光光度仪,日本岛津公司,RF-5301PC;恒温干燥箱,上海跃进医疗器械厂,GZX-DH-X;离心机,上海安亭科学仪器厂,TGL-16C;数控超声波清洗仪,昆山市超声仪器有限公司,KQ-100DE;恒温磁力搅拌器,上海梅颖浦仪器制造有限公司,95-I;pH计,上海洛奇特电子设备有限公司,PHS-25;马弗炉,上海慧泰仪器制造有限公司,PRD-C3000;电化学工作站,上海辰华仪器有限公司,CHI 660E;ECL分析系统,西安瑞迈分子仪器责任有限公司,MPI-A/B三电极系统,工作电极为玻碳电极(GCE),铂(Pt)丝为对电极,银/氯化银(Ag/AgCl)电极(饱和KCl溶液)为参比电极.
1.3 g-C3N4 NS的合成
按照前期报道的方法合成g-C3N4 NS,具体方法见文献[17].
1.4 Au-g-C3N4 NS纳米复合材料的制备
Au-g-C3N4 NS的合成采用原位生长法[18]:(1) 将10 μL 0.01 mol·L-1的HAuCl4·4H2O溶液倒入不断搅拌的2 mL 1 mg·L-1的g-C3N4 NS分散液中,超声10 min后继续室温搅拌2 h;(2) 向溶液中快速加入25 μL新制的0.01 mol·L-1 NaBH4溶液,持续搅拌20 min,使四氯合金离子(AuCl4-)还原为Au;(3) 向上述溶液中添加10 μL 0.01 mol·L-1柠檬酸钠溶液,搅拌30 min,柠檬酸钠作为稳定剂保护金属的成核位点;(4) 将溶液离心,除去多余的NaBH4、柠檬酸钠和未结合的Au NPs,用去离子水彻底清洗沉淀. 最后,将其分散于1 mL水中待用. 此材料标记为Au-g-C3N4 NS.
1.5 MIP-ECL传感器的构建
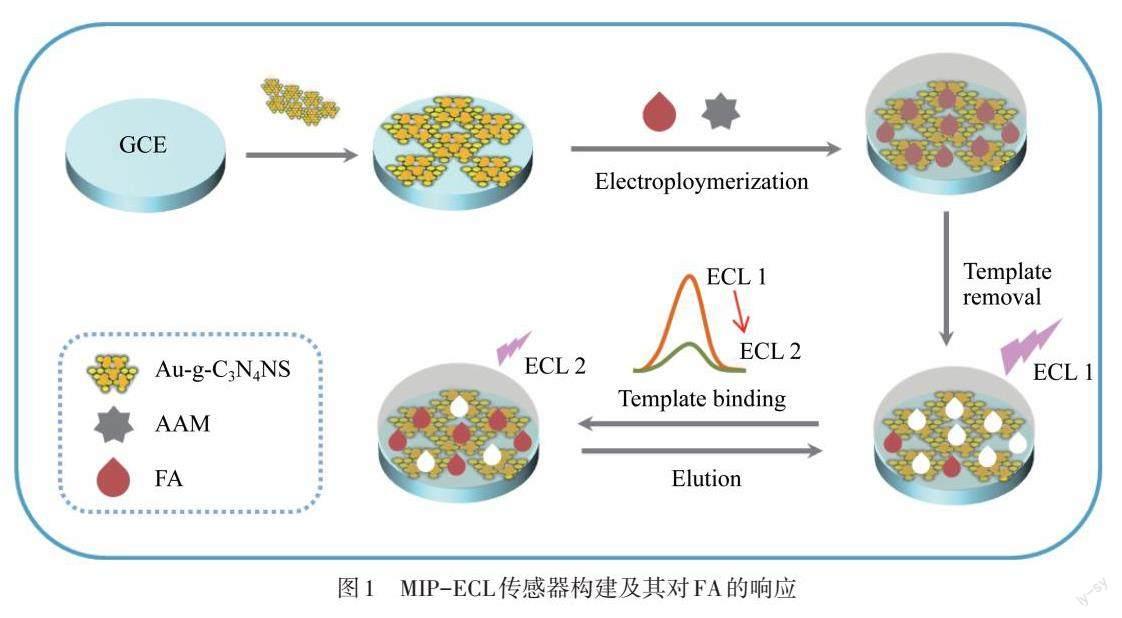
传感器的构建过程如图1所示. 先用0.5 μm 氧化铝(Al2O3)反复抛光GCE至光滑,用无水乙醇和去离子水超声冲洗. 取6.0 μL Au-g-C3N4 NS悬浮液滴涂在处理好的GCE上,室温晾干. 将此电极插入含有3 mmol·L-1 FA与9 mmol·L-1 AAM的0.1 mol·L-1磷酸缓冲溶液(PBS)(pH=7.5)溶液中,在0~1.4 V电压范围内扫描10圈,在电极表面引入MIP膜,记为MIP/Au-g-C3N4 NS/GCE修饰电极. 将该修饰电极浸入无水乙醇和2 mol·L-1 NaOH的混合溶液(体积比为7∶3),浸洗20 min,除去FA模板分子,得到能特异性结合FA的分子印迹传感器,记为MIP-ECL传感器. 作为比较,用同样方法(聚合液中不含FA)制备了非分子印迹传感器(NIP-ECL).

图1 MIP-ECL传感器构建及其对FA的响应
1.6 ECL检测
采用三电极系统,以修饰电极为工作电极,Pt丝为对电极,Ag/AgCl电极为参比电极,插入到pH=7.5的0.1 mol·L-1 PBS溶液(含0.1 mol·L-1 K2S2O8)中,在0~-1.5 V的范围内以100 mV·s-1的扫速扫描,记录ECL信号(光电倍增管电压为-600 V). 检测FA时,将制备好的MIP-ECL传感器浸入含不同物质的量浓度FA的PBS(0.1 mol·L-1,pH=7.5)中,孵育15 min,取出后用蒸馏水冲洗干净,除去非特异性吸附的FA,再转入ECL检测底液中,按照上述方法测试ECL信号.
2 结果与讨论
2.1 Au-g-C3N4 NS的表征
图2是g-C3N4 NS和Au-g-C3N4 NS的TEM图. 可以看出,g-C3N4 NS呈现均匀的二维片状结构,加入Au NPs后,其表面分布了大量黑色圆点,证明Au NPs被成功掺入到g-C3N4 NS中.

图2 (a) g-C3N4 NS和(b) Au-g-C3N4 NS的TEM图
为了进一步证明Au-g-C3N4 NS的成功合成,分别测试了g-C3N4 NS和Au-g-C3N4 NS的紫外-可见吸收(UV-vis)谱图,如图3所示. 与g-C3N4 NS(黑线)比较,Au-g-C3N4 NS(红线)在520 nm出现了新的吸收峰,这恰好对应着Au NPs特征吸收峰[18],进一步证明Au-g-C3N4 NS的成功合成.

图3 g-C3N4 NS(黑线)和Au-g-C3N4 NS(红线)的UV-vis谱图
2.2 Au NPs的作用
Au NPs具有比表面积大、导电性良好的特点,常被用来修饰电极以提高检测的灵敏度[19]. 本研究将Au NPs掺入到g-C3N4 NS中,比较了掺入前后的ECL信号. 发现在0~-1.0 V电位窗口下,g-C3N4 NS能发射稳定的ECL信号,当电位窗口扩大到0~-1.5 V时,其ECL信号变得不够稳定,呈现出逐步下降的趋势;而掺入Au NPs后,在0~-1.5 V窗口下的信号保持稳定,而且信号强度有所增加. 说明Au NPs的掺入能够稳定g-C3N4 NS,同时还可以提高信号强度. 分析原因为在较高的负电位下,高能量电子大量注入到g-C3N4 NS导带中,使电极表面发生钝化,阻碍了g-C3N4 NS与溶液中共反应剂过硫酸根离子(S2O82-)的反应,从而使ECL信号下降. 当Au NPs掺入到g-C3N4 NS中后,它能够接收更多过量的电子,避免了过量电子注入g-C3N4 NS导带而导致电极表面钝化的现象,从而使ECL信号保持稳定[20]. 同时,其良好的导电性加快了电子转移速度,使信号进一步增强.
2.3 MIP-ECL传感器的表征
为了验证传感器制备成功,分别记录了电极修饰过程中的电化学阻抗谱(EIS)、循环伏安(CV)和ECL信号,如图4所示.

图4 不同修饰电极的(a) EIS响应曲线、(b) CV响应曲线及(c) ECL响应曲线
图4(a)是不同修饰电极在5 mmol·L-1 [Fe(CN)6]3-/4-(含0.1 mol·L-1 KCl)溶液中的EIS谱图. 与裸电极(黑线)相比,修饰g-C3N4 NS后电极的电荷转移电阻(Rct)有所增大(红线),这是因为g-C3N4 NS的半导体性质导致电子传递速率降低. 引入Au NPs后,Au-g-C3N4 NS/GCE的Rct明显降低(蓝线),这是因为Au NPs良好的导电性能,提高了电子迁移速率. 当MIP膜引入后,Rct明显增大(橙线),因为非导电性的MIP膜阻碍了电极表面的电子传导,这一结果表明:MIP膜成功修饰到了电极表面. 当FA被洗掉后,MIP膜出现了许多与FA互补的空腔,所以电子传递速率加快,Rct降低(粉线). 再次吸附FA后,空腔又被阻塞,影响了电子传递速率,Rct变大(绿线).
同样,在5 mmol·L-1 [Fe(CN)6]3-/4-(含0.1 mol·L-1 KCl)溶液中,研究了不同修饰电极的CV行为,如图4(b),其信号变化与EIS变化趋势吻合.
图4(c)是不同修饰电极在0.1 mol·L-1的PBS(pH=7.5,含0.1 mol·L-1 K2S2O8)溶液中的ECL信号. 与裸GCE相比,g-C3N4 NS/GCE具有较强的ECL信号,说明g-C3N4 NS是一种优异的ECL材料. 当在电极上引入Au-g-C3N4 NS后,ECL信号进一步增强,说明掺杂Au NPs会提高g-C3N4 NS ECL的发光强度. 然而,在Au-g-C3N4 NS/GCE上引入MIP膜后,ECL強度显著降低,这是由两个原因引起的:一是FA自身可淬灭Au-g-C3N4 NS的ECL信号;二是由于MIP膜的物理阻碍效应. 当模板分子被洗脱后,ECL强度再次增加. 同样,吸附FA后的ECL值会减小.
2.4 实验条件的优化
为获得最佳的实验结果,对检测底液的pH值、模板分子与功能单体比例、FA的洗脱和孵育时间进行了优化,如图5所示.

图5 不同检测条件对MIP-ECL传感器的影响. (a) 检测底液的pH值; (b) 模板分子FA与功能单体AAM的物质的量之比;
(c) FA的洗脱时间;(d)FA的孵育时间
图5(a)为检测底液的pH值对传感器ECL信号的影响. 当pH值从6.5增加到7.5时,ECL信号逐渐增大;pH=7.5时,ECL信号达到最大;继续增加pH值,ECL信号又减小. 因此,选择检测底液的pH值为7.5.
图5(b)为目标分子FA与功能单体AAM的比例对ΔECL信号(ΔECL为模板分子洗脱后的ECL信号与洗脱前的ECL信号的差值)的影响. 固定FA的量为0.3 mmol,改变AAM的量,可以看出FA与AAM的物质的量之比为1∶3时,洗脱前后ECL信号变化最大. 这是因为,AAM过少会导致聚合物膜的不均匀、不稳定,形成信号的特异性识别位点较少;相反,AAM的量过多则会导致聚合物膜太厚,影响电子传递. 所以选择FA与AAM的物质的量之比为1∶3.
图5(c)为不同洗脱时间下的ECL信号. 将含有模板分子的MIP/Au-g-C3N4 NS/GCE电极插入乙醇和NaOH(2.0 mol·L-1)的混合溶液中(体积比为7∶3),测量不同洗脱时间对应的ECL信号. 可以看出,随着洗脱时间延长,ECL信号逐渐增大,当洗脱时间达到20 min后,ECL信号达到最大,继续延长洗脱时间,信号基本保持不变,表明膜内的FA分子被洗脱完全,因此选择洗脱时间为20 min.
图5(d)为FA孵育时间的优化. 将去除模板分子FA的电极重新插入1.0×10-5 mol·L-1的FA溶液中孵育,记录不同孵育时间下的ECL信号. 孵育时间从5~15 min,ECL信号一直降低,15 min后ECL信号基本保持不变. 故选择孵育时间为15 min.
2.5 传感器对FA的ECL响应
将MIP-ECL传感器插入不同浓度的FA溶液中,孵育15 min后取出,用蒸馏水冲洗干净,再转入含0.1 mol·L-1 K2S2O8的PBS溶液(0.1 mol·L-1,pH=7.5)中,测试ECL信号. 如图6所示,随FA浓度增加,ECL信号不断降低. ECL信号的降低值与FA浓度对数在1.0×10-10~1.0×10-3 mol·L-1范围内呈良好线性关系. 线性回归方程为I0-I=1 567.8 lg C–1 616.5(相关系数为0.993 9),其中I0是空白溶液(不含FA)的ECL强度,I是物质的量浓度为C(mol·L-1)的FA对应的ECL强度. LOD为0.07 nmol·L-1(信噪比S/N=3). 表1是本方法与其他方法检测FA的比较,本方法具有较低的LOD和较宽的线性范围.

图6 (a) 不同物质的量浓度FA的ECL信号和(b) FA物质的量浓度的对数值与ECL信号变化值之间的线性关系
2.6 ECL机理探究
为了探究FA对Au-g-C3N4 NS/K2S2O8体系的ECL抑制机制,从两方面考虑:一是化学反应导致的信号猝灭;二是光学作用引起的猝灭[26-27]. 如果体系中发生化学反应导致信号猝灭,有两种途径:(1) FA消耗共反应剂K2S2O8引起ECL降低;(2) FA与发光物质Au-g-C3N4 NS反应,引起信号降低. 分别测试了FA,K2S2O8及两者混合后的UV-vis谱图,如图7(a)所示,FA在240 nm和360 nm处有2个吸收峰,K2S2O8在250 nm后无吸收,两者混合后没有产生新的吸收峰,FA吸收光谱也没有改变,说明两者没有发生化学反应. 同样,分析了FA,Au-g-C3N4 NS及两者混合后的UV-vis光谱,如图7(b)所示,可以看出两者的混合物保留了原来FA和Au-g-C3N4 NS各自的特征吸收峰,没有新的吸收峰出现,说明FA与Au-g-C3N4 NS之间也没有发生化学反应. 所以可以排除 FA与共反应剂或发光物质发生反应导致ECL信号猝灭的可能.

图7 FA对体系ECL抑制机理探究. (a) FA,K2S2O8及它们混合溶液, (b) FA,Au-g-C3N4 NS及它们混合溶液的UV-vis光谱图; (c) FA加入前后Au-g-C3N4 NS的荧光光谱; (d) FA的UV-vis光谱与Au-g-C3N4 NS的ECL光谱
为了进一步探究抑制机理,测试了FA对Au-g-C3N4 NS荧光信号影响,如图7(c)所示,FA对Au-g-C3N4 NS荧光信号有淬灭作用,由此推测FA对Au-g-C3N4 NS的ECL的猝灭可能是由于光学作用引起的. 图7(d)是FA的UV-vis光谱与Au-g-C3N4 NS的ECL光谱,两者几乎没有重叠,因此排除了能量转移的可能性. 比较图7(b)中FA与Au-g-C3N4 NS的UV-vis光谱,发现两者在200~400 nm范围内有较大重叠. 根据文献[28],当两种物质的吸收峰有重叠时,两者之间会发生电子转移. 因此,推测FA对Au-g-C3N4 NS猝灭很可能是由于兩者之间的电子转移效应引起的. 当FA存在时,激发态的Au-g-C3N4 NS*将导带电子转移到FA的π*轨道上,导致Au-g-C3N4 NS*数量减少,所以ECL信号降低,抑制机理如图8所示.

图8 FA对Au-g-C3N4 NS/K2S2O8体系的抑制机理
2.7 传感器的选择性、稳定性、重现性
选择性测试:选择几种常见的与FA共存的生物物质,包括Glu,Tyr,UA,AA和DA进行选择性测试. 先测试传感器对这几种物质各自的响应,再将100倍浓度的这些物质分别加入到1.0×10-5 mol·L-1的FA溶液中,测试传感器对混合液的响应. 如图9(a)所示,可以看出,传感器只对FA产生响应,而对其他几种物质几乎没有响应. 当它们与FA共存时,也不会影响FA的信号,说明它们的存在不会干扰FA的测定,证明传感器对FA有很好的选择性. 这主要是因为该传感器引入了对FA具有特异性识别的MIP膜,该膜可选择性吸附FA,而排除其他物质的干扰.

图9 传感器的性能测试. (a) MIP-ECL传感器对FA的选择性(空白,FA,Glu,Tyr,UA,AA和DA); (b) 连续扫描10圈的稳定性; (c) 传感器储存5周的稳定性; (d) 6根不同电极的重现性(扫描电位从0~1.5 V,扫速为100 mV·s-1)
稳定性测试:采用连续扫描的方法测试了传感器的稳定性,如图9(b)所示. 在0~1.5 V的范圍内连续扫描10圈,ECL信号无明显改变,相对标准偏差(RSD)为2.1 %. 把制备好的传感器置于4 ℃环境中,每隔1周测试ECL信号,如图9(c)所示,5周内ECL信号基本保持稳定.
重现性测试:取6个不同的电极,按照相同的方法制备传感器,测试其ECL信号,如图9(d)所示,6个传感器的RSD为2.3 %. 证明本方法制备的传感器具有良好的重现性.
2.8 实际样品的分析
为了验证MIP-ECL传感器的可靠性和实用性,对正常人血清样本(来自上海师范大学校医院)中的FA进行了测定. 先将样品用0.45 μm滤膜过滤,并以10 000 r·mins-1离心10 min去除沉淀物,得到的上清液用0.1 mol·L-1的PBS(pH=7.5)稀释5倍,采用标准加入法进行分析,结果如表2所示,方法的回收率为96.0%~101.0%,RSD为2.4%~3.1%. 结果表明:所构建的MIP-ECL传感器可应用于实际样品中FA的检测.
3 结 论
本工作采用原位生长法在发光物质g-C3N4 NS的表面引入Au NPs,改善了g-C3N4 NS在高电位下发光信号不稳定的问题. 然后,以其为ECL物质,结合MIP技术,构建了一种对FA具有特异性响应的MIP-ECL传感器,将该传感器应用于实际样品人血清中FA的检测,获得满意结果. 同时,传感器表现出良好的稳定性和重现性. 与其他检测FA的方法相比较,本文所提出的方法简单、使用方便、成本低.
参考文献:
[1] LYON P, STRIPPOLI V, FANG B, et al. B vitamins and one-carbon metabolism: implications in human health and disease [J]. Nutrients, 2020,12(9):2867.
[2] HWANG S Y, SUNG B, KIM N D. Roles of folate in skeletal muscle cell development and functions [J]. Archives of Pharmacal Research, 2019,42(4):319-325.
[3] LI C, YANG Q, WANG X, et al. Facile approach to the synthesis of molecularly imprinted ratiometric fluorescence nanosensor for the visual detection of folic acid [J]. Food Chemistry, 2020,319:126575.
[4] GARBIS S D, MELSE-BOONSTRA A, WEST C E, et al. Determination of folates in human plasma using hydrophilic interaction chromatography-tandem mass spectrometry [J]. Analytical Chemistry, 2001,73(22):5358-5364.
[5] WANG H, DE S H, CHEN G, et al. Effectiveness of folic acid fortified flour for prevention of neural tube defects in a high risk region [J]. Nutrients, 2016,8(3):152.
[6] LEBIEDZINSK A, DBROWSKA M, SZEFER P, et al. High-performance liquid chromatography method for the determination of folic acid in fortified food products [J]. Toxicology Mechanisms and Methods, 2008,18(6):463-467.
[7] GONG H, HUANG T, YANG Y, et al. Purity determination and uncertainty evaluation of folic acid by mass balance method [J]. Talanta, 2012,101:96-103.
[8] CHRISTIANE R, MICHAEL R. Origins of the difference between food folate analysis results obtained by LC-MS/MS and microbiological assays [J]. Analytical and Bioanalytical Chemistry, 2017,409:1815-1825.
[9] PENG Y, DONG W, WAN L, et al. Determination of folic acid via its quenching effect on the fluorescence of MoS2 quantum dots [J]. Microchimica Acta, 2019,186:605.
[10] AKBARS, ANWAR A, KANWAL Q. Electrochemical determination of folic acid: a short review [J]. Analytical Biochemistry, 2016,510:98-105.
[11] ZHOU X M, ZHANG W, WANG Z, et al. Ultrasensitive aptasensing of insulin based on hollow porous C3N4/S2O82-/AuPtAg ECL ternary system and DNA walker amplification [J]. Biosensors and Bioelectronics, 2020,148:111795.
[12] MOHADESEH S, BEITOLLAHI H,SHISHEHBORE M R. Amplified electrochemical sensor employing Fe3O4@SiO2/graphene nanocomposite for selective determination of folic acid [J]. Journal of Analytical Chemistry, 2020,75:95-100.
[13] QI J L, ZHANG X L, ZHANG Q Y, et al. Ultrasensitive “signal-on” sandwich electrochemiluminescence immunosensor based on Pd@Au-L-cysteine enabled multiple-amplification strategy for Apolipoprotein-A1 detection [J]. Microchemical Journal, 2022,178:107409.
[14] PENG H P, HUANG Z N, WU W H, et al. Versatile high-performance electrochemiluminescence ELISA platform based on a gold nanocluster probe [J]. ACS Applied Materials & Interfaces, 2019,11(27):24812-24819.
[15] JIA M F, ZHANG Z, LI J H, et al. Molecular imprinting technology for microorganism analysis [J]. Trends in Analytical Chemistry, 2018,106:190-201.
[16] ZHANG T X, LONG D, GU X W, et al. A dual-recognition MIP-ECL sensor based on boric acid functional carbon dots for detection of dopamine [J]. Microchimica Acta, 2022,189:389.
[17] 張田欣, 刘意明, 杨敏丽. 分子印迹电化学发光传感器检测毒死蜱 [J]. 上海师范大学学报(自然科学版), 2021,50(6):697?705.
ZHANG T X, LIU Y M, YANG M L. Molecularly imprinted polymer electrochemiluminescence sensor for sensitive and selective detection of chlorpyrifos [J]. Journal of Shanghai Normal University(Natural Sciences), 2021,50(6):697?705.
[18] CHEN L C, ZENG X T, SI P, et al. Gold nanoparticle-graphite-like C3N4 nanosheet nanohybrids used for electrochemiluminescent immunosensor [J].Analytical Chemistry, 2014,86(9):4188-4195.
[19] GAO X, YUE H, HUANG S, et al. Synthesis of graphene/ZnO nanowire arrays/graphene foam and its application for determination of folic acid [J]. Journal of Electroanalytical Chemistry, 2018,808:189-194.
[20] LIANG R P, YU L D, TONG Y J, et al. An ultratrace assay of arsenite based on the synergistic quenching effect of Ru(bpy)32+ and arsenite on the electrochemiluminescence of Au-g-C3N4 nanosheets [J]. Chemical Communications, 2018, 54(99):14001-4004.
[21] LI W, ZHANG X Y, MIAO C Y, et al. Fluorescent paper-based sensor based on carbon dots for detection of folic acid [J]. Analytical and Bioanalytical Chemistry, 2020,412(3):1-9.
[22] GAO X, YUE H Y, HUANG S, et al. Synthesis of graphene/ZnO nanowire arrays/graphene foam and its application for determination of folic acid [J]. Journal of Electroanalytical Chemistry, 2018,808:189-194.
[23] ANANTHI A, KUMAR S S, PHANI K L. Facile one-step direct electrodeposition of bismuth nanowires on glassy carbon electrode for selective determination of folic acid [J]. Electrochimica Acta, 2015,151:584-590.
[24] ZHU R F, ZHANG Y H, WANG J, et al. A novel anodic electrochemiluminescence behavior of sulfur-doped carbon nitride nanosheets in the presence of nitrogen-doped carbon dots and its application for detecting folic acid [J]. Analytical and Bioanalytical Chemistry, 2019,411(27):7137-7146.
[25] ZHU R, ZHANG Y, WANG J, et al. A novel anodic electrochemiluminescence behavior of sulfur-doped carbon nitride nanosheets in the presence of nitrogen-doped carbon dots and its application for detecting folic acid [J]. Analytical and Bioanalytical Chemistry, 2019,411(27):7137-7146.
[26] FU X M, GU Z C, LU Q Y, et al. A solid-state electrochemiluminescent sensor based on C 60/graphite-like carbon nitride nanosheet hybrids for detecting melamine [J]. RSC Advances, 2016,6(16):13217-13223.
[27] ZHOU C, CHEN Y M, SHANG P X, et al. Strong electrochemiluminescent interactions between carbon nitride nanosheet-reduced graphene oxide nanohybrids and folic acid, and ultrasensitive sensing for folic acid [J]. Analyst, 2016,141(11): 3379-3388.
[28] BABAMIRI B, SALIMI A, HALLAJ R, et al. Nickel nanoclusters as a novel emitter for molecularly imprinted electrochemiluminescence based sensor toward nanomolar detection of creatinine [J]. Biosensors and Bioelectronics, 2018, 107:272-279.
(責任编辑:郁慧,顾浩然)

