溃结康调控PERK-elF2α-ATF4-CHOP信号通路干预内质网应激治疗溃疡性结肠炎的机制研究
李小丝 马建国 徐荣漪 祁燕
【摘 要】 目的:探討溃结康(KJK)调控PERK-elF2α-ATF4-CHOP通路改善溃疡性结肠炎(UC)的作用机制。方法:C57BL/6小鼠分为空白组、模型组、阳性对照组、KJK(6.4 g/kg、12.8 g/kg)组,制备DSS诱导的UC小鼠模型,造模同时给予对应药物治疗7 d后处死小鼠,测量结肠长度;HE染色观察结肠病理损伤;western blot法检测PERK-elF2α-ATF4-CHOP信号通路蛋白表达。结果:与空白组比较,模型组小鼠DAI评分、Geboes评分明显升高(P<0.001);结肠长度明显缩短(P<0.01);结肠组织中GRP78、CHOP、ATF4、p-PERK、p-elF2α蛋白表达明显升高(P<0.01);与模型组比较,KJK 6.4 g /kg及12.8 g/kg组小鼠DAI评分及Geboes评分明显降低,结肠长度明显缩短(P<0.05,P<0.01);结肠组织中GRP78、CHOP、ATF4、p-PERK蛋白表达明显降低(P<0.05,P<0.01)。结论:KJK可抑制PERK-elF2α-ATF4-CHOP通路信号转导,改善UC小鼠症状。
【关键词】 溃疡性结肠炎;内质网应激;溃结康;PERK-elF2α-ATF4-CHOP信号通路
【中图分类号】R285.5 【文献标志码】 A 【文章编号】1007-8517(2024)02-0008-06
DOI:10.3969/j.issn.1007-8517.2024.02.zgmzmjyyzz202402003
Mechanisms of Kuijie Kang Decoction Regulating PERK-elF2α-ATF4-CHOP Signaling
Pathway of Endoplasmic Reticulum Stress to Treat Ulcerative Colitis
LI Xiaosi1 MA Jianguo2 XU Rongyi1 Qi Yan1*
1.Central Laboratory of the First Affiliated Hospital of Yunnan University of Traditional Chinese Medicine,Kunming 650000,China;
2.Anorectal Branch,the First Affiliated Hospital of Yunnan University of Traditional Chinese Medicine,Kunming 650021,China
Abstract:
Objective To investigate the mechanism by which Kuijie Kang (KJK) regulates the PERK-elF2α-ATF4-CHOP pathway to improve ulcerative colitis (UC).Method C57BL/6 mice were divided into normal,model,positive control,and KJK (6.4 g/kg,12.8 g/kg) groups. A DSS-induced UC mouse model was established,and corresponding drugs were administered for 7 days before sacrificing the mice. Colon length was measured and HE staining was performed to observe colon pathological changes. Western blotting was used to detect the expression of proteins in the PERK-elF2α-ATF4-CHOP signaling pathway. Results Compared with the normal group,the DAI score and Geboes score of the model group mice were significantly increased (P<0.001);colon length was significantly shortened (P<0.01);the expression of GRP78,CHOP,ATF4,p-PERK,and p-elF2α proteins in colon tissue was significantly elevated (P<0.01). Compared with the model group,the DAI score,Geboes score,and colon length of the KJK 6.4 g/kg and 12.8 g/kg groups were significantly reduced (P<0.05,P<0.01);the expression of GRP78,CHOP,ATF4,and p-PERK proteins in colon tissue was significantly decreased (P<0.05,P<0.01).Conclusion KJK can inhibit the PERK-elF2α-ATF4-CHOP pathway and improve symptoms of UC in mice.
Keywords:Ulcerative Colitis;Endoplasmic Reticulum Stress;Kuijie Kang;PERK-elF2α-ATF4-CHOP Signaling Pathway
溃疡性结肠炎(ulcerative colitis,UC)是临床中常见的非特异性肠道炎症性疾病,极易复发及癌变。近年来,UC 的发病率逐年増高[1]。研究[2]发现,结肠炎患者具有更高的结直肠癌(colorectal cancer,CRC)发生率,且风险随年龄的增长而增加。UC发病率的逐年上升和治疗溃疡性结肠炎的诸多问题使得加强其病因和发病机理的研究,寻求切实有效、副作用小的治疗手段成为世界性的难题。内质网应激(endoplasmic reticulum stress,ERS)是各种原因引起的错误折叠或未折叠蛋白质在内质网腔中聚集导致的稳态失衡。在真核细胞中,ERS可通过未折叠蛋白反应(unfolded protein response,UPR),促进错误折叠或未折叠的蛋白质正确折叠及分泌,暂停早期蛋白质的翻译合成,以利于细胞生理功能的恢复[3]。过度和延长的ERS反应会通过涉及依赖或不依赖线粒体的凋亡通路最终导致细胞死亡[4]。肠道黏膜上皮细胞(intestinal epithelial cells,IECs)具有发达的内质网结构,当肠黏膜上皮细胞内质网稳态受到体内、外因素破坏时,内质网功能受到影响,即可触发ERS、UPR及其介导的信号通路,进而激发促炎因子级联释放、细胞凋亡途径及肠黏膜屏障障碍等病理变化,使肠黏膜受损,最终导致UC的发生发展。
溃结康为云南省中医医院王华宁主任医师临床治疗溃疡性结肠炎经验方,全方由痛泻要方化裁而来,具有疏肝健脾、清热凉血止血之功。目前,课题组已明确其物质基础,并从调控NLRP3炎性体、氧化应激、自噬、肠道菌群等不同环节对该方的作用机制进行了探讨[5-8]。
鉴于内质网应激诱导上皮细胞凋亡进而破坏肠道上皮屏障功能,溃结康对UC病变时肠黏膜损伤具有明显促进作用,本研究从调控内质网应激角度探讨该方作用机制,以进一步丰富疏肝健脾方治疗UC的科学内涵。
1 材料和方法
1.1 动物 C57BL/6雌性小鼠50只,体重18~22 g,购自斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2019-0010,质量检测单位:苏州西山生物技术有限公司,小鼠饲养于云南中医药大学第一附属医院中心实验室SPF级动物实验室,温度(22±1)℃,湿度(55±5)%,12 h明暗交替,自由摄取灭菌饲料和饮用水,适应性饲养1周开始实验。
1.2 试剂和药物 溃结康处方药材饮片白术、云茯苓、白芍、陈皮、防风等,购自云南省中医医院中药房,药材加入10 倍体积水,煎煮3次后,合并水煎液,过滤,于旋转蒸发仪浓缩制备流浸膏冻存于-20 ℃冰箱备用。柳氮磺胺吡啶肠溶片,国药准字 H31020557,上海新信谊天平药业有限公司。葡聚糖硫酸钠(DSS),购自MP公司,货号:M8667;elF2 alpha( 货号:AF6087)、Phospho-elF2 apha( 货号:AF3087)、Phospho-PERK(货号:AF4499)、PERK Antibody( 货号:AF4799) ,以上抗体均购自Affinity;ATF4 Polyclonal antibody(货号:28657-AP)、CHOP GADD153 Polyclonal antibody(货号:15204-AP) ,GRP78/BIP Polyclonal antibody(货号:11587-AP),以上抗体均购自proteintech。
1.3 仪器 RM2235切片机、ASP300S脱水机、DM2500正置显微镜+图文系统(德国 Leica),BIORAD电泳仪、电泳槽,Odyssey CLX红外荧光扫描成像系统。
1.4 分组、造模及给药 50只C57BL/6雌性小鼠适应性饲养一周后随机分为:空白组、模型组,KJK 12.8 g/kg组、KJK 6.4 g/kg组、柳氮磺胺吡啶组(0.45g/kg),每组10只。除空白组外,其余4组参考 Wirtz等[9] 的方法建立急性UC小鼠模型,造模同时给予蒸馏水或对应药物灌胃治疗,连续7d后脱颈椎处死,分离结肠,测定结肠长度后,选取1 cm中段结肠组织以磷酸盐缓冲液冲洗,置于4%多聚甲醛中固定,剩余组织置于-80 ℃保存备用。
1.5 指标检测
1.5.1 疾病活动指数(DAI)评分 每天观察动物体质量、大便性狀和隐血情况,按照表1进行评分,将各项评分相加,得出每只动物的DAI,以评估疾病活动情况。DAI评分=(体质量下降评分+大便性状评分+大便隐血情况评分) /3。见表1。
1.5.2 结肠组织病理形态学观察 取置于4%多聚甲醛中固定的结肠组织经脱水、包埋、切片染色后显微镜下观察结肠病理变化,对各组小鼠进行Geboes评分[10],评分标准如下:组织发生结构改变计0分,发生慢性炎症计1分,固有层可见中性粒细胞计2分,上皮层可见中性粒细胞计3分,隐窝结构破坏计4分,发生糜烂或溃疡计5分。
1.5.3 Western blot方法检测 UC小鼠结肠组织中GRP78、CHOP、ATF4、p-PERK、p-elF2α蛋白表达 结肠组织加入蛋白裂解液及蛋白酶、磷酸酶抑制剂,匀浆完成离心收集上清液,BCA法测定蛋白浓度,经变性后上样并电泳、湿转至PVDF膜,5%脱脂奶粉封闭1 h,洗膜两次后孵育一抗并4 ℃过夜,次日,TBST洗膜后,转移到含有二抗(稀释比例为1∶5000)的孵育盒中1 h,孵育完成后,TBST洗膜四次,红外荧光成像扫描系统检测荧光强度,用Image J软件对每条条带进行读取分析,以目的蛋白与β-actin的密度比值作为目的蛋白的相对含量。
1.5.4 统计学方法 数据采用统计软件SPSS 26.0行统计结果分析,以(x±s)表示。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,以P< 0.05,P<0.01表示两组差异有统计学意义。
2 结果
2.1 溃结康对UC模型小鼠体重、疾病活动指数评分和结肠长度的影响 与空白组比较,模型组小鼠体重第3天开始下降(P<0.01));第5天、第7天显著下降(P<0.001),DAI评分明显升高(P<0.001),结肠长度明显缩短(P<0.01);与模型组比较,KJK 12.8 g/kg、6.4 g/kg组小鼠体重第5天、第7天结肠长度明显增加(P<0.05)、DAI评分明显降低(P<0.05);柳氮磺胺吡啶组小鼠体重第3天、第5天、第7天明显增加(P<0.01、P<0.05),DAI评分显著降低(P<0.05),结肠长度明显增加(P<0.01)。见表2。
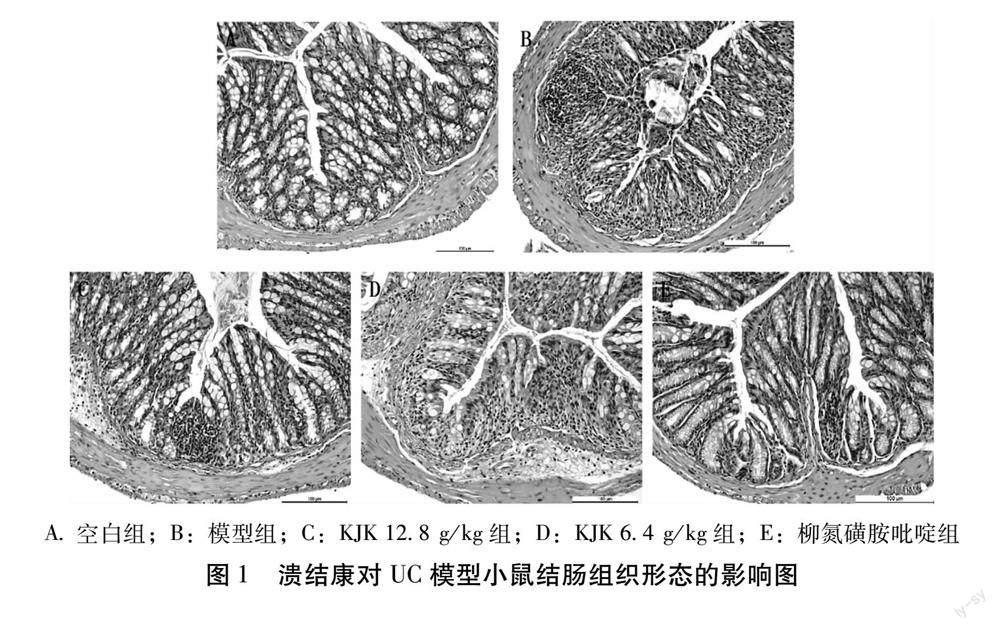
2.2 溃结康对UC模型小鼠结肠组织形态及Geboes评分的影响 HE染色结果表明,空白组小鼠结肠组织结构完整,细胞排列整齐,无明显炎性细胞浸润。模型组小鼠结肠组织炎细胞浸润,上皮细胞破坏,黏膜下层充血水肿。KJK组小鼠腺体结构完整度好转,炎性细胞浸润程度及结肠黏膜破坏减轻。如图1所示。Geboes评分结果表明,与空白组比较,模型组Geboes评分显著升高(P<0.001);KJK 12.8 g/kg、6.4 g/kg组和柳氮磺胺吡啶组Geboes评分显著降低(P<0.01) 。见表3。
A.空白组;B:模型组;C:KJK 12.8 g/kg组;D:KJK 6.4 g/kg组;E:柳氮磺胺吡啶组
图1 溃结康对UC模型小鼠结肠组织形态的影响图
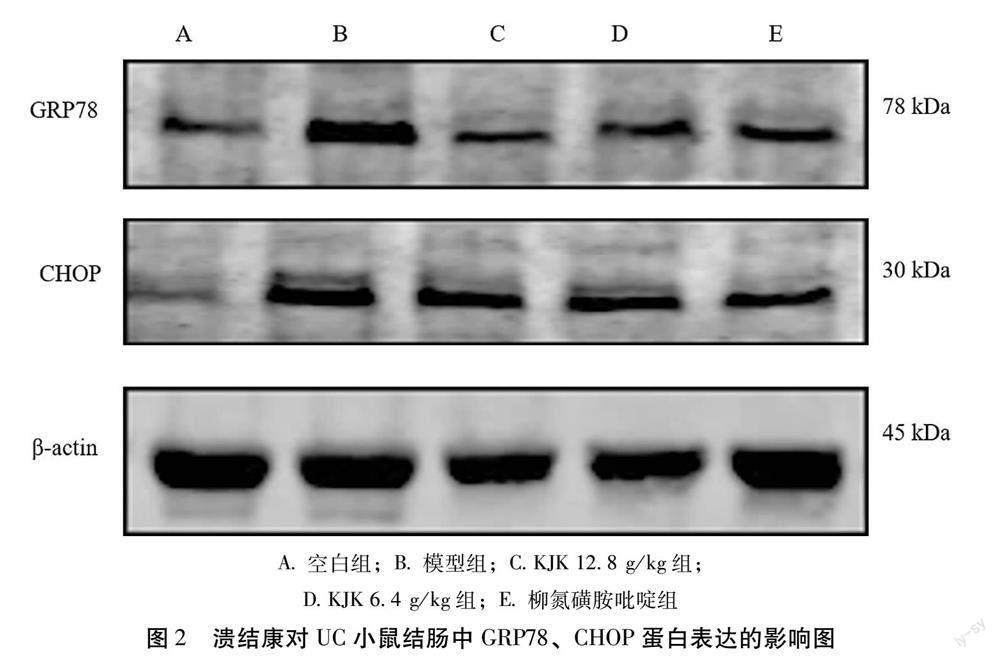
2.3 溃结康对UC模型小鼠结肠组织中GRP78、CHOP、ATF4、p-PERK/PERK、p-elF2α /elF2α蛋白的影响
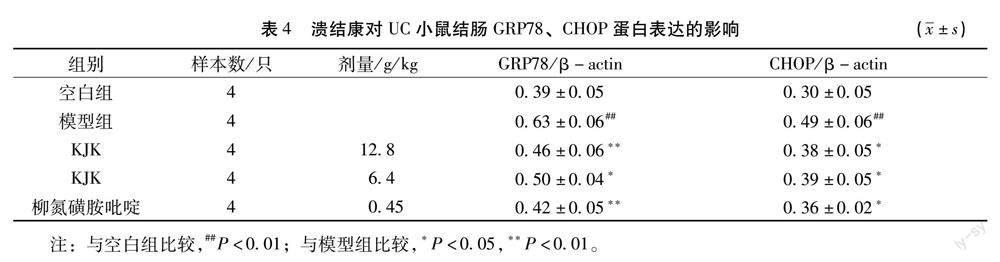
2.3.1 对内质网应激标记蛋白GRP78、CHOP的影响 与空白组比较,模型组小鼠结肠组织GRP78和CHOP蛋白表达明显升高(P<0.01);与模型组比较,KJK 12.8 g/kg组可显著下调GRP78和CHOP蛋白表达(P<0.01、P<0.05);KJK 6.4 g/kg组GRP78和CHOP蛋白表达均降低(P<0.05);柳氮磺胺吡啶组GRP78和CHOP蛋白表达均下调(P<0.01、P<0.05)。见表4,如图2所示。
2.3.2 对内质网应激调控蛋白ATF4、p-PERK、p-elF2α表达的影响 与空白组比较,模型组小鼠结肠组织中ATF4、p-PERK/PERK、p-elF2α/elF2α 蛋白表达明显升高(P<0.01);与模型组比较,KJK 12.8 g/kg组ATF4、p-PERK/PERK、p-elF2α/elF2α 蛋白表达显著降低(P<0.05);KJK 6.4 g/kg组ATF4、p-PERK/PERK蛋白表达均下降(P<0.05),p-elF2α/elF2α蛋白表达无明显变化;柳氮磺胺吡啶组ATF4、p-elF2α /elF2α蛋白表达显著降低(P<0.01),p-PERK/PERK蛋白表达降低(P<0.05)。见表5,如图3所示。
3 讨论
研究[11]表明,肠上皮细胞凋亡、肠黏膜损伤导致肠黏膜屏障稳态破坏是UC发病和复发的重要原因。目前,国际上已将“黏膜愈合”确定为UC的主要治疗目标和重要预后评估指标。促进肠上皮黏膜修复,维持肠屏障功能稳态已成为治疗UC药物研发的主要方向。
内质网为钙离子代谢、蛋白质发挥功能及脂质合成的主要场所。在病理条件下,细胞受到多种外源性应激源刺激,内质网腔内大量未折叠或以错误方式折叠的蛋白质积聚或腔内钙离子失衡诱导的细胞内稳态失衡过程[12]。正常状态下,ERS标志蛋白-葡萄糖调节蛋白78 (glucose regulated pro- tein78,GRP78) 與内质网膜上的跨膜蛋白PERK、活化转录因子 6(activating transcription factor 6,ATF6) 和肌醇酶 1(inositol requiring enzyme l,IREI)结合,疾病状态下,细胞应激反应发生,GRP78与以上三种结合蛋白解离,并促使结合蛋白活化,而启动保护性的未折叠蛋白反应[13]。适度的ERS,有助于改善蛋白质的合成和加工过程,从而避免细胞在应激状态下损伤死亡,但若应激反应过久或过强,未折叠蛋白反应不足以完全代偿缓解细胞损伤,活化的跨膜感受蛋白将进一步激活细胞凋亡程序,最终诱发应激细胞程序性死亡[14]。PERK-eIF2α-CHOP通路为与内质网应激相关的重要的凋亡信号转导途径。应激状态下,PERK与GRP78解离后通过同源二聚化而磷酸化激活自身,促使转录活化因子4(the activating transcrip- tion factor 4,ATF4)的翻译和表达,激活ERS特有的凋亡标志蛋白CHOP的基因转录。CHOP的表达可调节死亡受体途径和线粒体途径,最终激活凋亡效应子Caspase-3,导致细胞凋亡发生。肠上皮细胞内质网结构丰富、发达,且持续暴露并与肠腔内病原微生物接触,病变时,受炎性介质及缺血缺氧等刺激,内质网应激反应活跃。因此,调控肠上皮细胞ERS反应,进而抑制肠上皮细胞凋亡,保护肠黏膜,并促进其修复为改善UC的一重要途径。
溃结康组方为白术、云茯苓、白芍、陈皮、防风、桔梗、三七、槐花、地榆、甘草。全方具疏肝健脾,清热凉血止血之功。现代药理学研究[15-18]表明,方中多味药的药效成分均具有调控内质网应激作用。本研究结合前期研究基础及以上文献报道,以内质网应激为切入点,探讨溃结康调控PERK-elF2α-ATF4-CHOP信号通路促进UC小鼠肠黏膜修复的机制。结果显示,溃结康可逆转UC小鼠体重降低及结肠长度缩短,改善结肠病理损伤。进一步检测结肠组织中内质网应激相关蛋白表达,结果显示,溃结康可显著下调内质网应激标记蛋白及调控蛋白GRP78、CHOP、ATF4、p-PERK/PERK、p-elF2α/elF2α蛋白表达。表明溃结康对PERK-elF2α-ATF4-CHOP信号通路具有一定的调控作用,提示干预内质网应激相关通路,减轻肠上皮细胞损伤及黏膜屏障破坏为溃结康改善UC的重要机制之一。研究结果进一步丰富了疏肝健脾方治疗UC的疗效机制的认识。
参考文献
[1]
GBD 2017 Inflammatory Bowel Disease Collaborators.The global,regional,and national burden of inflammatory bowel disease in 195 countries and territories,1990-2017: a systematic analysis for the Global Burden of Disease Study 2017[J].Lancet Gastroenterol Hepatol,2020,5(1):17-30.
[2]TRIANTAFILLIDIS J K,NASIOULAS G,KOSMIDIS PA.Colorectal cancer and inflammatory bowel disease: epidemiology,risk factors,mechanisms of carcinogenesis and prevention strategies[J].Anticancer Res,2009,29(7):2727-37.
[3]KASER A,LEE A H,FRANKE A,et al.XBP1 links ER stress to intestinal inflammation and confers genetic risk for human inflammatory bowel disease[J].Cell.2008,134(5):743-56.
[4]WERNER T,HALLER D.Intestinal epithelial cell signalling and chronic inflammation: From the proteome to specific molecular mechanisms[J].Mutat Res,2007,622(1-2):42-57.
[5]祁燕,万春平,李小丝,等.溃结康对溃疡性结肠炎小鼠肠粘膜炎症因子及肠屏障功能相关蛋白的影响[J].中药药理与临床,2017,33(6):120-124.
[6]祁燕,袁志伟,万春平,等.溃结康对溃疡性结肠炎小鼠结肠抗氧化作用及 Nrf2/ARE信号通路的影响[J].中药药理与临床,2019,35(2):115-119.
[7]祁燕,袁志伟,万春平,等.溃结康对溃疡性结肠炎小鼠NLRP3炎性体基因表达及下游炎性因子影响[J].中华中医药学刊,2020,38(3):229-233
[8]HE J B,WAN C P,LI X S,et al.Bioactive Components and Potential Mechanism Prediction of Kui Jie Kang against Ulcerative Colitis via Systematic Pharmacology and UPLC-QE-MS Analysis[J].Evid Based Complement Alternat Med,2022(21):9122315.
[9]WIRTZ S,POPP V,KINDERMANN M,et al.Chemically induced mouse models of acute and chronic intestinal inflammation[J].Nat Protoc,2017,12(7):1295-1309.
[10]DAI Y C,ZHENG L,ZHANG Y L,et al.Effects of Jianpi Qingchang decoction on the quality of life of patients with ulcerative colitis: A randomized controlled trial[J].Medicine (Baltimore),2017,96(16):e6651.
[11]LEE S H,KIM M J,CHANG K,et al.Fecal calprotectin predicts complete mucosal healing and better correlates with the ulcerative colitis endoscopic index of severity than with the Mayo endoscopic subscore in patients with ulcerative colitis[J].BMC Gastroenterol,2017,17(1):110.
[12]MRTON M,KURUCZ A,LIZK B,et al.A Systems Biological View of Life-and-Death Decision with Respect to Endoplasmic Reticulum Stress-The Role of PERK Pathway[J].Int J Mol Sci,2017,18(1):58.
[13]MA L,ZHANG X,ZHANG C,et al.Omentin-1 attenuates inflammation and barrier damage in DSS-induced ulcerative colitis in mice by inhibiting endoplasmic reticulum stress[J].Gen Physiol Biophys,2022,41(3):221-230.
[14]HIRAMATSU N,CHIANG W C,KURT T D,et al.Multiple Mechanisms of Unfolded Protein Response-Induced Cell Death[J].Am J Pathol,2015,185(7):1800-1808.
[15]WU C,HUANG H,CHOI H Y,et al.Anti-esophageal Cancer Effect of Corilagin Extracted from Phmllanthi Fructus via the Mitochondrial and Endoplasmic Reticulum Stress Pathways[J].J Ethnopharmacol,2021(269):113700.
[16]QIU C,ZHANG T,ZHANG W,et al.Licochalcone A Inhibits the Proliferation of Human Lung Cancer Cell Lines A549 and H460 by Inducing G2/M Cell Cycle Arrest and ER Stress[J].Int J Mol Sci,2017,18(8):1761.
[17]張登青,袁琴,袁成福,等.三七总皂苷对衰老大鼠肝脏内质网应激介导炎症反应的影响[J].中国实验方剂学杂志,2017,23(19):140-144.
[18]王雅男,李红杰,马艳霞,等.白芍总苷对心肌缺血再灌注大鼠内质网应激因子CHOP、GRP78、GRP94的表达及凋亡的影响[J].现代生物医学进展,2018,18(8):1469-1473.
(收稿日期:2023-05-05 编辑:刘斌)

