中药复方开心散调控慢性压力应激小鼠海马神经新生抗抑郁作用机制研究*
郑嘉妮,黄灵欣,陆韫青,李 璇,陈 杨,仝佳祥,朱梓强,段金廒,李乐军,朱 悦**
(1.南京中医药大学药学院,江苏省方剂研究重点实验室/江苏省方剂高技术研究重点实验室/中药资源产业化与方剂创新药物国家地方联合工程研究中心/江苏省中药资源产业化过程协同创新中心 南京 210023;2.南京中医药大学附属苏州市中医医院 苏州 215007)
抑郁症是以显著而持久的心境低落,同时伴有思维迟缓、认知功能和意志活动减退等主要临床特征的心境障碍疾病[1]。受COVID-19 影响,2020 年全球范围内重度抑郁症增加了28%[2],因此抑郁症已成为危害公众身心健康的重大疾病。目前临床常用的抗抑郁药物多为单胺类神经递质再摄取抑制剂,但有近40%患者对该类药物效用不明显[3]。此外,使用该类药物易出现恶心、便秘等胃肠道反应以及勃起功能障碍等不良反应,严重影响了患者服药依从性[4]。
研究发现,抑郁症病理机制极为复杂,涉及神经递质重摄取障碍、神经营养因子缺乏、压力应激下丘脑-垂体-肾上腺轴异常激活、神经炎症损伤等多重环节[5]。上述多重环节综合作用最终损害海马区神经元是抑郁症的重要病理环节。尤其值得重视的是,多种研究认为海马区齿状回区域神经元即使在成年后也可新生生长,突破了中枢神经难以新生的传统认识[6]。临床研究发现,严重抑郁症患者较正常人海马体积显著减少,并伴有显著的认知缺失[7]。动物实验表明,现有的单胺类神经递质再摄取抑制剂类抗抑郁药物、体育锻炼和电疗等均可通过促进神经干细胞增殖与海马神经元新生发挥抗抑郁作用,而其药效也能通过转基因或药物干扰阻断神经新生所拮抗[8]。因此,促进海马区神经新生成为抑郁症治疗策略与药物开发的研究热点之一。
开心散始载于唐代孙思邈《备急千金要方》[9],由人参、远志、石菖蒲、茯苓组成。主治心气不足证,症见神志不宁,健忘失眠,心悸怔忡等。功可益气养心、安神定志,是经临床证实的改善轻、中度抑郁症的有效方剂,并被纳入2018 年国家中医药管理局公布的首批古代经典名方目录。现代研究发现,该方可以通过促进神经递质与神经营养因子供给,抑制压力应激轴激活,减轻神经炎症等多环节、多靶点改善抑郁动物模型的抑郁样行为,但是关于其对海马区神经新生的影响未见报道[10]。因此,本研究拟基于慢性温和不可预知刺激小鼠抑郁模型[11]与小鼠原代神经干细胞培养体系,评价开心散对模型小鼠海马神经新生的影响并探索相关信号通路,为开心散临床应用提供参考。
1 材料
1.1 动物
ICR 小鼠,雄性,体质量22-25 g,购自江苏集萃药康生物科技有限公司,动物许可证号SCXK(苏)2018-0008。动物饲养于南京中医药大学实验动物中心SPF环境中,常规饲养,12 h 光照,温度22-25℃,湿度40%-70%。ICR 小鼠孕鼠(14 天),购自江苏集萃药康公司,许可证号:SCXK(苏)2018-0008。
1.2 试剂
氟西汀(F131623)购自阿拉丁试剂公司,5-溴脱氧尿嘧啶核苷(5-Bromodeoxyuridinc,BrdU,ST1056)、5-乙炔基-2’-脱氧尿苷(5-ethynyl-2’-deoxyuridine,EDU,C0071S)试剂盒购自碧云天生物科技有限公司。抗体β-catenin Rabbit mAb(8480S)、GSK-3b Rabbit mAb(9315S),Histone H3 Rabbit mAb(9715S)、NeuN Rabbit mAb(24307S)、Anti-rabbit IgG Fab2 Alexa Fluor(M)488(4408S)购自Cell Signaling Test 公司;Wnt3a Mouse antibody(sc-136163)、β-actin Mouse antibody(66009-1-lg)购自Proteintech 公司;Nestin Rabbit antibody(MAB353)购自Millipore 公司;HRP-Linked Anti-Mouse IgG(BA1050),HRP-Linked Anti-Rabbit IgG(BA1054 购自BOSTER 公司。小鼠促肾上腺皮质激素(AF2554-A)、促肾上腺皮质激素释放因子(AF30178-A)、皮质醇(AF2565-A)ELISA 试剂盒购自湖南艾方生物科技有限公司。小鼠神经生长因子(NGF,JEB-12458)、脑源性神经营养因子(BDNF,JEB-12339)ELISA 试剂盒购自南京金益柏生物科技有限公司。Neurobasal(21103-049)、B27(17504-044)、N2(17502001)培养基购自Gibco 公司;DMEM/F12培养基购自CORNING 公司;胎牛血清、青链霉素、Trypsin solution B (03-024-5B) 购 自 Biological Industries 公司;表皮生长因子(EGF)、碱性成纤维细胞生长因子(bFGF)购自Proteintech公司。
1.3 药材
人参(Panax ginsengC.A.Mey)、远志(Polygala tenuifoliaWilld)、石菖蒲(Acorus tatarinowiiSchott.)、茯苓(Poria cocos(Schw.)Wolf)药材饮片购自苏州天灵中药饮片公司,经南京中医药大学段金廒教授鉴定为合格药材。
1.4 仪器
凝胶成像系统(Bio-Rad);动物行为测试系统(上海吉量软件公司)。二氧化碳培养箱(Thermo 3100,美国Thermo 公司);倒置显微镜(TE-2000,Nicon 公司);恒温混均仪(TS100,杭州瑞诚仪器有限公司);超微量紫外/可见分光光度计(DENOVIX DS-11,美国);AXIO Vert.A1荧光倒置显微镜(Zeiss公司)。
2 方法
2.1 开心散提取物的制备
按照人参、远志、石菖蒲、茯苓(3∶2∶2∶3)的配伍比例,称取100 g 药材,采用8 倍量的溶剂回流提取2 次,每次2 h,过滤,合并2 次提取液,减压浓缩,合并2次滤液,减压浓缩至约1 mL药液中含有1 g生药的浸膏,冷冻干燥,得到开心散水提取物冻干粉。使用前,按需复溶。
2.2 慢性不可预知压力应激抑郁动物模型建立与行为学测试
取健康ICR 小鼠60 只,适应性饲养1 周后随机分为5 组,每组12 只。依据课题组前期已建立的慢性不可预知压力应激(Chronic unpredictable mild stress,CUMS)动物模型方法构建模型,实验流程见图1。刺激条件包括:①饲养笼倾斜45° 12 h;②禁食24 h;③禁水24 h;④足底电击3 次;⑤束缚2 h;⑥夹尾1 min;⑦强迫游泳10 min;⑧夜间照明12 h。随机选取8 种条件中的4 种对小鼠进行刺激,每天1 次,持续8 周,各组小鼠同一天内接受的刺激相同。以糖水偏好实验(Sucrose preference test,SPT)、悬尾实验(Tail suspension test,TST)与强迫游泳实验(Forced swimming test,FST)等行为学测试实验结果判断模型构建与给药效果(见表1)。受试动物首先进行SPT 测试;TST 测试于SPT 测试结束24 h 后进行;FST 测试于TST 测试结束24 h 后进行(见图1)。模型建立与行为学测试方法详参相关文献[12-13]。

图1 实验流程
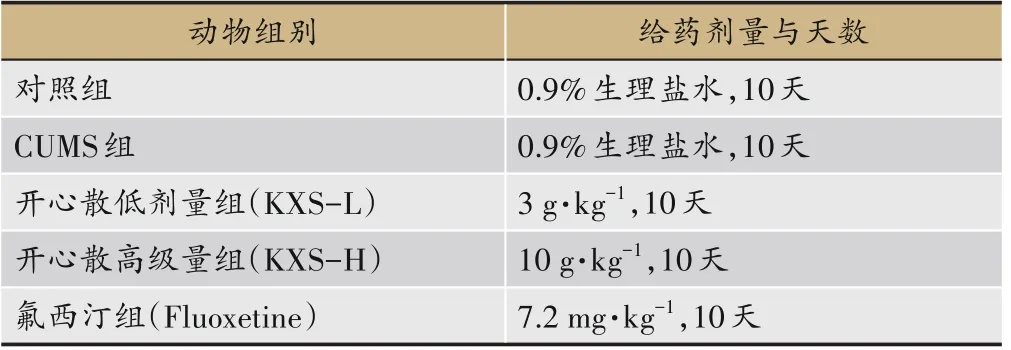
表1 实验动物给药剂量
2.3 动物分组给药与剂量
模型构建成功后,对照组与模型组小鼠按体质量每10 g 灌胃0.1 mL 生理盐水。其余各组小鼠灌胃相应药物,每日1 次,持续10 天给药,开心散提取物剂量按照提取物制备得率折算成生药量。灌胃第3天给需要灌注取材的小鼠腹腔注射BrdU(100 mg·kg-1·d-1),每天1 次,共7 次。给药期间,模型组与给药组动物维持压力应激造模。
2.4 小鼠压力应激因子与神经营养因子测定
行为学测试结束后,处死小鼠,分离得到小鼠海马、下丘脑、肾上腺等组织。液氮迅速冷冻,粉碎。称取相应重量组织,加入10 倍体积裂解液(10 mmol·L-1HEPES,pH=7.5,1 mol·L-1NaCl,1 mmol·L-1EDTA,1 mmol·L-1EGTA,0.5% Triton X-100,5 mmol·L-1benzamidine HCl,10 mmol·L-1aprotinin,10 mmol·L-1leupeptin),ELISA 法检测下丘脑中促肾上腺皮质激素释放因子(Corticotropin-releasing factor,CRF),肾上腺中促肾上腺皮质激素(Adrenocorticotropic hormone,ACTH),海马中皮质醇(Cortisol)、神经生长因子(Nerve growth factor,NGF)与脑源性神经营养因子(Brain derived nerve growth factor,BDNF)的含量,试剂盒检测范围为7.8-500.0 pg·mL-1。
2.5 免疫荧光法检测小鼠海马区细胞增殖情况
受试小鼠完成行为学测试后,处死小鼠解剖获得全脑,于4%多聚甲醛中固定24 h;分别于20%、25%、30%蔗糖溶液中浸泡梯度脱水。取脱水后脑组织,制备脑组织海马区石蜡包埋切片,切片常温保存。所得的脑组织石蜡切片脱蜡之后,浸于柠檬酸钠缓冲溶液中微波加热15 min。根据BrdU 试剂盒标准步骤,检测模型动物海马区神经新生水平。用光学显微镜400倍放大率观察海马组织病理变化。
2.6 免疫蛋白印迹法
每组称取海马组织,记录重量,加入10 倍量的RIPA裂解液与蛋白酶抑制剂(50∶1),研磨后置于冰上裂解30 min,离心10 min 取上清。按照BCA 试剂盒的操作步骤测定总蛋白含量,98℃加热15 min,使蛋白变性。配制10%和7.5%的蛋白凝胶,120 V 电泳,nestin转膜时间为4 h,Wnt3a、GSK-3β、β-Actin 检测转膜时间为1 h,β-catenin 检测转膜时间为2 h,5%脱脂牛奶封闭2 h。结束后加入一抗(β-catenin Rabbit mAb、GSK-3b Rabbit mAb、Wnt3a Mouse antibody、Nestin Rabbit antibody,抗体比例均为1:2000;β-Actin Mouse antibody,抗体比例为1:10000),4℃摇床过夜,二抗孵育(Anti-MouseIgG,Anti-RabbitIgG,HRP-linkedAntibody,抗体比例1∶10000),室温孵育1 h,洗膜后使用凝胶成像系统显色曝光。
2.7 小鼠原代神经干细胞体系建立与鉴定
异氟烷麻醉孕鼠解剖取出胎鼠并分离脑组织,于消化液(10% Trypsin solution B,90% DMEM/F12)中37℃消化15 min 后置于50 mL 离心管中,加入终止消化液(10% FBS,90% DMEM/F12)终止消化。轻柔解离组织制备细胞悬液,2184 r·min-1离心 5 min,加神经干细胞培养基(49% Neurobasal,49% DMEM/F12,0.5% N2,1% B27,0.02% bFGF,0.02% EGF,0.5% P/S)重悬细胞,以1.5×105-2.5×105个细胞·mL-1的密度接种于75 mL 培养瓶中,置37℃、5% CO2培养箱培养,每隔48 h半量换液,5-7天传代1次。以此构建小鼠原代神经干细胞(Neural stem cell,NSCs)培养体系。
取传代后的NSCs加入EdU(10 mol·L-1)培养48 h。接种于多聚赖氨酸预先赋予的细胞爬片。4%多聚甲醛常温固定30 min,PBS 洗3 次,每次5 min。TritonX-100(0.3%)孵育30 min,PBS洗3次,每次5 min;10%山羊血清孵育封闭1 h 后加入Nestin 单克隆抗体(1∶100),4℃孵育过夜24 h后进行EDU染色,含FITC标记的羊抗小鼠IgG抗体(1∶100)室温避光孵育1 h,PBS清洗3次后于荧光显微镜下观察并拍摄。
2.8 统计学分析
采用SPSS 19.0软件进行统计学分析,组内进行正态分布统计分析后,采用单因素方差分析法(One-way ANOVA)分析。组间比较采用T-test 分析,结果以均数±标准差(±s)表示,P<0.05 表示有显著差异,以P<0.01表示有极显著差异。
3 结果
3.1 开心散提取物抗抑郁效用评价
建立CUMS模型小鼠,造模成功后,给以开心散提取物与氟西汀10天后,进行行为学测试。与对照组相比,CUMS 模型组小鼠糖水偏嗜率(Sucrose preference test,SPT)显著降低(P<0.01),悬尾实验(Tail suspension test,TST)和强迫游泳(Forced swimming test,FST)不动时间显著增加(P<0.01)。与模型组相比,氟西汀给药组SPT 显著提升,TST 和FST 不动时间显著减少(P<0.01),提示模型构建成功。与模型组相比,开心散提取物的低、高剂量组均能提升模型小鼠的SPT,降低TST 和FST 测试不动时间(P<0.01),改善模型小鼠抑郁样行为,其中开心散高剂量组作用趋势更加明显(见图2)。

图2 开心散对抑郁模型小鼠行为学的影响(n=10)
3.2 开心散提取物对抑郁模型小鼠海马区细胞增殖的影响
通过BrdU法考察小鼠海马区细胞新生水平,结果如图3 所示。与对照组相比,模型组新生细胞数显著减少(P<0.01)。与模型组相比,开心散提取物给药后能够显著逆转模型小鼠海马新生细胞减少的趋势(P<0.01),提示开心散具有促进海马细胞新生的作用,以高剂量作用趋势更强。

图3 开心散对抑郁模型小鼠海马区神经细胞新生的影响(n=6)
3.3 开心散提取物对抑郁模型小鼠海马组织巢蛋白表达的影响
采用Western blot 法检测受试小鼠海马组织中神经干细胞标志物巢蛋白(nestin)的表达水平,结果如图4 所示,与对照组相比,模型组小鼠海马组织中nestin 含量显著下降(P<0.01),说明CUMS 模型小鼠海马区神经干细胞新生减少。与模型组相比,开心散低、高剂量组均可提高小鼠海马组织中nestin 蛋白表达(P<0.05),开心散高剂量效用趋势更强。

图4 开心散对抑郁模型小鼠海马区nestin蛋白表达的影响(n=8)
3.4 开心散提取物对抑郁模型小鼠压力因子表达的影响
解剖受试动物,分离得到小鼠海马、下丘脑、肾上腺等组织,ELISA 试剂盒检测海马Cortisol、下丘脑CRF、肾上腺ACTH 的含量,结果如图5 所示。与对照组相比,模型组小鼠Cortisol、CRF、ACTH 含量显著上升(P<0.01)。与模型组相比,开心散低、高剂量组均可降低小鼠Cortisol、CRF、ACTH 含量(P<0.05),以开心散高剂量效用趋势更强。
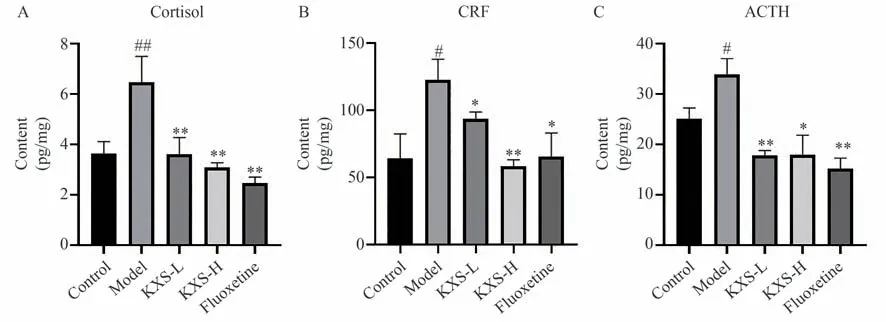
图5 开心散对抑郁模型小鼠压力因子表达的影响(n=8)
3.5 开心散提取物对抑郁模型小鼠海马组织营养因子表达的影响
解剖受试动物,分离得到小鼠海马组织,制备组织匀浆液。试剂盒检测小鼠海马组织BDNF、NGF 的含量,结果如图6 所示,与对照组相比,模型组小鼠BDNF、NGF 含量显著下降(P<0.01),与模型组相比,开心散低、高剂量组均可升高小鼠BDNF、NGF 含量(P<0.05),以开心散高剂量效用趋势更强。

图6 开心散对抑郁模型小鼠海马营养因子表达影响(n=8)
3.6 开心散提取物对抑郁模型小鼠海马组织Wnt、β-catenin、GSK-3β蛋白表达的影响
采用Western blot 法检测受试小鼠海马中Wnt、β-catenin、GSK-3β 的相对表达水平,结果见图7。与对照组相比,模型动物海马中Wnt、β-catenin 的表达水平较对照组显著下调(P<0.05)。与模型组相比,开心散提取物低、高剂量均可上调模型动物海马中Wnt、β-catenin 的表达水平(P<0.05);并且模型动物海马中GSK-3b 的表达水平较对照组显著上调(P<0.05)。与模型组相比,开心散提取物低、高剂量均可下调模型动物海马中GSK-3β 的表达水平(P<0.05),以开心散高剂量效用趋势更强。

图7 开心散提取物对抑郁模型小鼠海马组织中Wnt/β-catenin通路蛋白表达的影响(n=8)
3.7 小鼠神经干细胞的鉴定
小鼠NSCs细胞于显微镜明场(Bright field)观察时由多个神经球聚集形成细胞团,细胞团体积大小各不相同,周围有新增殖的体积相对较小的神经球,无明显的片状物,杂质细胞少(图8)。免疫荧光显示,NSCs呈nestin 染色阳性(图8)和EdU 染色阳性(图8),说明本实验方法培养出的细胞为NSCs且具有增殖能力。

图8 小鼠NSCs的鉴定(比例尺=50 μm,n=6)
3.8 开心散提取物对小鼠NSCs中细胞增殖的影响
为了考察开心散提取物对NSCs增殖的影响,将提取物冻干粉按照低、中、高3个浓度(1、3、10 µg·mL-1)加至NSCs 中作用24 h 后,固定细胞,以免疫荧光实验法检测EDU 表达。结果如图9 所示,与对照组相比,开心散提取物不同剂量均能够明显提高NSCs 中EDU 表达(P<0.01),提示开心散能够促进NSCs增殖。

图9 开心散对小鼠NSCs增殖水平的影响(n=6)
除免疫荧光法,通过Western blot 法检测NSCs 标志物nestin 表达以考察开心散提取物对NSCs 增殖的影响。结果如图10 所示,与对照组相比,给药开心散提取物不同剂量均能够明显提高nestin蛋白的表达(P<0.01),也间接佐证了开心散提取物促进NSCs增殖。

图10 开心散对小鼠NSCs中nestin蛋白表达的影响(n=6)
3.9 开心散提取物对小鼠NSCs 中Wnt/β-catenin 信号通路调控的影响
将NSCs 与开心散提取物共同作用24 h 后,通过Western blot 法检测Wnt、β-catenin、GSK-3β 的表达。结果如图11 所示,与对照组相比,开心散提取物不同剂量均能够明显提高Wnt、β-catenin 蛋白的表达(P<0.05)、降低GSK-3β 蛋白表达(P<0.05)。结果提示开心散提取物对Wnt/β-catenin信号通路具有调控作用。
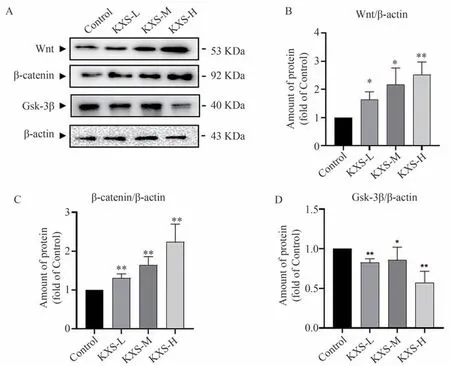
图11 开心散提取物对小鼠NSCs中Wnt/β-catenin通路蛋白表达的影响(n=6)
依据上述实验结果,进一步考察开心散提取物对小鼠NSCs中β-catenin入核情况的影响。结果如图12显示,与对照组相比,NSCs 加入不同剂量的开心散提取物后,胞浆内β-catenin 的表达水平降低,胞核内β-catenin 的表达水平提高(与对照组相比,P<0.05),提示开心散提取物可以促进β-catenin 入核,对Wnt/β-catenin通路具有调控作用。

图12 开心散提取物对小鼠NSCs中β-catenin蛋白入核表达的影响(n=6)
4 讨论
传统观点认为,成年哺乳动物脑内神经元不具备新生能力。自从Altman和Das采用BrdU 掺入法,发现了成年大鼠海马齿状回中存在神经干细胞并具有神经新生现象后,海马区神经新生成为神经科学关注的焦点[14-17]。抑郁症的发生也认为与海马神经新生密切相关[18-20],持续压力应激导致的皮质酮水平上升会导致CUMS 抑郁模型小鼠海马齿状回细胞增殖减少,海马神经新生减少,促进焦虑和抑郁的病程发展[21]。多种抑郁治疗手段能够促进神经新生并改善模型动物抑郁样行为[22]。因此,海马神经新生被视为抗抑郁药物的重要作用机制。本研究发现开心散水提物能够显著抑制持续压力应激导致的CUMS小鼠压力应激轴激活并降低海马区cortisol 表达,促进海马区NGF 与BDNF 表达,并显著促进海马区BrdU 和nestin 的表达,上调小鼠原代神经干细胞中EdU 和nestin 的表达,表明神经新生调控可能是开心散提取物抗抑郁作用的重要环节。
Wnt/β-catenin 信号通路是神经元新生与NSCs 增殖的经典通路[23]。Wnt 蛋白与细胞膜上的Frizzled 结合,抑制GSK-3β 活性,使其不能磷酸化β-catenin;并导致Axin 不稳定,APC、GSK-3β 和Axin 降解复合物无法形成,抑制β-catenin 磷酸化而使其在细胞质内聚集。β-catenin 聚集达到一定量时,可向细胞核内移位并与细胞核内TCF/LEF 转录复合物结合,作为转录激活因子可引起靶基因表达并促进NSCs 增殖[24]。本研究也发现,开心散能够促进β-catenin入核。亦有报道显示,开心散具有改善多种AD 模型小鼠的学习与记忆能力[25],Wnt/β-catenin 信号通路也是其促进海马区神经新生重要的调控通路[26]。因此,Wnt/β-catenin 信号通路是开心散调控海马神经新生的重要信号通路。
开心散是经临床证实的轻、中度抑郁症有效治疗方剂[27]。方中人参大补心气,鼓动气血上荣于脑,脑得阳气温煦与阴血滋养。远志开心气宁心安神,兼豁痰利窍以泄浊。石菖蒲开窍化湿,茯苓淡渗利水,使痰湿得化,不复上僭。四药同用,共奏补心安神,开心益智之功。同时根据辨证论治的需要,心气不足较重则重用人参与远志,痰湿阻窍较重则重用石菖蒲与茯苓,从而形成了不同配比的开心散类方。课题组基于抑郁症动物模型研究发现,开心散可通过增加单胺类神经递质供给[28-29]、抑制压力应激HPA 轴激活,调控“脑-肠”轴改善中枢神经炎症等多环节[30-31]、多靶点发挥抗抑郁效用。其中,神经营养因子调控是开心散发挥抗抑郁作用的重要作用环节。研究发现,开心散可促进神经营养因子NGF与BDNF合成并抑制降解从而提升抑郁模型动物海马中相关营养因子表达。开心散不同配伍比例中,以人参、远志、石菖蒲、茯苓药材配比为3∶2∶2∶3 比例的配伍组合促进NGF 与BDNF 表达效用最为显著。基于细胞模型,还发现开心散能够促进星形胶质细胞分泌神经营养因子[32],并协同低浓度NGF 促进大鼠肾上腺髓质嗜铬瘤PC12 细胞分化与神经丝纤维蛋白表达[12,33],其中人参皂苷可能为其主要功效成分[32]。这些研究结果均证实了神经营养因子调控是开心散抗抑郁的重要作用环节,也与其他相关研究报道一致[34]。
基于神经营养因子供给是开心散调控神经新生改善抑郁的重要环节,在本研究中以CUMS 抑郁模型小鼠为研究对象,并结合NSCs 模型,继续探究开心散是否能促进海马区神经新生与促进原代神经干细胞增殖。研究结果表明,开心散确实具有上述效用,同时也发现Wnt/β-catenin 信号通路是其调控的重要信号通路。已有研究表明,人参皂苷Rg1具有神经营养、促进神经新生的作用[35]。远志寡糖酯类化合物可以调节内分泌、细胞保护、增加神经营养因子BDNF 表达[36-37]。石菖蒲可通过提高海马区神经营养因子逆转抑郁行为[38],β-细辛醚也能够通过调控海马神经突触可塑性相关因子的表达,改善小鼠学习记忆能力障碍[39]。茯苓水提液对东莨菪碱、30%乙醇所致记忆再现障碍两种模型小鼠的学习记忆能力均有改善作用[40]。以上结果也提示,这些成分可能是开心散促进海马区神经新生抗抑郁的功效物质基础。
本研究基于小鼠CUMS 抑郁模型,发现了开心散具有抑制压力应激HPA 轴激活,增进神经营养因子供给,从而促进海马神经新生与增进神经干细胞增殖改善小鼠抑郁样行为的效用,同时发现Wnt/β-catenin 通路可能是其调控神经新生的重要调控通路。课题组将深入挖掘开心散调控神经新生抗抑郁的功效物质基础,助力于这一经典名方抗抑郁的临床应用与二次开发。

