萝卜硫素通过调节ALOX5/NF-κB信号通路调控巨噬细胞糖酵解抑制糖尿病肾病进展
乌日娜,丁海东,常 宏,孙娜娜,张 磊
糖尿病肾病(diabetic nephropathy,DN)是2型糖尿病最常见的微血管并发症[1]。有文献[2]报道,在DN中高糖能够促进巨噬细胞糖酵解并且加速DN进展。萝卜硫素(sulforaphane,SFN)是一种主要从西兰花等十字花科蔬菜中提取的异硫氰酸盐,Kong et al[3]研究表明,SFN可以减轻糖尿病肾纤维化。花生四烯酸5-脂氧合酶(arachidonic acid 5-lipoxygenase,ALOX5)基因在人体中起着重要作用,其编码的蛋白质是一种催化花生四烯酸等多不饱和脂肪酸过氧化反应的双加氧酶[4]。研究[5]表明,ALOX5在高糖诱导的体外DN细胞模型中表达上调,敲低ALOX5通过抑制核因子kappa B(nuclear factor kappa B,NF-κB)信号传导进而促进高糖处理的肾系膜细胞增殖并抑制细胞凋亡。此外,也有研究[6]表明SFN能够抑制NF-κB通路的激活。然而,关于SFN调控ALOX5/NF-κB信号通路在DN中的作用机制尚不明确。该研究旨在探讨SFN通过调节ALOX5/NF-κB信号通路调控巨噬细胞糖酵解对DN进展影响的机制。
1 材料与方法
1.1 主要材料与仪器雄性C57BL/6小鼠[许可证号:SCXK(蒙)2020-0001]购自内蒙古医科大学实验动物中心;人近端肾小管上皮细胞系(HK-2细胞)和人单核细胞白血病细胞系(THP-1细胞)(中国科学院上海细胞库,货号:GNHu47、TCHu57);SFN(上海诗丹德标准技术服务有限公司,货号:4478-93-7);链脲佐菌素(streptozotocin,STZ)(上海懋康生物科技有限公司,货号:18883-66-4);Lipofectamin3000试剂盒、RPMI-1640培养基(美国ThermoFisher公司,货号:L3000015、11875119);CCK-8溶液、佛波醇 12-肉豆蔻酸酯 13-乙酸酯(phorbol 12-myristate 13-acetate,PMA)、Triton X-100(美国MedChemExpress公司,货号:HY-K0301、16561-29-8、HY-Y1883A );Transwell细胞培养小室(美国康宁公司,货号:3412);原位末端脱氧核苷酸转移酶标记(TdT-mediated dUTP Nick End Labeling,TUNEL)试剂盒(瑞士Roche公司,货号:11684817910);葡萄糖和乳酸试剂盒(武汉艾美捷科技有限公司,货号:KA4088、K607-100);小鼠CD11b磁珠(北京诺为生物技术有限公司,货号:AM0111210);RIPA裂解液、BCA试剂盒、10%SDS-PAGE、ECL(上海碧云天生物技术股份有限公司,货号:P0013B、ST2222、P0690、P0018S);PVDF膜(美国Millipore公司,货号:IPVH00010);一抗:抗己糖激酶-2(hexokinase-2,HK2)、丙酮酸激酶M2(pyruvate kinase M2,PKM2)、葡萄糖转运蛋白1(glucose transporter 1,GLUT1)、ALOX5、NF-κB、p-NF-κB和β-actin,二抗:辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG(美国Abcam公司,货号:ab209847、ab85555、ab115730、ab169755、ab239882、ab264271、ab8227);Masson染色试剂盒(南京森贝伽生物科技有限公司,货号:BP-DL022); ELISA试剂盒(上海酶联生物科技有限公司,货号:ml037585);细胞培养箱(德国Eppendorf公司,型号:CellXpert® C170i);自动生化分析仪(日本东京日立公司,型号:7600);酶标仪(北京普朗新技术有限公司,型号:DNM-9602A);光学显微镜(日本OLUMPUS公司,型号:IX53);荧光显微镜(日本Nikon公司,型号:SMZ18)。
1.2 方法
1.2.1生物信息学分析 通过Swiss target prediction(http://www.swisstargetprediction.ch/)获得SFN的靶基因,之后借助GEO数据库(https://www.ncbi.nlm.nih.gov)查找DN相关芯片GSE30122和GSE30529,以实验组和对照组基因表达水平的对数倍数变化的绝对值大于1,校正后P<0.05为条件筛选DN相关基因,去除重复基因。借助Venn在线工具(http://bioinformatics.psb.ugent.be/webtools/Venn/)取SFN靶基因和DN相关基因的交集。
1.2.2细胞培养和处理 将HK-2细胞分为如下组:正常糖(NG)组、HG组、HG+SFN组、HG+ALOX5组、HG+SFN+ALOX5组。巨噬细胞和HK-2细胞共培养组分为:NG处理的巨噬细胞+HK-2细胞组、HG处理的巨噬细胞+HK-2细胞组、HG+SFN处理的巨噬细胞+HK-2细胞组、HG+ALOX5转染处理的巨噬细胞+HK-2细胞组、HG+SFN+ALOX5转染处理的巨噬细胞+HK-2细胞组。
使用含有10% FBS和1%青霉素-链霉素的RPMI-1640培养基培养HK-2细胞和THP-1细胞,并置于37 ℃、含5% CO2的培养箱中。为构建体外DN模型,使用30 mmol/L高葡萄糖(high glucose,HG)处理HK-2细胞24 h诱导DN损伤模型,使用5.5 mmol/L正常葡萄糖(normal glucose,NG)处理HK-2细胞24 h作为对照组,将SFN溶解于DMSO中并稀释至所需浓度3 mmol/L后处理HG组细胞24 h[7]。使用100 ng/ml PMA处理48 h诱导THP-1细胞分化为巨噬细胞,并使用上述方法处理巨噬细胞,评估SFN对HG诱导的巨噬细胞糖酵解的影响。
使用Transwell共培养系统完成巨噬细胞和HK-2细胞的共培养,首先在Transwell小室上腔加入HK-2细胞,之后在Transwell小室下腔添加不同条件处理后的巨噬细胞,在37 ℃、含5%CO2的培养箱中连续培养24 h并进行后续实验。
1.2.3细胞转染 将巨噬细胞接种于6孔板中(密度为1×105个/孔),待细胞生长至60%~70%融合度时,使用Lipofectamin3000试剂将ALOX5过表达质粒转染至巨噬细胞,转染48 h后检测转染效率并用于后续研究。
1.2.4CCK-8实验检测细胞活力 将各组细胞以3×103个/孔接种于96孔板中,37 ℃孵育过夜直至细胞贴壁生长,之后将10 μl CCK-8溶液添加到96孔板中,继续孵育1 h。使用酶标仪检测450 nm处的吸光度值。
1.2.5TUNEL法检测细胞凋亡 各组HK-2细胞处理完毕后制备成细胞爬片,室温下用4%多聚甲醛固定30 min。PBS冲洗,用1%Triton X-100透化3 min。PBS洗涤3次,每次5 min,吸水纸吸干样本周围水分,每个样本滴加50 μl TdT酶反应液,放入避光湿盒中,37 ℃反应1 h。PBS再次洗涤,加入DAPI染色液复染细胞核。荧光显微镜下观察并计算阳性细胞百分比,TUNEL阳性细胞为凋亡细胞。
1.2.6检测葡萄糖和乳酸水平 收集各组巨噬细胞培养基,以1 000 r/min的转速离心15 min后取上清液,根据说明书使用葡萄糖和乳酸试剂盒检测上清液中葡萄糖和乳酸的水平。
1.2.7动物实验 18只雄性SPF级C57BL/6小鼠(8周龄)体质量18~22 g用于本研究。将所有小鼠饲养在无特殊病原体的环境中,温度22 ℃,湿度50%~55%,光照/黑暗12 h循环。适应性喂养7 d后,将小鼠分为对照组(con组)、DN组、DN+SFN组。对照组给与正常饲料喂养,DN和DN+SFN组给与高脂饮食,连续喂养4周后构建DN小鼠模型,使用STZ(60 mg/kg,溶解在柠檬酸钠中,pH 4.5)对DN和DN+SFN组小鼠行腹腔注射,每d 1次,注射连续5 d,对照组(con组)腹腔注射等量柠檬酸钠溶液。最后一次注射5 d后,通过小鼠尾静脉检测小鼠空腹血糖,并留取24 h尿液,当连续3 d空腹血糖≥16.7 mmol/L且尿蛋白阳性被认为DN模型诱导成功。随后DN+SFN组小鼠使用SFN(0.5 mg/kg)行皮下注射,每周5次,持续4个月[3]。
1.2.8生化分析 在治疗结束前24 h,将动物关在单独的代谢笼中收集24 h尿液,用ELISA试剂盒检测24 h尿蛋白。实验结束当天,小鼠通过尾静脉收集小鼠血液标本,使用自动生化分析仪测量小鼠空腹血糖(fasting blood glucose,FBG)、血尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,Scr)的水平。
1.2.9肾组织中巨噬细胞分离 血液采集结束后使用50 mg/kg的戊巴比妥钠麻醉小鼠,之后以颈椎脱臼法安乐死小鼠,解剖后取肾组织。小鼠肾组织(100 mg)使用含胶原酶的培养基在37 ℃水浴中消化1 h,然后使用过滤网(40 μm)过滤。使用小鼠CD11b磁珠分离过滤液收获巨噬细胞,用于后续Western blot分析。
1.2.10Western blot检测蛋白表达 使用含有蛋白酶和磷酸酶抑制剂混合物的RIPA裂解液提取各组HK-2细胞、巨噬细胞和小鼠肾组织巨噬细胞中的总蛋白,使用BCA试剂盒检测蛋白的浓度。每组30 μg蛋白在10%SDS-PAGE上进行电泳分离并转移至PVDF膜上,5%脱脂牛奶封闭1 h。然后与一抗:抗HK-2(1/1 000),PKM2(1/1 000),GLUT1(1/100 000),ALOX5(1/2 000),NF-κB(1/1 000),p-NF-κB(1/2 000)和β-actin(1/2 000)在4 ℃下孵育过夜,TBST洗涤后,加入HRP标记的羊抗兔 IgG二抗(1/1 000)在室温下避光孵育2 h。ECL对蛋白条带进行显影、成像,以β-actin作为内参计算目的蛋白的相对灰度值。
1.2.11小鼠肾组织HE染色 小鼠肾组织脱水,10%福尔马林固定,石蜡包埋,切成5 μm厚的切片,脱蜡,水化,常规HE染色后在显微镜下观察肾组织的病理改变。
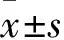
2 结果
2.1 SFN抑制ALOX5/NF-κB信号通路如图1A,生物信息学分析显示SFN的靶基因与DN相关基因的交集共8个,结合相关文献[5]选择ALOX5进行进一步研究。Western blot 检测HK-2细胞和巨噬细胞中ALOX5和NF-κB的蛋白表达。结果显示,与NG组相比,HG组巨噬细胞及HK-2细胞中ALOX5和p-NF-κB的表达均上调(q=20.05、22.54、19.79、21.06,均P<0.001)。与HG组相比,SFN处理后抑制了高糖处理HK-2细胞和巨噬细胞的ALOX5和p-NF-κB的表达(q=13.51、14.72、14.01、14.67,均P<0.001)。见图1B、C。提示SFN处理能够抑制HG诱导的巨噬细胞和HK-2细胞中ALOX5和NF-κB通路相关因子的表达。
2.2 SFN抑制高糖诱导的HK-2细胞损伤CCK-8检测和TUNEL检测结果显示,与NG组相比,HG组HK-2细胞活力百分数下降,TUNEL阳性细胞占比增多(q=13.44、16.96,均P<0.001)。与HG组相比,SFN处理后HK-2细胞活力增强,细胞凋亡被抑制(q=7.523、9.435,均P<0.01)。见图2。提示SFN能够抑制高糖诱导的HK-2细胞损伤。

图2 SFN抑制高糖诱导的肾小管细胞损伤
2.3 SFN抑制高糖诱导的巨噬细胞糖酵解与NG组相比,HG处理上调巨噬细胞上清液中葡萄糖水平和乳酸的水平(q=35.24、14.37,均P<0.001),而SFN处理后HG诱导的葡萄糖水平和乳酸的水平(q=10.31、8.974,P<0.001、P=0.002)被抑制。见图3A、B。Western blot检测结果显示,HG处理后HK2、PKM2和GLUT1的表达均高于NG组(q=14.10、11.59、14.39,均P<0.001),而SFN处理明显降低HG诱导的HK2、PKM2和GLUT1的水平(q=9.574、7.472、9.595,均P<0.01)。见图3C。

图3 SFN抑制高糖诱导的巨噬细胞糖酵解
2.4 SFN抑制高糖处理的巨噬细胞介导的肾小管上皮细胞损伤将CCK-8和TUNEL检测结果显示,与NG处理的巨噬细胞+HK-2细胞组相比,HG处理的巨噬细胞+HK-2细胞组细胞活力降低,细胞凋亡增加(q=17.11、17.32,均P<0.001);SFN处理后,HG处理的巨噬细胞+HK-2细胞活力增强,且细胞凋亡减少(q=13.64、10.40,均P<0.001)。见图4。提示SFN能够抑制高糖处理的巨噬细胞介导的肾小管上皮细胞损伤。

图4 SFN抑制巨噬细胞介导的肾小管上皮细胞损伤
2.5 过表达ALOX5减弱SFN对巨噬细胞糖酵解引起的肾小管上皮细胞损伤的保护作用检测结果显示,与HG+SFN组相比,HG+SFN+ALOX5组巨噬细胞培养基上清液中葡萄糖水平和乳酸水平升高(q=4.950、5.739,P=0.033、0.0154),且细胞中糖酵解相关蛋白HK2、PKM2和GLUT1表达均上调(q=3.888、6.760、6.327,P=0.048、0.005、0.007)。提示ALOX5可能促进巨噬细胞的糖酵解过程。此外,相比于HG+ALOX5组,SFN处理后,HG+SFN+ALOX5组巨噬细胞中的葡萄糖水平和乳酸水平降低(q=10.97、10.66,均P<0.001),糖酵解相关蛋白HK2、PKM2和GLUT1表达降低(q=20.91、16.69、27.13,均P<0.001)。见图5A-C。提示SFN可能抑制ALOX5促进巨噬细胞的糖酵解这一过程。与HG+SFN处理的巨噬细胞+HK-2细胞组相比,
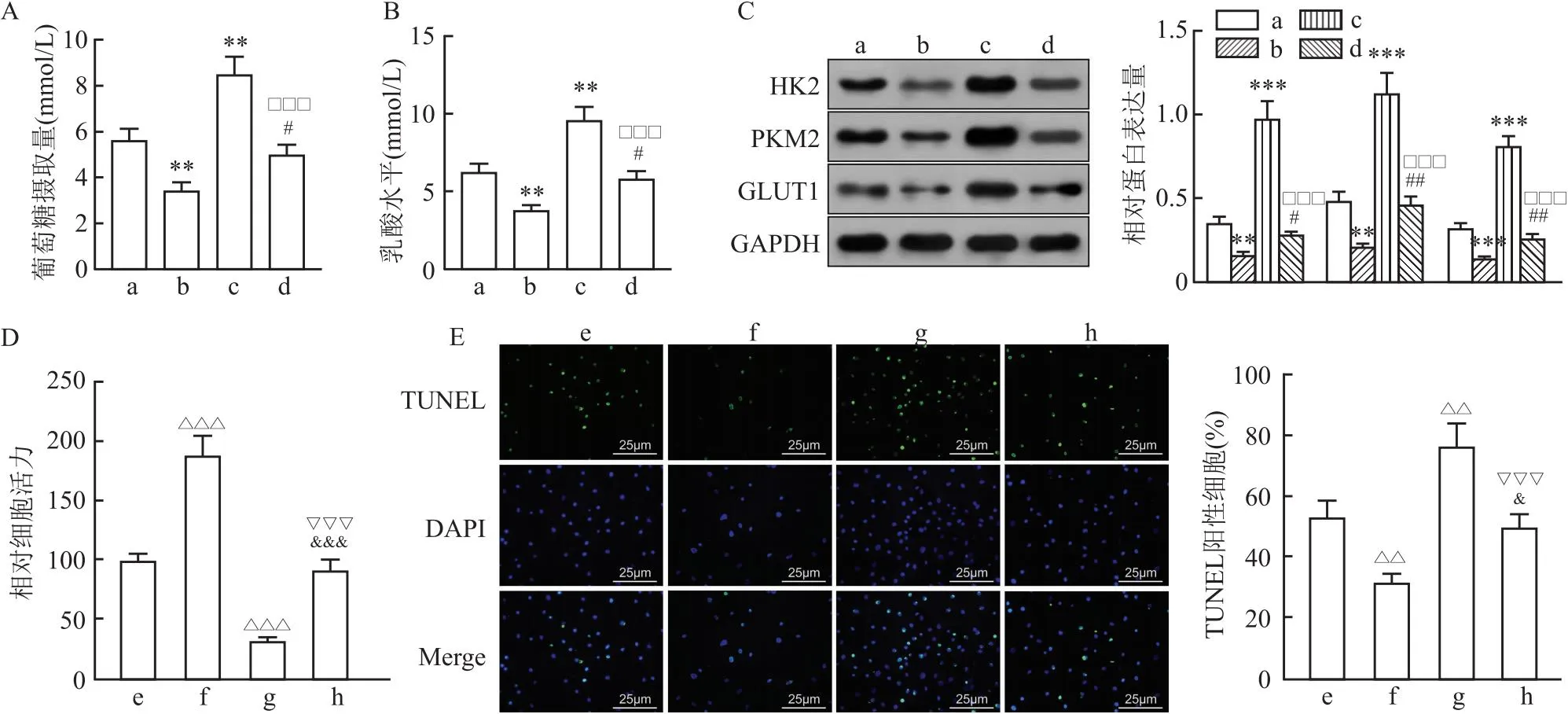
图5 过表达ALOX5减弱SFN对巨噬细胞糖酵解引起的肾小管上皮细胞损伤的保护作用
转染ALOX5并且以HG+SFN处理的巨噬细胞+HK-2细胞组中的细胞活力降低,细胞凋亡增加(q=16.34、5.92,P<0.001、P=0.013)。与HG+ALOX5转染处理的巨噬细胞+HK-2细胞组比较,HG+SFN+ALOX5转染处理的巨噬细胞+HK-2细胞组中细胞活力增加、凋亡降低(q=10.08、8.68,均P<0.001)。见图5D、E。说明通过促进ALOX5表达可能影响肾脏细胞的活力和凋亡水平,并且会影响SFN对肾脏细胞的保护作用。
2.6 SFN减轻DN模型小鼠肾损伤并抑制肾脏巨噬细胞糖酵解本研究动物实验示意图见图6A。与con组比较,DN组小鼠FBG、24小时尿蛋白、BUN和Scr均上调(q=18.17、21.61、20.45、10.88,均P<0.001),糖酵解相关蛋白HK2、PKM2和GLUT1表达均升高(q=17.92、15.50、15.09,均P<0.001)。使用SFN治疗后,FBG、24小时尿蛋白、BUN和Scr水平均降低(q=9.265、8.538、9.830、7.183,均P<0.01),糖酵解相关蛋白HK2、PKM2和GLUT1表达均降低(q=11.88、10.44、10.06,均P<0.01)。见图6B-E、G。HE染色结果显示,con组肾小球体积和结构无明显改变,DN组肾小球基底膜增厚、系膜增生,细胞空泡变性增多,肾小球体积增大,而SFN治疗后,这些病理改变和纤维化得到改善。见图6E。提示SFN可能对DN具有治疗作用。

图6 SFN对DN模型小鼠肾损伤和肾脏巨噬细胞糖酵解影响
3 讨论
DN的发病机制复杂,且多种因素,如血流动力学异常、代谢紊乱和晚期糖基化终产物的形成均被认为与DN的发病有关[8]。巨噬细胞是DN患者和动物模型肾组织中浸润最丰富的免疫细胞类型之一。高血糖、肾小球免疫复合物沉积和趋化因子的产生能够促进巨噬细胞在肾脏中的积累和活化,进而导致肾损伤和纤维化[9]。有文献[10]报道,DN小鼠肾脏巨噬细胞糖酵解增强,通过抑制巨噬细胞糖酵解可以减轻肾脏炎症和纤维化。本研究表明SFN能够抑制ALOX5和NF-κB的表达及巨噬细胞糖酵解介导的肾小管上皮细胞损伤,且SFN有利于改善DN小鼠肾功能和组织损伤。
糖酵解是一种细胞代谢途径,最近的研究[11]表明,M1巨噬细胞被促炎因子激活时会快速通过糖酵解获取能量并促进炎症反应。Zeng et al[12]表明,HG可以诱导骨髓源性巨噬细胞分化为M1促炎表型,且在HG条件下M1巨噬细胞糖酵解增加。此外,糖酵解激活会进一步上调巨噬细胞中促炎和纤维化基因的表达[13]。本研究结果表明,HG处理后巨噬细胞培养基上清液中葡萄糖和乳酸的水平升高,糖酵解相关蛋白(HK2、PKM2、GLUT1)的表达上调。同时,从DN小鼠肾脏分离的巨噬细胞中糖酵解相关蛋白的表达高于正常对照组小鼠。这些结果表明,在高葡萄糖环境下或DN发展过程中,巨噬细胞的糖酵解途径增加。这可能是由于糖酵解相关蛋白表达的上调导致了葡萄糖的优先代谢及乳酸的累积。而使用SFN处理巨噬细胞后,糖酵解途径被抑制,可能是通过调控糖酵解相关蛋白的表达来实现。
关于DN的研究[14]显示ALOX5在高葡萄糖处理的HK-2细胞中表达上调,且ALOX5可能参与了DN患者中的铁死亡分子机制,可能通过特定的代谢途径和免疫/炎症机制发挥作用。NF-κB是一种核转录因子,有研究[15]报道NF-κB在DN中表达上调,抑制其活化能够减轻高糖处理对足细胞的促炎反应和促凋亡作用。本研究证明了ALOX5是SFN治疗DN的核心靶点。HG处理后的巨噬细胞和HK-2中ALOX5和p-NF-κB的蛋白表达上调,而SFN处理则能够抑制ALOX5和p-NF-κB的表达。本研究显示过表达ALOX5能够增强HG条件下巨噬细胞糖酵解以及巨噬细胞介导的HK-2细胞损伤,减弱SFN对HK-2细胞的保护作用。这些发现强调了ALOX5在糖尿病性肾病中的重要作用,并且提示SFN可能通过抑制ALOX5和p-NF-κB表达,调节糖酵解和巨噬细胞介导的损伤来发挥其治疗DN的作用。
综上所述,SFN通过抑制ALOX5/NF-κB通路激活来抑制巨噬细胞糖酵解从而改善DN的进展。ALOX5可以作为治疗DN的潜力靶点。本研究为DN的治疗提供了新的方向和思路。然而本研究也存在一定局限性,如本研究只关注了ALOX5和NF-κB通路,未完全探究其他可能的机制和靶点,可能有其他未知的关键因素在DN的发展中起到了重要作用。此外,本研究并未对SFN的药理学或毒理学进行深入研究。未来有待进一步研究ALOX5和NF-κB通路参与DN进展的机制以及SFN的药理作用。

