内皮素-1调控SOCC/TGF-β参与房颤大鼠发生心房纤维化
贾卓然,代曼玉,梁士楚,吴 健,薛杨诚,张定欣,沈 兵,赵 韧
心房颤动(atrial fibrillation,AF)是最常见的心律失常,我国成年人AF患病率为1.6%,较之前明显升高[1]。心房结构重构和电重构引发并维持AF,目前认为,心房纤维化是AF主要病理基础,但心房纤维化的发生发展的机制研究缺乏,对于心房纤维化的有效干预靶点仍有待探究。内皮素系统在维持心血管稳态中发挥重要作用,是治疗心血管系统疾病的重要靶标之一。大量研究[2-4]发现,AF患者外周血和心房组织内皮素-1(endothelin-1,ET-1)含量升高,参与心房纤维化过程。钙库操纵性钙内流是钙离子进入细胞内的主要模式之一,对细胞分化、增殖、凋亡具有重要调控作用,其中,钙感受器基质相互作用分子1(stromal interaction molecule 1,STIM1)、钙释放激活的钙通道蛋白1(calcium release-activated calcium channel protein 1,Orai1)是钙库操纵性钙通道(store-operated calcium channels,SOCC)的主要功能蛋白。研究[5]表明ET-1通过介导胞外钙离子内流及胞内钙库释放调控胞浆钙离子浓度,最近的研究[6]显示,SOCC的激活参与ET-1在缺血再灌注过程中介导的冠脉收缩,但SOCC的激活是否参与AF心房纤维化过程及是否与ET-1调控相关尚不明确。该研究通过构建AF大鼠模型及体外HL-1细胞实验,研究AF心房结构变化及心房组织中ET-1、Orai1、STIM1、TGF-β和COL-1蛋白表达情况,探究ET-1及SOCC在AF发生过程中的关联,并探讨ET-1对AF心房纤维化的作用和机制。
1 材料与方法
1.1 材料
1.1.1实验动物 经安徽医科大学伦理委员会批准(伦理学批号:No.LLSC20190530),14只健康雄性成年Sprague-Dawlay (SD)大鼠来自安徽医科大学动物实验中心,体质量220 g左右,组间体质量无统计学差异,心率450次/分左右,窦性心律,依随机数字原则分为对照(normal control,NC)组、房颤(atrial fibrillation,AF)组,统一标准饲料喂养,自由饮水,动物实验室12 h/12 h明暗交替,湿度50%左右,温度维持在 24 ℃左右并通风良好。
1.1.2主要试剂和仪器 ET-1 (货号:HY-P71446)购自美国MedChemExpress公司; 乙酰胆碱(acetylcholine,Ach)(货号:A6625)购自上海Sigma-Aldrich公司;氯化钙(CaCl2)(货号:ST365)及BCA蛋白浓度测定试剂盒(货号:P0010)购自上海碧云天生物科技有限公司;小干扰RNA(small interfering RNA,siRNA) (货号:NS-028541)购自北京梓熙生物科技有限公司;Orai1 siRNA (si Orai1) 序列:sense (CCUCAACUCGGUCAAAGAG),antisense (CUCUUUGACCGAGUUGAGG);一抗 Anti-TGF-β (货号:BF 8012)、ET-1 antibody(货号:DF6125)、Anti-Orai1 (货号:DF 7956)、Anti-GAPDH (货号:AF 7021)、山羊抗小鼠二抗 (货号:S0002)及山羊抗兔二抗(货号:S0001)购自美国Affinity Biosciences公司;STIM1抗体(货号:GTX54855)购自美国 GeneTex公司; 一抗Anti-COL1 (货号:R 26615)购自ZENBIO Biosciences公司;一抗Anti-Tubulin (货号:10094-1)购自美国Proteintech Biosciences公司;HE染色试剂盒(货号:G 1120)及Masson三色染色试剂盒(货号:G 1340) 购自北京索莱宝生物科技有限公司;减血清培养基(opti-minimal essential medium,Opti-MEM)(货号:31985070)购自美国Thermo Fisher Scientific Inc.US.。小鼠心房肌细胞HL-1细胞 (货号:FH1101)购自上海富衡生物科技有限公司。心脏超声仪器购自美国General Electric HealthCare公司(型号:Vivid E95 Ultra Edition);体式辅助显微镜(型号:BX53F2)购自日本Olympus Corporation;二氧化碳培养箱(型号:HF90)购自上海力康生物医疗科技控股有限公司。
1.2 方法
1.2.1SD大鼠分组及AF模型构建 将14只SD大鼠随机分为NC组和AF组,每组7只。NC组大鼠10%的水合氯醛腹腔注射麻醉后,仰卧固定于鼠板上,四肢伸展用绝缘弹力带牵拉固定,针形电极分别刺入四肢皮下,记录正常心电图。暴露大鼠尾静脉,静脉注射生理盐水0.1 ml/100 g,每日尾静脉注射1次,连续注射7 d,再次记录心电图;AF组大鼠同样记录正常心电图后,暴露大鼠尾静脉,静脉注射CaCl2-Ach混合液0.1 ml/100 g(混合液浓度为CaCl210 mg/ml + Ach 66 ug/ml新鲜配制),每日尾静脉注射1次,连续注射7 d,记录心电图,出现典型AF心电图表现说明模型构建成功(P波消失,代之以大小不等f波并持续时间>2 s)。
1.2.2超声心动图 以50 mg/kg剂量腹腔注射0.3%戊巴比妥钠全身麻醉两组SD大鼠,胶带固定大鼠四肢,使其背部朝下仰卧于鼠板上,充分暴露心脏所在位置,除去表皮毛发,打开心脏超声仪器,准备完成后使用探头(型号:12 s)寻找大鼠心脏位置,M型频谱扫描速度为200 mm/s,测定左室收缩末期内径(left ventricular end-systolic diameter,LVESD)、左室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)及射血分数(ejection fraction,EF),计算左室分数缩短率(fractional shortening,FS)=[(LVEDD-LVESD)/LVEDD]×100%。采用模式追踪法在胸骨旁长轴切面主动脉窦水平测量左房内径(left atrium diameter,LAD),计算模型建立前后LAD、EF及FS的差值,并分别表示为ΔLAD、ΔEF及ΔFS。每项参数测量3次,计算平均值。
1.2.3心房组织HE染色和Masson染色 以50 mg/kg剂量腹腔注射0.3%戊巴比妥钠全身麻醉两组SD大鼠,无菌手术器械打开胸腔,取出心脏,无菌PBS液冲洗后,置于显微镜下分离出心房组织,固定脱水后制备石蜡切片。HE染色:将石蜡切片依次放入二甲苯醇Ⅰ浸泡10 min,无水二甲苯醇Ⅱ浸泡约10 min,无水二甲苯醇Ⅲ浸泡10 min 后用无水乙醇Ⅰ浸泡5 min,无水乙醇Ⅱ浸泡5 min后,依次按照由高到低浓度梯度乙醇溶液浸泡20 min,用苏木精液染液处理5 min后水洗1 min,复用0.5%的盐酸乙醇分化液处理30 s,水洗1 min 后用碳酸锂蓝化处理30 s,水洗2 min,加伊红液染色处理3 s,流水冲洗1 min,依次按照由高到低浓度梯度的乙醇脱水后二甲苯冲洗使组织透明,滴加中性树胶,盖玻片封片,显微镜下观察。根据Masson染色试剂盒说明进行Masson染色。PBS缓冲液清洗切片3次,每次10 min,滴加铁苏木精染色液4 min后水洗,酸性乙醇溶液分化10 s,Masson蓝化液染色3 min,再次水洗1 min,丽春品红液染色1 s,弱酸水冲洗1 min,磷钼酸溶液分色2 min,苯胺蓝染液染色1 min,乙醇脱水后二甲苯冲洗使组织透明,滴加中性树胶封片,显微镜下观察。
1.2.4Western blot 法检测心房组织ET-1、Orai1、STIM1、TGF-β和COL-Ⅰ蛋白表达 取大鼠心房组织,加入适量裂解液,冰上研磨,4 ℃,12 000 r/min,离心20 min,取上清液,BCA蛋白浓度测定试剂盒检测总蛋白含量,配平后行Western blot试验,转膜后5%脱脂牛奶室温孵育PVDF膜2 h,之后加入稀释一抗ET-1 (1∶1 000),Orai1 (1∶1 000),STIM1 (1∶1 000),TGF-β(1∶1 000),COL-Ⅰ (1∶1 000)4 ℃孵育过夜,洗膜后室温孵育相应稀释二抗(1∶2 000)2 h,PBST洗膜后加入ECL显影液显影曝光。使用ImageJ软件分析条带灰度值,检测各组心房组织中ET-1、Orai1、STIM1、TGF-β、COL-Ⅰ的相对蛋白表达水平。
1.2.5细胞培养、分组和转染 复苏HL-1细胞,从液氮罐中取出细胞冻存管,37 ℃水浴解冻,1 000 r/min 离心5 min 后,均匀接种于60 mm细胞培养皿,加入10%培养基约2 ml,于37 ℃恒温,5% CO2细胞培养箱培养。细胞传代,第3代传代至6孔板,细胞贴壁程度至正常70%时进行细胞小干扰RNA (small interfering RNA,siRNA)的转染,更换为Opti-MEM。将HL-1细胞分为4组:NC组(对照组)、ET-1组(ET-1处理)、Si Orai1组(Si Orai1转染使Orai1表达降低)、ET-1+Si Orai1组(Si Orai1转染使Orai1表达降低并使用ET-1处理)。以lipofectamine 3000为转染试剂,Si Orai1组加入si Orai1溶液,转染浓度为100 nmol/L,置于37 ℃恒温,5% CO2培养箱继续培养,6 h后更换新鲜10% DMEM培养基,转染48 h后进行Orai1蛋白表达量检测;ET-1组使用50 nmol/L的ET-1处理HL-1细胞24 h;ET-1+Si Orai1组即HL-1细胞在使用Si Orai1转染48 h后,使用50 nmol/L的ET-1处理24 h ;对照组细胞不做处理,置入37 ℃恒温,5% CO2培养箱培养48 h。
1.2.6Western blot法检测细胞Orai1、STIM1和TGF-β蛋白表达 将细胞从培养箱中取出,冰上操作,吸尽原培养基后加入细胞裂解液,摇床震荡20 min充分裂解后转至EP管,4 ℃高速离心机12 000 r/min离心10 min,取上清液进行BCA蛋白定量后行Western blot实验,依次上样、电泳、转膜,转膜后5%脱脂牛奶室温孵育PVDF膜2 h,之后加入稀释一抗Orai1 (1∶1 000),STIM1 (1∶1 000),TGF-β(1∶1 000)4 ℃孵育过夜,洗膜后加入相应稀释二抗(1∶2 000)室温孵育2 h后,均匀滴加显影液后曝光。用ImageJ软件分析条带灰度值检测蛋白表达水平。
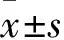
2 结果
2.1 AF组与NC组大鼠心电图与超声心动图相关指标的比较心电图记录结果显示NC组大鼠呈窦性心律(图1A),AF组大鼠可见典型AF心电图表现(图1B);大鼠超声心动图数据显示,与NC组大鼠相比(0.028±0.009) mm,AF组大鼠左房ΔLAD (0.119±0.013) mm增大(t=5.75,P<0.001),而ΔEF、ΔFS两组差异无统计学意义(t=1.70、2.49,均P>0.05)。见图1C。

图1 两组大鼠心电图及超声心动图的比较
2.2 AF组大鼠心房组织病理变化情况SD大鼠心房组织HE及Masson染色结果显示,NC组心房肌细胞排列整齐,形状基本一致,AF组可见大片蓝色胶原纤维沉积(图2A),AF组大鼠心房组织纤维化增加(t=3.52,P<0.05)。见图2B。

图2 两组大鼠心房组织纤维化情况的比较
2.3 AF组大鼠心房组织中ET-1、COL-1、Orai1、STIM1和TGF-β蛋白表达增多利用Western blot检测心房组织中ET-1、纤维化相关蛋白COL-Ⅰ及TGF-β表达情况与SOCC功能蛋白Orai1、STIM1表达水平,结果显示,与NC组大鼠相比,AF组大鼠心房组织中ET-1、COL-1及TGF-β蛋白表达增多(t=2.92、5.19、2.45,均P<0.05),此外,AF组心房组织中Orai1、STIM1蛋白表达也增多(t=3.58、5.21,均P<0.01)。见图3。提示AF大鼠在ET-1蛋白表达增多的同时发生心房纤维化。

图3 两组大鼠心房组织中ET-1、COL-1、Orai1、STIM1和TGF-β蛋白表达的比较
2.4 ET-1对HL-1细胞Orai1、STIM1、TGF-β表达情况影响Western blot检测结果显示,HL-1细胞接受浓度为50 nm/L的ET-1处理24 h后,Orai1、STIM1、TGF-β的表达上调(t=4.36、4.85、5.69,均P<0.05);当细胞中SOCC功能蛋白Orai1表达敲减后,ET-1+Si Orai1组细胞中TGF-β的表达与NC组差异无统计学意义,然而,相较于ET-1组,其表达呈下调趋势(图4),提示ET-1促进HL-1细胞TGF-β的表达过程中,SOCC功能蛋白参与其中。

图4 ET-1对HL-1细胞Orai1、STIM1和TGF-β表达情况影响
3 讨论
目前,心房结构重构、电重构、异常钙离子电流和自主神经系统变化在AF的发生发展中发挥重要作用,其中以心房纤维化为主要表现的结构重构是AF发生和维持的关键[7]。许多途径如肾素-血管紧张素-醛固酮系统、氧化应激和信息传递途径能够调节心房纤维化,TGF-β是其中一个关键调节器[8]。当前研究[9-10]表明,沙库巴曲缬沙坦通过降低TGF-β表达和通过影响心房肌的钙离子通道抑制心房纤维化的进展。最新研究[11]发现乳脂球-EGF因子8通过负向调控TGF-β/Smad2/3抑制心房纤维化,但具体作用机制尚不明确。临床上,AF患者亟需改善心肌重构治疗新途径[12],但对于心房纤维化尚无明确的治疗策略,AF患者心房纤维化的机制需要更多的探索与研究。本研究显示AF大鼠心房增大,心房发生纤维化,同时ET-1/SOCC/TGF-β信号通路关键蛋白表达上调,抑制SOCC的同时抑制了HL-1细胞中的TGF-β蛋白的表达,初步表明了ET-1/SOCC/TGF-β信号通路对心房纤维化的促进作用,拮抗其中相关分子可能能够有效干预AF和心房纤维化进展。
ET-1是人类重要的内皮素亚型之一,主要由内皮细胞分泌,可以作为细胞因子或与其受体结合在组织纤维化中发挥重要作用,心脏中存在ETA和ETB受体,其中内皮素受体拮抗剂波生坦已被证明可以减少高血压和修复性心肌纤维化动物模型中纤维化心肌的重构[13]。最近研究[2]表明,AF患者血清ET-1水平显著升高,与AF持续时间呈正相关,且在射频消融术后复发的AF患者中ET-1水平较高,表明ET-1在AF发生和维持过程中发挥重要作用。AF患者心耳ET-1和COL-Ⅰ表达及胶原纤维沉积增多,且COL-Ⅰ表达水平与ET-1表达水平呈正相关,提示ET-1可能通过促进心房纤维化而参与AF的发生[3],但具体机制尚不明确。本研究显示AF大鼠心房组织中ET-1表达增加,HL-1细胞培养后ET-1诱导TGF-β合成增加,提示ET-1/TGF-β可能参与AF和心房纤维化的过程。
SOCC与心肌纤维化的发生密切相关。Orai1和STIM1作为SOCC两个重要分子基础,在心肌重构过程中发挥重要作用。药理研究[14]表明,SOCC和非选择性阳离子通道是ET-1诱导平滑肌收缩、丝裂原活化蛋白激酶磷酸化和花生四烯酸释放的重要钙内流途径。但ET-1诱导的心肌纤维化过程中,SOCC是否参与其中尚不明确。最近研究[15]表明,Orai1介导的Ca2+内流的上调,增强人心房成纤维细胞的增殖和迁移能力。本研究显示HL-1细胞中Orai1表达降低后ET-1的诱导不再使TGF-β蛋白表达水平升高,表明Orai1参与ET-1诱导心房纤维化的过程。
综上所述,本研究探索了通过ET-1/SOCC/TGF-β信号通路促进AF大鼠发生心房纤维化,拮抗该信号通路中相关分子如Orai1可能会有效干预心房纤维化在AF发生中的进展。此结果为改善AF患者心房纤维化提供了新的治疗方向与药物靶点。然而ET-1是作为细胞因子或是与其受体结合调控SOCC/TGF-β尚未得到具体研究,因此也将成为下一步实验的研究重点。

