谷子DUS 测试标准品种指纹图谱的构建与应用
史慎奎 祁东梅 王春芳 王玉芳 蔡爽

摘要:谷子遗传资源多样性的研究对谷子基础研究与育种实践具有重要意义。选择高质量的SSR 标记对DUS(Distinctness-特异性、Uniformity-一致性和Stability-稳定性)测试标准品种进行遗传多样性分析,不仅能够解析标准品种的遗传信息,也有助于对新育成品系进行分子水平的遗传多样性分析。研究利用高质量的20 个SSR标记对30 份不同地理来源的谷子DUS 测试标准品种进行遗传多样性分析,并构建其指纹图谱;同时,利用该指纹图谱的SSR 标记对22 份春谷区和30 份夏谷区区试品种进行遗传多样性分析,旨在为谷子品种资源利用与遗传改良奠定理论基础。结果表明,20 对SSR 标记在DUS 测试品种平均每对引物检出的等位变异数为9.15 个,20 个位点的平均多态性信息含量(PIC)为0.77。利用上述SSR 标记对来自春谷区与夏谷区的共计52 份谷子区试品种进行分子鉴定,春谷区的聚类分析结果显示,22 份春谷区区试品种分为3 个主要的类群;而夏谷区的聚类分析结果显示,30 份谷子夏谷区区试品种分为4 个类群,但难以区分春谷、夏谷区区试品种。研究结果厘清了谷子DUS 测试标准品种和区试品系间的遗传相似性。
关键词:谷子;指纹图谱;遗传多样性;DUS 测试;区试品种
中图分类号:S515 文献标识码:A 文章编号:1002?2481(2024)01?0010?09
谷子是我国北方旱作农业区重要的特色作物之一,距今已有8 700 a 的栽培历史。其具有优良的抗旱、节水特性,是旱地农业的稳产作物,也是应对未来干旱形势的战略储备作物[1-2]。我国是谷子的起源中心,谷子种质资源的遗传多样性丰富[3]。因此,利用分子标记技术构建指纹图谱,并研究谷子的遗传多样性,有助于谷子遗传基础的解析与种质资源的有效利用,对谷子的种质资源创新与遗传改良具有重要意义[4-7]。
SSR(Simple sequence repeat)标记由于其在基因组间分布广泛,表现出共显性与重复性好、多态性高、扩增结果稳定、检测手段简便等优势,从而被广泛应用于作物品种资源的指纹图谱构建、遗传关系分析等研究[8-9]。JIA 等[10]利用自主开发的15 个EST-SSR 標记对12 份谷子进行遗传多样性分析,其中,4 个标记表现出多态性,共检测到10 个等位变异,由于EST-SSR 标记的多态性丰富性较差,不适于作遗传多样性分析。贾小平等[11]利用37 个SSR 标记在来自中国、印度和俄罗斯的共计40 份谷子品种中共检测出228 个等位变异,平均等位变异位点为6.16 个,多态性信息含量(PIC)为0.697,显示了SSR 标记在分析谷子遗传变异方面的有效性。对于目前谷子DUS 测试标准品种来说还未从分子标记水平上进行遗传多样性分析,也未筛选出一套用于标准品种和区试品种的较为高效应用性SSR 标记。
本研究使用筛选到的20 个高质量的SSR 标记对30 份谷子DUS 测试标准品种进行指纹图谱的构建,同时对来自春谷区和夏谷区的52 份区试品种进行遗传多样性分析,以期能够为区试材料的遗传相似性分析和后续参加DUS 测试奠定基础,亦能够为谷子品种资源管理与利用、育种实践、品种审定及新品种保护等方面提供一定的科学依据与技术基础。
1 材料和方法
1.1 试验材料
本研究利用30 份谷子DUS 测试品种(表1)构建DNA 指纹图谱,并利用该指纹图谱对22 份春谷区试品种和30 份夏谷区试品种进行遗传多样性检测(表2)。
1.2 基因型检测
采用CTAB 法提取谷子基因组DNA,使用紫外分光光度法测定DNA 浓度,稀释至20 μg/L。PCR 扩增反应在eppendorf 公司PCR 仪上进行,反应总体积为20 μL,包括DNA 模板(20 ng/μL)2 μL,2×Es TaqMasterMix 10 μL,正反向引物各1 μL,去离子水6 μL。扩增产物在6% 变性聚丙烯酰胺凝胶以50 W 恒功率电泳分离,用硝酸银法对凝胶进行染色、显影并拍照。
本研究选用20 个SSR 标记进行指纹图谱构建与遗传多样性检测,所有SSR 标记分布在谷子的1~9 号染色体上(表3)[11]。
1.3 数据统计与分析
用Excel 的形式,将清晰的条带转换成数字形式,形成“01”矩阵(要求:无扩增条带记为“0”,有扩增条带记为“1”)[12-13]。通过POPGENE V1.32[14]和Powermarker[15]软件来分析基因型数据,从而获得SSR 标记位点的有效等位变异数(Ne)、香农-韦弗(Shannon-Weaver)指数(I)、观测核苷酸杂合度(Ho)、期望核苷酸杂合度(He)、Nei?s 多样性指数以及等位变异数Na[15]。通过NTSYS(Version 2.10e)软件来分析基因型数据,从而获得30 份谷子DUS测试品种的指纹图谱以及区试品种间遗传关系的聚类图[16]。
2 结果与分析
2.1 DUS 测试品种指纹图谱构建与遗传多样性分析
本研究使用的20 个SSR 标记覆盖谷子全基因组的9 条染色体,每条染色体的标记数量为2~3 个。SSR 引物在谷子DUS 测试品种中的扩增结果显示,全部引物在多数材料中均能实现稳定、清晰的扩增,例如,p80 和b165 在30 份谷子材料中仅有1 份材料未能实现有效扩增,其余材料均能有效扩增(图1),分别检测出等位位点4 个和6 个,所有SSR 标记多态性信息含量(PIC)分别为0.65 和0.73,b185 的PIC 值最低,为0.47,共测出等位位点数5 个,而b247 共检测出等位位点数15 个,PIC 值最高,为0.91(表4)。
每个标记检测出的等位变异数为5~15 个,平均每个位点检测出的等位变异数为9.15 个,每个位点获得有效等位变异数(Ne)为2.1~12.2 个,香农-韦弗(Shannon-Weaver)指数(I)分布范围为1.00~2.59,所有SSR 标记多态性信息含量(PIC)为0.47~0.91,平均值为0.77(表4)。
使用其中20 對SSR 标记即可对30 份谷子DUS 测试品种进行指纹图谱构建,结果表明,仅用前16 个SSR 标记即可将30 份谷子品种进行区别鉴定(图2)。
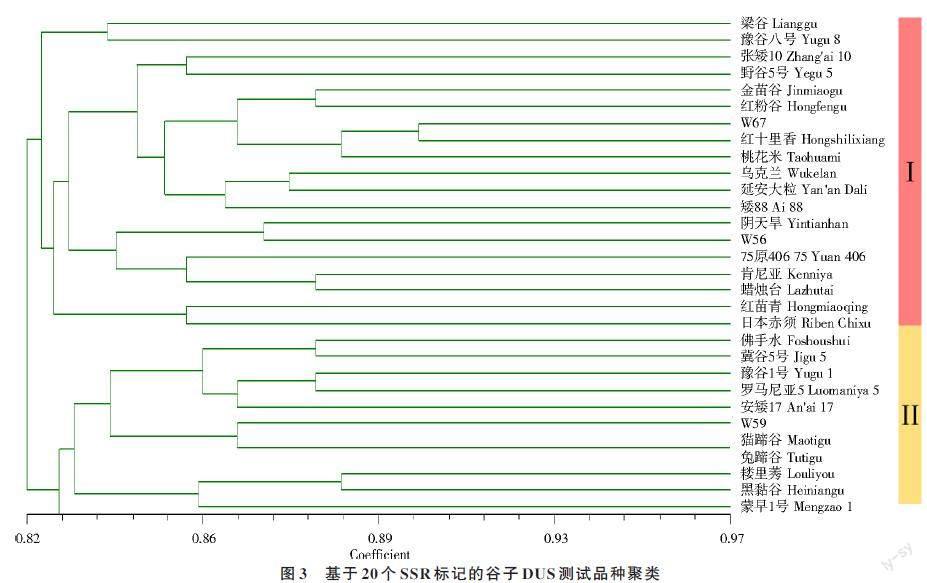
进一步对DUS 测试品种进行遗传聚类分析,结果显示(图3),可以将30 份品种分为两大类群,类群I 包括粱谷等19 份品种,类群Ⅱ包括佛手水等11 份品种;30 份谷子DUS 标准品种间遗传相似系数(genetic similarity,GS)值变动于0.82~0.97,其中I 组内遗传相似度最高的2 个品种为W67 与红十里香,II 组内遗传相似程度最高的为2 个农家品种猫蹄谷与兔蹄谷。
2.2 指纹图谱的应用
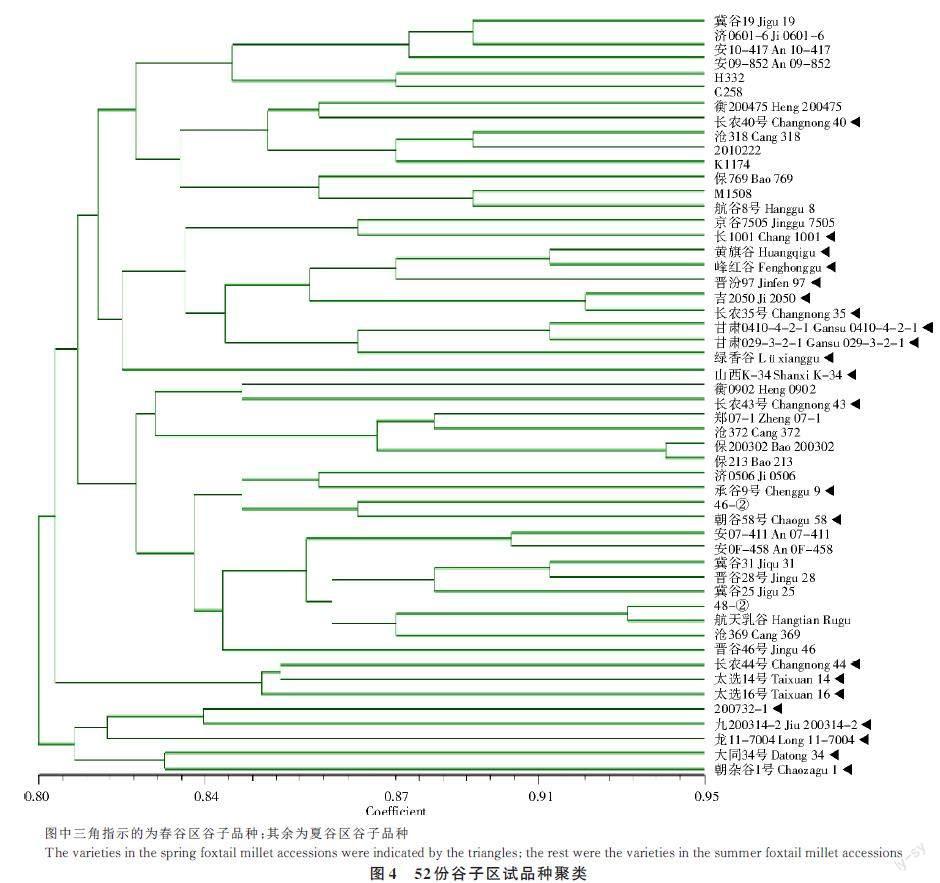
利用上述构建DUS 测试品种指纹图谱的分布在谷子不同染色体上的20 个SSR 标记,对春谷区试品种和夏谷区试品种进行遗传多样性分析。首先对全部春谷区和夏谷区区试品种52 份材料进行整体聚类分析,未见其明显分为两大类,也暗示春谷区材料和夏谷区材料之间具有共同的遗传基础,可能与跨生态区域的种质资源交流较为频繁有关(图4)。
进一步对22 份春谷区区试品种聚类,分为3 个主要的类群,即I、II 和III(图5-A),I 组包括2 个品系200732-1 与龙11-7004,III 组包括长农40 号、长农43 号、长农44 号、太选14 号和太选16 号等5 个品种,均为来自山西的品系;II 组中包括15 个品系,甘肃的2 个品系遗传相似度最高,与农家品系绿香谷亲缘关系较近;2 个农家品系黄旗谷和峰红谷遗传相似度较高,与育成品种承谷9 号遗传关系较近;来自东北的品系如吉2050、朝谷58、朝杂谷1 号等与来自山西的品系聚在一起。
夏谷区的聚类分析显示,30 份夏谷区区试品种分为4 个类群,即I、II、III 和IV(图5-B),其中I 组包括7 个品系,II 组包括4 个品系,III 组包括5 个品系,IV 组包括14 个品系。遗传相似度最高的为来自保定的2 个品系保200302 和保213,其次是郑07-1 与沧372、晋谷28 号与冀谷25 和M1508 和航谷8 号相似度较高。
3 结论与讨论
谷子育成品种的遗传多样性分析是发掘谷子遗传改良的基础[2],对谷子DUS 测试品种的遗传多样性分析有利于对其遗传基础的剖析[13,17],也有助于DUS 测试品种的应用。本研究选用20 对分布于谷子9 条染色体上的SSR 引物对30 份不同地理来源的谷子DUS 测试品种进行分析,构建了谷子的指纹图谱。每个标记检测出的等位变异数为5~15 个,平均每个位点检测出的等位变异数为9.15 个,平均PIC 为0.77。本研究结果略低于朱学海等[18]报道的用21 个SSR 标记对120 个谷子品种进行鉴定,其检测出的平均等位变异数为14.5 个/位点,平均PIC 值为0.809 的结果,但高于贾小平等[11]报道的用37 个SSR 标记检测40 个谷子品种,其检测出的平均等位变异数为6.16 个/位点,平均PIC值为0.697 的结果;同时远高于JIA 等[10] 用15 个SSR 标记对12 个谷子品种进行鉴定,发现其平均等位变异数为2.5 个/位点,也高于杨天育等[4]报道的用60 对引物检测来自我国北部高原生态区的20 个谷子品种,其检测出的平均等位变异数为2.71 个/位点。产生这一结果的原因之一可能是DUS 测试品种存在较大的地理来源差异,另外,也可能是由于使用的SSR 标记具有丰富的遗传变异,造成在DUS 测试品种的指纹图谱构建中发现的谷子遗传多样性较高[19]。
基于20 个SSR 标记分析的春谷区与夏谷区区试品种的遗传相似性和聚类分析结果显示,春谷区22 份区试品种聚成三大类,其中C 组来自山西的品种聚在一起,说明该组品种的培育存在地域性,可能的原因是目前在育种过程中针对关键育种材料使用频率较高,尤其是对谷子种质资源中重点骨干亲本利用过于集中,造成在特定生态区域内新育成的谷子品种(品系)遗传背景较相似,遗传相似程度较高,遗传多样性降低[2]。针对夏谷区30 份区试品种的鉴定发现,不同地理来源的品种聚在一起,可能的原因是由于不同的育种单位之间存在的育种材料的交流与共享,说明在夏谷区的育种过程中对资源的利用程度与品种资源的交流比较频繁[15]。因此,在利用SSR 标记对谷子品种进行遗传多样性分析的同时,还需要更多方面的证据包括农艺性状方面的多态性鉴定,才能更清晰的了解所鉴定的谷子品种的遗传构成,也为谷子品种资源的利用提供支持[16,19-20]。
目前,利用SSR 指纹图谱对品种鉴定和分析的方法已经在谷子常规品种中研究与应用较多[13,21]。本研究首次将此方法用在谷子DUS 测试品种与区试品系分子鉴定中,发现利用16 个SSR 标记可将30 份谷子DUS 测试品种成功区分开,表明利用SSR 标记对谷子DUS 测试品种进行品种鉴定与遗传多样性分析是一种有效手段[22]。因而,本研究也为包括新育成品系在内的其他谷子分子指纹图谱的建立与品种的分子鉴定提供了借鉴。
本研究利用高质量的20 个SSR 标记对DUS测试品种进行指纹鉴定,平均每个标记检出的等位变异数为9.15 个,20 个位点的平均多态性信息含量(PIC)为0.77;同时,应用上述SSR 标记对来自春谷区与夏谷区的共计52 份谷子区试品种分别进行了分子鉴定,厘清了品系间的遗传相似性,为谷子品种资源利用与遗传改良奠定理论基础。
参考文献:
[1] 刁现民. 中国谷子产业与产业技术体系[M]. 北京:中国农业科学技术出版社,2011:21.
DIAO X M. Millet industry and industrial technology system inChina[M]. Beijing:China Agricultural Science and TechnologyPress,2011:21.
[2] AUSTIN D F. Fox-tail millets(Setaria:Poaceae)-abandonedfood in two hemispheres[J]. Economic Botany,2006,60(2):143-158.
[3] BARTON L,NEWSOME S D,CHEN F H,et al. Agriculturalorigins and the isotopic identity of domestication in NorthernChina[J]. Proceedings of the National Academy of Sciences ofthe United States of America,2009,106(14):5523-5528.
[4] 杨天育,牟平,孙万仓,等. 中国北部高原地区谷子品种遗传差异的SSR 分析[J]. 西北植物学报,2010,30(9):1786-1791.
YANG T Y,MOU P,SUN W C,et al. Genetic variation of fox?tail millet cultivars in north plateau region of China by SSRmarkers[J]. Acta Botanica Boreali-Occidentalia Sinica,2010,30(9):1786-1791.
[5] 田伯红. 谷子地方品种和育成品种的遗传多样性研究[J]. 植物遗传资源学报,2010,11(2):224-228.
TIAN B H. Genetic diversity of Landrace and improved culti?vars in foxtail millet[J]. Journal of Plant Genetic Resources,2010,11(2):224-228.
[6] 李志江,刁现民. 谷子分子标记与功能基因组研究进展[J]. 中国农业科技导报,2009,11(4):16-22.
LI Z J,DIAO X M. Research progress on molecular marker andfunctional genomic of foxtail millet,Setaria italica beauv[J]. Jour?nal of Agricultural Science and Technology,2009,11(4):16-22.
[7] JIA G Q,SHI S K,WANG C F,et al. Molecular diversity andpopulation structure of Chinese green foxtail(Setaria viridis(L.) Beauv.)revealed by microsatellite analysis[J]. Journal ofExperimental Botany,2013,64(12):3645-3656.
[8] WANG C F,CHEN J F,ZHI H,et al. Population genetics of fox?tail millet and its wild ancestor[J]. BMC Genetics,2010,11(1):90.
[9] WANG C F,JIA G Q,ZHI H,et al. Genetic diversity and popu?lation structure of Chinese foxtail millet(Setaria italica(L.)Beauv.)landraces[J]. G3,2012,2(7):769-777.
[10] JIA X P,SHI Y S,SONG Y C,et al. Development of ESTSSRin foxtail millet(Setaria italica)[J]. Genetic Resourcesand Crop Evolution,2007,54(2):233-236.
[11] 賈小平,谭贤杰,李永祥,等. 用SSR 标记研究谷子品种的遗传多样性[J]. 江西农业大学学报,2009,31(4):633-638.
JIA X P,TAN X J,LI Y X,et al. A study on the genetic diver?sity of foxtail millet cultivars by SSR markers[J]. Acta Agricul?turae Universitatis Jiangxiensis,2009,31(4):633-638.
[12] JIA X P,ZHANG Z B,LIU Y H,et al. Development and ge?netic mapping of SSR markers in foxtail millet(Setaria italica(L.) P. Beauv.)[J]. Theoretical and Applied Genetics,2009,118(4):821-829.
[13] 朱建楚. 基于PCR 标记的糜子遗传多样性分析[D]. 杨凌:西北农林科技大学,2005.ZHU J C. Genetic diversity analysis of broomcorn millet basedon PCR markers[D]. Yangling:Northwest A & F University,2005.
[14] YEH F C,YANG R C,BOYLE T,et al. POPGENE, ver?sion 1.32:the user friendly software for population geneticanalysis[CP]. Molecular Biology and Biotechnology Centre,University of Alberta,Edmonton,AB,Canada,1999.
[15] LIU K J,MUSE S V. PowerMarker:an integrated analysis en?vironment for genetic marker analysis[J]. Bioinformatics,2005,21(9):2128-2129.
[16] ROHLF F J. NTSYS-pc-numerical taxonomy and multivariateanalysis system[CP]. Exeter Software,Setauket,New York. 2000.
[17] 王姗姗,张宁,王凯玺,等. 中国辽西地区谷子品种遗传多样性的SSR 分析[J]. 分子植物育种,2015,13(5):1091-1097.
WANG S S,ZHANG N,WANG K X,et al. Genetic diversityof foxtail millet cultivars in western Liaoning Province revealedby SSR markers[J]. Molecular Plant Breeding,2015,13(5):1091-1097.
[18] 朱学海,张艳红,宋燕春,等. 基于SSR 标记的谷子遗传多样性研究[J]. 植物遗传资源学报,2010,11(6):698-702.
ZHU X H,ZHANG Y H,SONG Y C,et al. Genetic diversityanalysis of foxtail millet accessions revealed by SSR markers[J]. Journal of Plant Genetic Resources,2010,11(6):698-702.
[19] LE THIERRY D?ENNEQUIN M,PANAUD O,TOUPANCEB,et al. Assessment of genetic relationships between Setariaitalica and its wild relative S. viridis using AFLP markers[J].Theoretical and Applied Genetics,2000,100(7):1061-1066.
[20] LI W,ZHI H,WANG Y F,et al. Assessment of genetic rela?tionship of foxtail millet with its wild ancestor and close rela?tives by ISSR markers[J]. Journal of Integrative Agriculture,2012,11(4):556-566.
[21] 于淑婷,杨延兵,陈二影,等. 华北夏谷区近30 年来主要谷子育成品种农艺和品质性状演变分析[J]. 山东农业科学,2017,49(2):15-19.
YU S T,YANG Y B,CHEN E Y,et al. Evolution of agro?nomic and quality traits of main foxtail millet varieties in NorthChina bred in past thirty years[J]. Shandong Agricultural Sci?ences,2017,49(2):15-19.
[22] 董玉琛,曹永生. 粮食作物种质资源的品质特性及其利用[J].中国农业科学,2003,36(1):111-114.
DONG Y C,CAO Y S. Quality characteristics of germplasmresources of food crops and their utilization[J]. Scientia Agricul?tura Sinica,2003,36(1):111-114.

