莲草直胸跳甲短神经肽F 受体基因sNPFR的克隆及表达分析
王康 赵雪莹 霍楠 胡军 王苑馨 杨军 贾栋

摘要:为明确莲草直胸跳甲(Agasicles hygrophila)短神经肽F 受体AhsNPFR 功能及其表达特点,为探索莲草直胸跳甲生防作用奠定理论基础,利用PCR 技术克隆鉴定莲草直胸跳甲AhsNPFR 基因并进行生物信息学分析,通过实时荧光定量PCR 技术分析其在莲草直胸跳甲不同发育时期和组织中的时空表达谱。结果表明,克隆获得基因AhsNPFR 全长1 669 bp,开放阅读框1 257 bp,编码418 个氨基酸;预测其蛋白质分子质量为48.11 ku,理论等电点为8.21,AhsNPFR 具有7 个典型保守跨膜结构域,属于GPCRs 家族,系统进化树分析表明,其与玉米根萤叶甲Diabrotica virgifera virgifera sNPFR 亲缘关系最近。AhsNPFR 基因在不同发育阶段均有表达,在1 龄幼虫中的表达量最高,是卵中表达量的9.06 倍;在卵中表达量最低;雌成虫的表达量显著高于雄成虫。AhsN ?PFR 基因在不同组织中均有表达,在3 龄幼虫后肠中显著高表达,是脂肪体表达量的12.21 倍;在雌雄成虫后肠显著高表达,并在所有组织中均没有雌雄表达差异。
关键词:莲草直胸跳甲;短神经肽F 受体基因sNPFR;基因克隆;发育时期表达;组织表达
中图分类号:S476.2文献标识码:A 文章编号:1002?2481(2024)01?0137?08
神经肽是一类重要的信号分子,在昆虫的生长发育、繁殖和行为等多种生物学过程中发挥重要调节作用[1]。昆虫神经肽作为配体通过与同源的G 蛋白偶联受体(G protein-coupled receptors,GPCRs)相互作用介导其生物学功能[2]。短神经肽F(shortneuropeptide F,sNPF)是最初通过神经肽F(neuro?peptide F,NPF)C 末端抗体在马铃薯甲虫Leptino?tarsa decemlineata 和沙漠蝗虫Schistocerca gregaria中鉴定得到的一类NPF 短肽[3-4],这些NPF 短肽仅由8~10 个氨基酸组成,而不是无脊椎动物NPF 典型的36~40 个氨基酸[5],基于其羧基末端的RLRF酰胺序列类似于无脊椎动物的NPF 的RPRF 基序[6],因此,命名为sNPF。
与大多数神经肽信号系统相同,sNPF 也是通过激活其特异性短神经肽F 受体(short neuropep?tide F receptor,sNPFR),进而引发细胞信号传导机制发挥系列功能[7]。sNPFR 首次在黑腹果蝇中发现[8],随后在红火蚁Solenopsis invicta 和冈比亚按蚊Anopheles gambiae 中相继克隆出来[9-10]。sNPF 信号系统在昆虫的昼夜节律[11]、生长发育[12]、寄主定位[13-14]、取食等生理过程中发挥重要作用,尤其在昆虫取食中的调控作用引起相关研究者的广泛关注。在黑腹果蝇Drosophila melanogaster 中,DmsNPF及其受体DmsNPFR 的表达能促进取食量增加及体型增大,相反RNA 干扰二者的功能后果蝇的取食量减少且体型变小[15-16]。华山松大小蠹Dendrocto?nus armandi 中敲除DasNPF 及其受体DasNPFR后,幼虫和雌雄成虫的取食量均减少[17]。与上述昆虫相反,在沙漠飞蝗S. gregaria 中,SgsNPF 及其受体SgsNPFR 的敲除反而会导致取食量增加[18-19]。大量研究表明,昆虫头部和肠道是sNPFR 的主要表达部位,但在其他组织部位如中枢神经系统(cen?tral nervous system,CNS)、触角、脂肪体、马氏管等也都有表达[10,17,20],关于sNPFR 的表达部位目前还没有明确结论。
莲草直胸跳甲Agasicles hygrophila 是世界恶性杂草喜旱莲子草Alternanthera philoxeroides 的专食性天敌昆虫[21-23]。本研究拟基于神经肽sNPF信号系统与昆虫的寄主定位及取食密切相关的特性,克隆鉴定莲草直胸跳甲sNPF 信号系统的sNPFR 基因,检测其在不同发育阶段及组织的表达模式,旨在为后续深入研究莲草直胸跳甲专一性定位寄主与取食的分子调控机制提供理论基础。
1材料和方法
1.1 試验材料
供试莲草直胸跳甲采自华南农业大学,后饲养于山西农业大学生物安全与生物防治实验室养虫室。饲养条件为:温度(25±1)℃ ,相对湿度为85%±5%,光周期14L∶10D。幼虫饲养于玻璃培养皿(直径15 cm,高2.5 cm),成虫饲养于养虫罐(直径12 cm,高17 cm)。
喜旱莲子草采自浙江省玉环县,现种植于太谷区山西农业大学生物安全与生物防治基地。
1.2 试验方法
1.2.1 昆虫样品收集
基因克隆样品为莲草直胸跳甲不同发育阶段的混合样本。各发育阶段的取样分别为:1 日龄卵,1 日龄的1、2、3 龄幼虫,1 日龄蛹和雌雄成虫。其中,3 龄幼虫组织的取样为:头、前肠、中肠、后肠、马氏管、脂肪体;雌雄成虫取样为:触角、头、前肠、中肠、后肠、马氏管、脂肪体。以上样本均3 次生物学重复,液氮速冻,-80 ℃冰箱保存备用。
1.2.2 RNA 的提取与cDNA 合成
总RNA 使用Trizol 试剂(TaKaRa,大连)提取,通过超微量蛋白核酸分析仪(BioDrop,Cambridge,UK)测定浓度,1% 琼脂糖凝胶电泳检测质量。以1 μg RNA 为模板,采用HiScript? Ⅲ 1stStrand cDNA Synthesis Kit(+gDNA wiper)试剂盒(Vazyme,南京)的步骤合成cDNA 第1 链,-20 ℃备用。
1.2.3 AhsNPFR 的克隆鉴定与序列分析
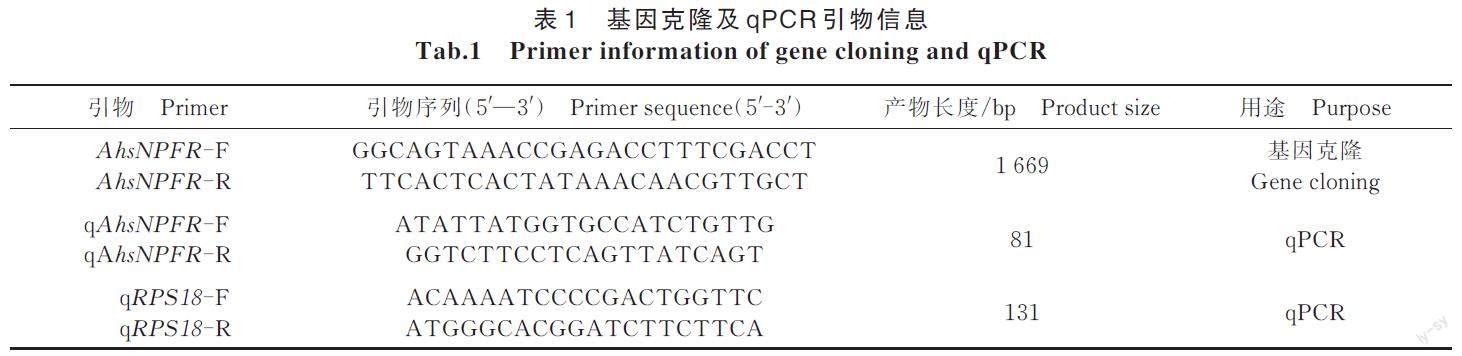
基于课题组的莲草直胸跳甲转录组数据[24],利用Primer5.0 设计目的基因的扩增引物(表1),以1.2.2 合成cDNA 为模板,利用Phanta? Max Super-FidelityDNA Polymerase 试剂盒(Vazyme,南京)进行PCR扩增。PCR 反应体系为:2×Phanta Max Buffer10 μL,引物AhsNPFR-F/AhsNPFR-R 各0.8 μL,1 ? cDNA 1 μL,Phanta MAX Super-Fidelity DNApolymerase 0.5 μL,dNTP Mix 0.4 μL,加ddH2O 至20 μL。PCR反应条件为:95 ℃预变性3 min;95 ℃变性15 s,48 ℃退火15 s,72 ℃延伸2 min,35 个循环;彻底延伸5 min。PCR 产物用1% 琼脂糖凝胶电泳检测,通过M5 Gel Extraction Kit(Mei5bio,Beijing,China)进行回收,连接于pEASY?-Blunt3 CloningVector(Trans Gen Biotech,北京),转入TOP10 感受态细胞(ANGYUBIO,上海),菌液送上海生工生物工程有限公司测序。
利用NCBI ORF(Open Reading Frame)(https://www.ncbi.nlm.nih.gov/orffinder)预测AhsNPFR 基因的开放阅读框,DNAMAN 进行多序列比对,ExPASy-ProtParam(http://web. expasy. org/prot?param/)预测等电点及蛋白质分子量大小,DeepT?MHMM(https://dtu. biolib. com/DeepTMHMM)预测跨膜结构域,InterPro(https://www.ebi.ac.uk/interpro/search/sequence/)预测保守结构域与蛋白家族。通过MEGA 7.0 采用邻接法构建系统发育树,重复1 000 次。
1.2.4 AhsNPFR 基因的表达模式分析
以1.2.2合成cDNA 为qPCR 模板,通过BeaconDesign 7.0设计AhsNPFR 特异性引物,以18S 核糖体蛋白(RPS18)[25]作为不同发育阶段和不同组织处理的内参基因进行实时荧光定量PCR(表1)。qPCR 所使用的仪器为ABI7500(Applied Biosystems,Fos?ter City,CA,USA)。反应体系为:2?ChamQ Uni?versal SYBR qPCR Master Mix 10 μL,上下游引物各0.8 μL,10 ? cDNA 1 μL,加ddH2O 至20 μL。qPCR 反应条件为:95 ℃ 预变性3 min;95 ℃ 变性10 s,55 ℃退火30 s,72 ℃延伸30 s,40 个循环。不同发育阶段和各组织样品分别设置3 次生物学重复和3 次技术重复。
1.3 数据分析
qPCR 相对表达量数据采用2-ΔΔCt[26]法进行分析,使用SPSS 26.0 软件进行单因素方差分析(one-way ANOVA),Tukey?s HSD 进行多重比较差异分析,差异显著性标准为P<0.05。所得结果采用平均值± 标准误表示,柱状图均由GraphPadPrism 8 绘制。
2结果与分析
2.1 AhsNPFR 基因克隆鉴定
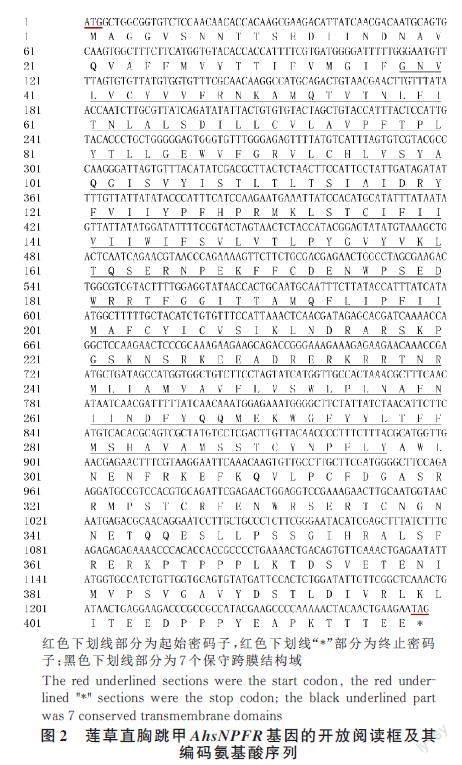
克隆获得了1 个短神经肽受体基因,产物经1% 琼脂糖凝胶电泳检测,得到与预期长度一致的目的片段(图1),其开放阅读框ORF 长1 257 bp,编码418 个氨基酸(图2),命名为AhsNPFR(Gen?Bank 登录号为OQ550102)。
2.2 序列与系统发育分析
莲草直胸跳甲AhsNPFR 蛋白质分子质量为48.11 ku,等电点(pI)为8.21;结构域预测显示,在38—297 位氨基酸残基之间具有GPCRs 家族的保守结构域,属于GPCRs 家族;多序列比对结果(图3)显示,莲草直胸跳甲AhsNPFR 氨基酸序列与其他5 种鞘翅目昆虫的sNPFR 序列相似性最高,为72.15%~87.22%,其中,与玉米根萤叶甲Di?abrotica virgifera virgifera 相似性最高(87.22%),与鳞翅目昆虫家蚕Bombyx mori 相似性次之(52.34%),与双翅目昆虫黑腹果蝇D. melanogaster相似性最低(38.83%)。根据与其他昆虫sNPFR共有的7 个典型保守跨膜结构域,克隆序列应该为AhsNPFR 基因。
将莲草直胸跳甲sNPFR 氨基酸序列与鞘翅目、鳞翅目、双翅目和半翅目等其他26 种昆虫进行多序列比对,构建系统发育树,结果如图4 所示,莲草直胸跳甲AhsNPFR 与其他鞘翅目昆虫聚为一支;其中与玉米根萤叶甲DvsNPFR、光肩星天牛AgsNPFR 和马铃薯甲虫LdsNPFR 亲缘关系较近;其他目昆虫也能分别聚类,符合分类学关系。
2.3 AhsNPFR 基因在莲草直胸跳甲不同发育阶段的表达模式
通过qPCR 分析了AhsNPFR 基因在莲草直胸跳甲不同發育阶段内的表达水平。结果表明,AhsNPFR 基因在莲草直胸跳甲各发育阶段均有表达,其中幼虫期(1~3 龄幼虫)和成虫期(雌雄成虫)的表达量均显著高于卵期和蛹期(P<0.05),1、3 龄幼虫表达量显著高于2 龄幼虫,雌成虫表达量显著高于雄成虫(P<0.05)。AhsNPFR 在1~3 龄幼虫、蛹、雌、雄成虫的相对表达量分别是卵期AhsNPFR表达量的9.05 倍、6.16 倍、8.03 倍、3.20 倍、8.84 倍和5.55 倍(图5)。
2.4 AhsNPFR 基因在莲草直胸跳甲不同组织的表达模式
通过qPCR 分析了AhsNPFR 基因在莲草直胸跳甲3 龄幼虫不同组织的表达水平,结果表明(图6),AhsNPFR 基因在3 龄幼虫各组织均有表达,其中后肠的表达量最高,显著高于其他组织,是脂肪体表达量的12.21 倍(P<0.05);在头、前肠、中肠和马氏管的表达量间没有显著差异(P>0.05);在脂肪体的表达量最低。
通过qPCR 分析了AhsNPFR 基因在莲草直胸跳甲雌雄成虫不同组织的表达水平,结果表明(图7),AhsNPFR 基因在莲草直胸跳甲雌雄成虫各个组织均有表达,且表达模式相似,后肠的表达量均显著高于其他组织(P<0.05);触角、头、前肠、中肠、马氏管、脂肪体的表达量没有显著差异,雌雄成虫相同组织中表达量差异不显著(P>0.05)。
3结论与讨论
本研究克隆了莲草直胸跳甲sNPFR 基因全长序列,其开放阅读框编码418 个氨基酸残基,具有GPCRs 家族的保守结构域。目前,已鉴定的节肢动物短神经肽受体sNPFR 均属于GPCRs 家族[18],主要典型特征为含有7 个跨膜结构域。本研究结果显示,莲草直胸跳甲AhsNPFR 也含有7 个跨膜结构域,并且与其它昆虫sNPFR 的保守结构域高度保守。系统发育分析也表明该基因可用于物种的进化关系研究。
莲草直胸跳甲AhsNPFR 基因在幼虫和成虫期的表达量显著高于卵和蛹期,1 龄幼虫表达量最高。有研究表明,在豌豆蚜Acyrthosiphon pisum 中,ApsNPFR 在若虫和成虫中都有表达,且1 龄若虫表达量最高,敲除ApsNPFR 后,刺探电位图谱(EPG)结果显示,豌豆蚜A. pisum 刺吸植物的次数和刺吸时间显著减少[27]。在黑腹果蝇中,DmsNPFR的过表达导致取食量增加[16]。由此可见,sNPFR 在调控昆虫取食中发挥重要功能作用,莲草直胸跳甲是喜旱莲子草的专食性天敌昆虫,我们推测,AhsNPFR 也可能与莲草直胸跳甲取食密切相关,但其功能还需后续基因干扰及行为试验验证。另外发现,莲草直胸跳甲雌成虫AhsNPFR 表达量显著高于雄成虫,相关结果在其它文献未见报道,推测可能为莲草直胸跳甲雌成虫取食量高于雄成虫的重要分子基础。
AhsNPFR 基因在莲草直胸跳甲3 龄幼虫和雌雄成虫后肠中显著高表达。有研究表明,在华山松大小蠹D. armandi 中,DasNPFR 基因在头和中肠组织中显著高表达,功能验证表明其主要与取食相关[17]。在橘小实蝇Bactrocera dorsalis 中,BdsN ?PFR 在触角和中枢神经系统显著高表达,通过CRISPR/Cas9 敲除BdsNPFR,发现该虫定位寄主能力变弱;EAG 反应中,对3 种气味物质的电生理反应均显著降低[28]。家蚕B. mori sNPF 的3 个同源受体(BNGR-A7、BNGR-A10 和BNGR?A11)在不同组织中表达模式不同,其中BNGR?A7 仅在成虫头部高表达,BNGR?A10 在幼虫和蛹的马氏管中高表达,而在成虫马氏管中表达量较低,BNGRA11在幼虫和成虫的马氏管、中肠和精巢中表达量较高,而在蛹期的卵巢中相对表达量较高[20]。由此可见,短神经肽受体sNPFR 在不同昆蟲的调控模式可能不同。本研究中检测了AhsNPFR 基因在莲草直胸跳甲触角、头、前肠、中肠、后肠、马氏管和脂肪体的表达情况,但仍有不足。有文献报道,sN ?PFR 在昆虫中枢神经系统中显著高表达[27],由于技术原因,没有检测AhsNPFR 在中枢神经系统CNS中的表达情况。
本研究克隆鉴定了莲草直胸跳甲AhsNPFR 基因,明确了AhsNPFR 基因在莲草直胸跳甲不同发育时期和不同组织的表达模式,为进一步解析短神经肽受体AhsNPFR 调控莲草直胸跳甲的取食调控机制奠定依据,也为莲草直胸跳甲生防世界恶性杂草喜旱莲子草提供一些新的思路。
参考文献:
[1] ALTSTEIN M,N?SSEL D R. Neuropeptide signaling in in?sects[J]. Advances in Experimental Medicine and Biology,2010,692:155-165.
[2] HEWES R S,TAGHERT P H. Neuropeptides and neuropep?tide receptors in the Drosophila melanogaster genome[J]. Ge?nome Research,2001,11(6):1126-1142.
[3] SPITTAELS K,VERHAERT P,SHAW C,et al. Insect neu?ropeptide F(NPF)-related peptides:isolation from Colorado po?tato beetle(Leptinotarsa decemlineata) brain[J]. Insect Biochem?istry and Molecular Biology,1996,26(4):375-382.
[4] SCHOOFS L,CLYNEN E,CERSTIAENS A,et al. Newlydiscovered functions for some myotropic neuropeptides in locusts[J]. Peptides,2001,22(2):219-227.
[5] N?SSEL D R,WEGENER C. A comparative review of shortand long neuropeptide F signaling in invertebrates:any similari?ties to vertebrate neuropeptide Y signaling? [J]. Peptides,2011,32(6):1335-1355.
[6] MAULE A G,SHAW C,HALTON D W,et al. NeuropeptideF(Moniezia expansa):localization and characterization usingspecific antisera[J]. Parasitology,1992,105( Pt 3):505-512.
[7] 栗洪飞. 短神经肽F 受体(sNPFR)参与调控桔小实蝇觅食和取食行为[D]. 重庆:西南大学,2022.
LI HF. The short neuropeptide F receptor(sNPFR)involved inregulating foraging and feeding behaviors in the oriental fruit flyBactrocera dorsalis(Hendel)[D]. Chongqing:Southwest Univer?sity,2022.
[8] MERTENS I,MEEUSEN T,HUYBRECHTS R,et al. Char?acterization of the short neuropeptide F receptor from Dro?sophila melanogaster[J]. Biochemical and Biophysical ResearchCommunications,2002,297(5):1140-1148.
[9] GARCZYNSKI S F,CRIM J W,BROWN M R. Characteriza?tion and expression of the short neuropeptide F receptor in theAfrican malaria mosquito,Anopheles gambiae[J]. Peptides,2007,28(1):109-118.
[10] CHEN M E,PIETRANTONIO P V. The short neuropeptideF-like receptor from the red imported fire ant,Solenopsis in?victa Buren(Hymenoptera:Formicidae)[J]. Archives of InsectBiochemistry and Physiology,2006,61(4):195-208.
[11] JOHARD H A D,YOISHII T,DIRCKSEN H,et al. Peptider?gic clock neurons in Drosophila:ion transport peptide and shortneuropeptide F in subsets of dorsal and ventral lateral neurons[J]. The Journal of Comparative Neurology,2009,516(1):59-73.
[12] 李梅梅. 黏虫种群遗传结构与神经肽F 及其受体基因功能研究[D]. 杨凌:西北农林科技大学,2022.
LI M M. Study on genetic structure and neuropeptide F and itsreceptor gene function of armyworm population[D]. Yangling:Northwest A & F University,2022.
[13] JIANG H B,GUI S H,XU L,et al. The short neuropeptide Fmodulates olfactory sensitivity of Bactrocera dorsalis upon star?vation[J]. Journal of Insect Physiology,2017,99:78-85.
[14] ROOT C M,KO K I,JAFARI A,et al. Presynaptic facilita?tion by neuropeptide signaling mediates odor-driven food search[J]. Cell,2011,145(1):133-144.
[15] LEE K S,YOU K H,CHOO J K,et al. Drosophila short neu?ropeptide F regulates food intake and body size[J]. Journal ofBiological Chemistry,2004,279(49):50781-50789.
[16] LEE K S,KWON O Y,LEE J H,et al. Drosophila short neu?ropeptide F signalling regulates growth by ERK-mediated insu?lin signalling[J]. Nature Cell Biology,2008,10:468-475.
[17] LIU B,FU D Y,NING H,et al. Identification of the short neu?ropeptide F and short neuropeptide F receptor genes and theirroles of food intake in Dendroctonus armandi[J]. Insects,2021,12(9):844.
[18] DILLEN S,ZELS S,VERLINDEN H,et al. Functional char?acterization of the short neuropeptide F receptor in the desertlocust,Schistocerca gregaria[J]. PLoS One,2013,8(1):e53604.
[19] DILLEN S,VERDONCK R,ZELS S,et al. Identification ofthe short neuropeptide F precursor in the desert locust:evi?dence for an inhibitory role of sNPF in the control of feeding[J].Peptides,2014,53:134-139.
[20] MA Q,CAO Z,YU Y N,et al. Bombyx neuropeptide Gprotein-coupled receptor A7 is the third cognate receptor forshort neuropeptide F from silkworm[J]. The Journal of Biologi?cal Chemistry,2017,292(50):20599-20612.
[21] 賈栋,赵龙龙,王森,等. 莲草直胸跳甲Hsp70 蛋白的生物信息学分析[J]. 山西农业科学,2015,43(4):397-400.
JIA D,ZHAO L L,WANG S,et al. Bioinformatic analysis ofAgasicles hygrophila Hsp70[J]. Journal of Shanxi AgriculturalSciences,2015,43(4):397-400.
[22] 马瑞燕. 空心莲子草天敌:莲草直胸跳甲引进中国后的生态适应性研究[D]. 北京:中国农业科学院,2001.
MA R Y. Ecological adaptation of the introduced biocontrolagent,Agasicles hygrophila,for alligatorweed,Alternantheraphiloxeroides,in china[D]. Beijing:Chinese Academy of Agri?cultural Sciences,2001.
[23] 余国梁,李政,李健,等. 喜旱莲子草生物防治研究进展[J]. 湖南生态科学学报,2020,7(4):62-67.
YU G L,LI Z,LI J,et al. Research progress on biological con?trol of Alternanthera philoxeroides[J]. Journal of Hunan Eco?logical Science,2020,7(4):62-67.
[24] JIA D,WANG Y X,LIU Y H,et al. SMRT sequencing offull-length transcriptome of flea beetle Agasicles hygrophila(Selman and Vogt)[J]. Scientific Reports,2018,8:2197.
[25] 贾栋,纪周瑜,刘艳红,等. 莲草直胸跳甲不同发育阶段内参基因的筛选与验证[J]. 山西农业大学学报(自然科学版),2020,40(4):53-58.
JIA D,JI Z Y,LIU Y H,et al. Screening and validation of in?ternalreference genes in different developmentalstages of Agas?icles hygrophila[J]. Journal of Shanxi Agricultural University(Natural Science Edition),2020,40(4):53-58.
[26] LIVAK K J,SCHMITTGEN T D. Analysis of relative geneexpression data using real-time quantitative PCR and the2?ΔΔCT method[J]. Methods,2001,25(4):402-408.
[27] AMIR M B,SHI Y,CAO H H,et al. Short neuropeptide Fand its receptor regulate feeding behavior in pea aphid(Acyrtho?siphon pisum)[J]. Insects,2022,13(3):282.
[28] LI H F,HUANG X Y,YANG Y H,et al. The short neuropep?tide F receptor regulates olfaction-mediated foraging behaviorin the oriental fruit fly Bactrocera dorsalis(Hendel)[J]. InsectBiochemistry and Molecular Biology,2022,140:103697.

