植物耐受高温胁迫的分子机制研究进展
江珊,吴龙英,赵宝生,黄佳惠,蒋宇喆,焦元,黄进
(成都理工大学生态环境学院,成都 610000)
0 引言
随着人类活动的加剧,温室气体的排放量显著增加,导致全球地表气温不断上升。研究数据显示,2011至2020 年,全球地表平均温度比1850 至1900 年期间升高了1.09℃(范围在0.95~1.2℃之间),相较于2003至2012 年,则上升了约0.1℃(范围在0.16~0.22 之间)。据估计,未来20 年全球温度的上升幅度将达到或超过1.5℃[1]。持续高温对植物的正常生理活动产生了显著的影响,不仅影响到植物的生长、发育,甚至可能威胁到它们的生存。以光合作用为例,该过程在高温条件受到明显的抑制,植物为了适应高温,其蒸腾作用和呼吸被迫增强。但如果植物长期处于这种不利环境,当呼吸作用导致的能量消耗量超过了光合作用能量的积累,植物的生长明显受阻,严重时甚至威胁到植物的生存[2]。高温条件下植物光合效率的下降主要是是由于植物叶片中的叶绿素含量的减少及包括酶在内蛋白质分解速度的加快[3]。而蛋白质的加速分解,不仅会造成相关酶活性的不足,蛋白质分解所产生的过量的氨也可造成对细胞的毒害,进而进一步损害植物的正常生理和生化活动。
在农业生产实践中,高温胁迫对作物的产量以及品质的影响尤为显著。以水稻为例,高温胁迫已被证实可导致稻米产量的显著下降。研究表明,在水稻的孕穗期的高温胁迫可导致水稻的结实率下降15%左右[4]。在水稻开花期,特别是开花当天的高温天气可明显影响植物受精,导致花粉败育[5]。此外,如水稻在灌浆期遭受高温胁迫,其光合速率和同化产物积累也会受到严重影响,由于秕谷粒增多和粒重下降,进而导致水稻减产严重[6]。从品质角度来看,高温环境还可能导致水稻垩白粒率上升和垩白面积增大,并改变支链淀粉的精细结构,致使稻米品质显著下降[7]。因此,探索植物应对高温胁迫的机制,对指导农作物品种的选育及建立科学的田间管理制度均具有重要的意义。
1 高温胁迫对植物的影响
由于植物无法像动物一样通过迁移来应对环境胁迫,其代谢以及生长发育等生理生化过程极易对周边环境的影响极其敏感。根据胁迫来源,可将胁迫划分为生物胁迫和非生物胁迫。高温胁迫是指由于环境温度高于植物生长的适宜温度范围,从而对植物产生不利影响的一种非生物胁迫[8]。大多数植物可适应的最高温度一般不超过35℃,一旦超出,植物即面临高温胁迫[8]。而根据持续时间的不同,高温胁迫被可分为长期(几天或几个星期)和短期(几分钟或几个小时)两种形式,无论是长期还是短期的高温胁迫均可影响植物的形态、光合作用、呼吸作用等,进而影响植物的生理状态和生长(图1)[9]。
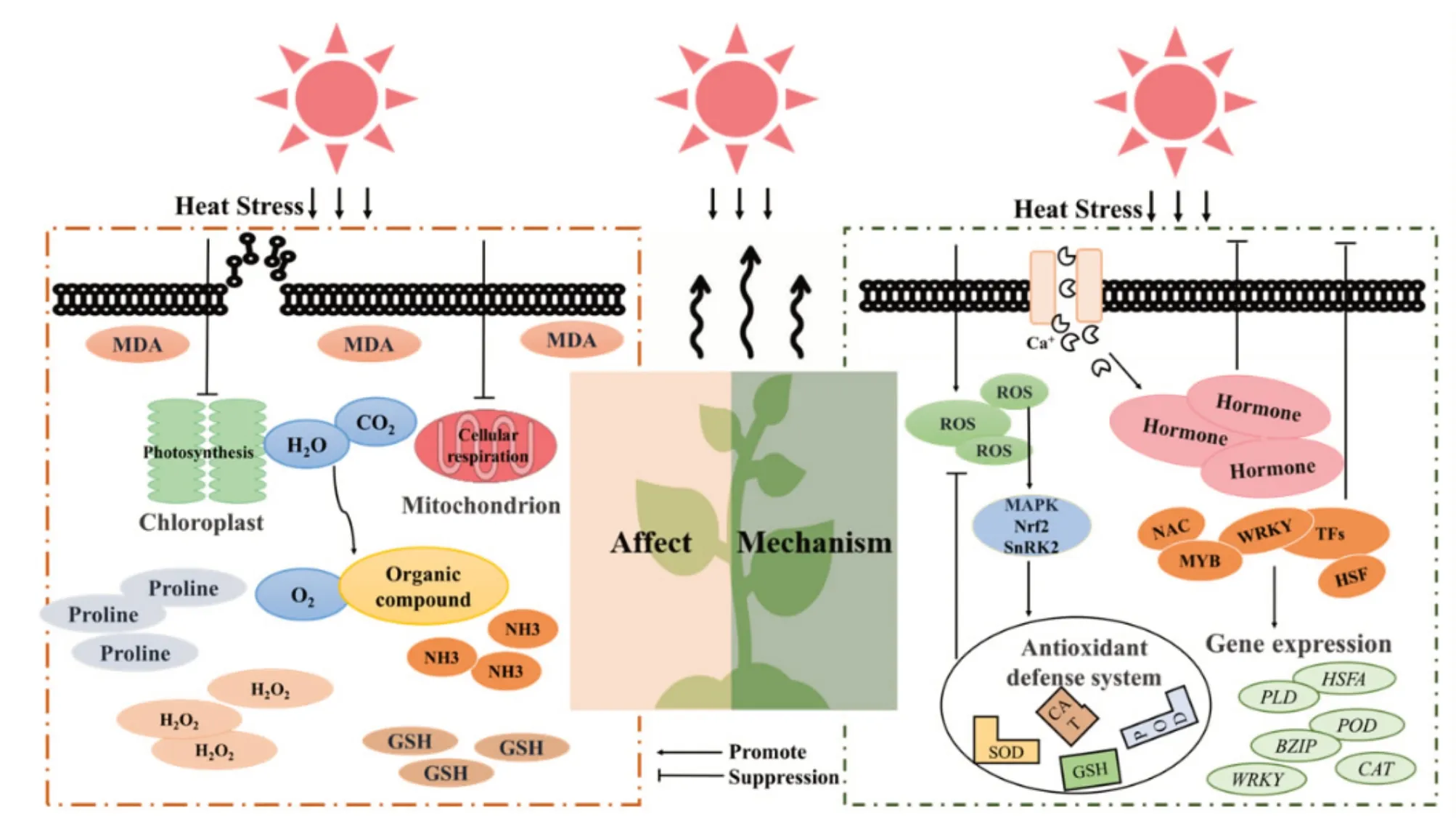
图1 高温胁迫对植物的影响及植物应对高温胁迫的分子机制
1.1 高温胁迫对植物形态的影响
维持正常的形态特征是植物确保发育以及产量的重要前提,然而高温可造成植物种子萌发率降低,并对幼苗期植物胚根和胚芽的生长和发育造成不利影响[10-11]。而在生长期和繁殖期,持续的高温胁迫可造成花期及成熟期植物结实器官败育[12-13]、雌雄配子体畸形、果实畸形以及粒径减小等,从而导致作物产量和品质的显著下降[14-15]。此外,虽然生物节律调控机制在植物应答非生物胁迫过程中发挥着重要的作用,但其在植物应对高温胁迫中的具体作用仍有待研究[16]。
1.2 高温胁迫对植物生理生化特性的影响
植物通过调整体内的代谢产物含量或者酶活性以应对外界胁迫,因此胁迫相关代谢物含量及酶活性常作为衡量植物应对逆境胁迫能力的关键指标。这些代谢物主要包括脯氨酸(Proline,Pro)、丙二醛(Malondialdehyde,MDA)、谷胱甘肽(Glutathione,GSH)、过氧化氢(Hydrogen peroxide,H2O2),而相关的酶主要是抗氧化酶[17-18]。在高温胁迫下,这些生理、生化参数的变化表现为Pro、MDA 及GSH 含量的上升、过氧化物含量的升高及抗氧化酶活性的加强。脯氨酸不仅是高效的渗透压调节剂,其在着螯合重金属、抵抗过氧化物损伤以及传递信号等过程中发挥作用[19]。在高温条件下,植物体内的脯氨酸合成途径(谷氨酸途径和鸟氨酸途径)被激活,同时脯氨酸合成酶的水解反应则受到抑制,导致脯氨酸在植物体内的累积。MDA是膜脂质过氧化的指示性产物,其含量提升表明高温胁迫下细胞膜的损伤程度[20-21]。还原型GSH则是细胞内重要的抗氧化剂,可以保护植物细胞免受氧化损伤,以提高植物对高温胁的耐受能力[22]。此外,在高温胁迫下,由于植物叶绿体和线粒体机能受到抑制,过氧化氢(H2O2)、超氧自由基(Superoxide radical,O2-)以及羟基自由基(Hydroxyl radical,-OH)等物质快速生成和积累,同时超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Fungal catalase,CAT)和谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)等酶的活性也会相应增强,以防止这些活性氧物质对植物造成进一步的伤害[23]。
1.3 高温胁迫对植物呼吸作用的影响
植物的呼吸作用涉及氧气、葡萄糖以及淀粉等有机物质的氧化分解,在这个过程中释放出能量以维持生物体的正常生命活动,这一过程依赖于多种酶的参与。短时间的高温胁迫可刺激植物的呼吸过程,促进有益物质的合成以及加快蛋白质的运输周转,同时清除或降解高温下植物体内累积的各类有害物质[24]。反之,长时间的高温胁迫则可能导致植物体内的营养物质的过度消耗,减弱与呼吸相关酶的活性甚至导致其失活,从而抑制呼吸作用,影响植物的生长发育和高温适应能力。此外,高温胁迫亦可造成植物中核酮糖二磷羟化酶或加氧酶同化活性的降低,即光呼吸增强。尽管光呼吸是植物应对高温胁迫的重要方式之一,但是长时间的光呼吸作用及该过程中产生的氨会对植物造成不良的影响[25]。
1.4 高温胁迫对植物光合作用的影响
高温不但影响植物的呼吸过程,还显著影响其光合作用,而光合作用也是植物中最易受到高温影响的代谢过程[26]。短期高温胁迫主要导致气孔限制引起的光合速率降低,而长时间的高温胁迫造成的光合速率降低则由非气孔限制相关原因导致[27]。研究表明,核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco ribulose-1,5-bishosphate carboxylase,Rubisco)失活以及光系统PSⅡ结构改变是长期高温下非气孔限制导致光合效率降低的主要原因[28-30]。同时,在高温的胁迫下,植物叶绿体内超氧化物歧化酶的活性受到抑制,从而造成叶绿体结构如负责光化学反应的类囊体受损[31-32]。
在植物的生命活动中,高温胁迫也可能触发包括植物内源性激素、水分代谢、细胞膜热稳定性等水平的变化,以提高植物对环境的适应能力[33]。因此,高温胁迫下各种生理生化参数的变化反映了植物就应对高温胁迫的不同策略,而潜在的分子机制依然是当前科学研究的热点。
2 植物应对高温胁迫的分子机制
为了适应高温环境,植物自身也进化出了复杂且多样的防御机制。而这些分子机制涉及复杂的分子调控网络,包括信号传导途径、转录因子的调节功能以及抗逆相关基因的表达[34-35]。
2.1 信号传导途径
在面对高温胁迫时,细胞膜是最先感应温度的变化的细胞结构,它通过产生高浓度的Ca2+发起信号传导[36]。Ca2+是细胞内重要的第二信使,负责将胁迫信息传递至下游分子及信号通路,以激活植物的胁迫应答机制[37]。研究发现,通过抑制Ca2+信号转导途径中钙调蛋白(Calmodulin,CaM),可调控钙调素结合转录因子(Calmodulin-binding transcription factor,CAMTA)的转录活性,进而提高植物的高温耐受能力。但是我们该过程中所涉及的分子机制仍然了解有限[38]。遭受高温胁迫导致活性氧(Reactive oxygen species,ROS)在细胞内大量积累,植物借助氧化信号传导途径,如丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPK)、Nrf2 (Nuclear factor erythroid 2-related factor 2)、SnRK2 (SNF1-related protein kinase 2)等抗氧化防御机制,以激活抗氧化酶活性[39-40]。植物体内相关抗氧化酶活包括SOD、CAT、GSH- Px、过氧化物酶(Peroxidase,POD)等。这些酶通过清除过量的ROS帮助植物适应高温环境[41-43]。
此外,激素信号传导途径也是植物响应胁迫的关键机制之一。在高温条件下,通过积累激素,植物能够激活特定的信号途径,以此来调节生长发育并提升自身的温度适应能力[44]。植物激素如脱落酸、褪黑素、赤霉素、细胞分裂素等植物激素都可以通过诱导抗性转录因子和基因表达,改善高温胁迫下植株的高温耐受能力[45-46]。研究表明,外源性褪黑激素可提高植物抗氧化剂的含量和抗氧化酶的活性,减少幼苗的高温受损情况[47-48]。而赤霉素对高温胁迫下植物的花药育性、赤霉素含量及代谢相关基因的表达均有显著影响[49]。植物在高温胁迫下积累的细胞分裂素,如玉米素(Zeatin,ZT)、激动素(Kinetin,KT)、6- 苄基氨基嘌呤(6-Benzylaminopurine,6-BA)等,可保证细胞有序的分裂与分化过,并增强植物的光合作用[50]。有观点认为,植物激素主要通过抑制超氧阴离子(Superoxide anion,O2-)的产生及增强SOD的活性降低O2-过量积累而引起的细胞膜和DNA损伤,从而抑制高温胁迫下植物细胞凋亡的发生[51]。虽然植物激素在植物应对高温胁迫过程中发挥重要作用这一观点已被普遍接受,但由于研究过程中使用的植物种类以及处理条件的差异,关于植物激素的具体作用及相关机制,不同的研究往往得出不同的结论。因此,对于激素在植物应对高温胁迫过程中的作用仍有等进一步的阐明[52]。
2.2 转录因子的调控作用
为了适应高温环境,植物启动特定功能蛋白的合成,这些由高温诱导的蛋白质被称为热激蛋白(Heatstimulated protein,HSPs)。HSPs 主要存在于叶绿体、线粒体和内质网等细胞器中,并在蛋白质的折叠、组装、转运和降解过程中发挥重要作用[53]。高温胁迫会影响植物细胞膜的流动性并破坏蛋白质的稳态,而HSPs 通过帮助细胞中蛋白质正确地折叠及空间结构的形成。因此,HSPs通过维持转录因子和相关酶的活性和功能,确保应激信号通路的启动及相关基因的表达,以保护植物免受胁迫危害[54-56]。有研究表明,MYB、AP2、ERFBP、NAC 和WRKY 等转录因子是植物在应对非生物胁迫过程中的关键调控因子[57-58]。此外,热激转录因子(Heat-stimulated transcription factor,HSFs)通过结合下游HSP 基因上游热激反应元件(Thermal response element,HSE),以转录激活相关HSP基因的机制也被认为是应对植物高温胁迫的重要分子机制之一[59-60]。例如,在拟南芥中,热转录因子基因AtHSFA1a和AtHSFA1b在植物处于高温胁迫初期即被激活,是调控热激蛋白表达的重要转录因子。在AtHSFA1a/AtHSFA1b双突变植物中,受限的HSP 活性导致突变体对高温胁迫更为敏感。相反,在拟南芥和烟草中过量表达AtHSFA1a则可显著提高植物的耐高温能力[61]。此外,HSF 通过调节氧化应激相关基因的表达、降低ROS水平及提高脯氨酸含量等途径增强植物对高温胁迫的适应性[62]。除HSF之外的其他转录因子也参与了植物耐受高温胁迫的相关机制,例如辣椒、小麦以及拟南芥的WRKY 均被证实参与植物对高温胁迫的响应[63-65]。
2.3 高温响应相关基因的表达变化
在植物应对高温胁迫的整体机制中,除了以MYB、NAC和WRKY转录因子家族的基因外,其他可响应高温基因表达的变化同样是该机制的关键的组成部分[42,66]。高温响应相关基因是指在高温环境下表达量发生变化的基因,包括负责激素合成调控的基因、抗氧化酶活相关基因以及细胞壁合成相关基因等[67]。例如,在水稻中敲除磷脂酰胆碱水解酶D 基因(PhosphatidylcholinehydrolaseDgene,PLD)可显著降低水稻的垩白粒率以及水稻对高温的耐受能力。但是目前对于植物中参与高温胁迫应对信号通路的基因其功能及作用机制的研究仍然非常有限。
3 展望
随着全球气候变化的影响日益加剧,尤其是“温室效应”引起的持续升温,作物耐热性已成为决定其生长发育、品质和产量的关键因素[68]。因此,如何提高作物对包括高温在内不利环境的耐受能力成为农业生产中亟待解决的问题。此外,植物对高温胁迫适应机制的相关研究对于干热、干旱河谷区的植被恢复等生态修复工作也具有重要的指导意义。
抗高温相关遗传和种质资源的发掘及具有抗高温潜力植物、作物品种的选育,已成为应对植物高温逆境危害的关键途径。随着生物技术特别是生物信息学、基因工程、细胞生物学、分子生物学等领域的飞速发展,研究人员在揭示植物耐高温相关分子机制方面取得诸多突破。比如,有研究从转录水平、蛋白水平以及代谢水平对豆类、水稻、小麦等植物应对高温胁迫的分子机制进行了探索[69-71]。此外,有研究利用基因编辑技术成功培育了水稻、玉米及小麦的耐热作物品系,在未来实际生产中具有很大的应用潜力[72-74]。
目前关于植物耐受高温的机制主要集中于细胞膜结构抗氧化系统、渗透调节机制、植物激素调控机制及高温响应基因等方面,这些研究领域在未来一段时间内也仍然是材的耐热机制研究的重点方向。鉴于目前植物耐高温机制的研究情况,该领域相关研究可能呈现以下新的趋势:(1)对于包括小麦、玉米、水稻等主要粮食作物之外的蔬菜、水果、中草药、花卉等经济作物耐高温胁迫分子机制的研究;(2)对于生物节律调控机制如何参与植物耐高温胁迫的研究;(3)更深入地研究植物耐高温胁迫机制,包括钙信号途径;(4)对于植物高温胁迫记忆机制的进一步研究。

