MAPK级联调控作物响应生物胁迫的研究进展
马红义 李珊 曹爽 李承男 尹晓

摘要:促分裂原活化蛋白激酶(MAPK)是一种蛋白激酶,可以催化底物蛋白质磷酸化,MAPK级联则是植物中高度保守的信号转导模块,将细胞外刺激转导为细胞内反应,在植物信号转导生物胁迫中起着非常重要的作用。植物MAPK的早期研究主要集中在模式植物拟南芥的功能上。基于全基因组测序的结果显示,许多MAPKs已在大田作物和园艺作物中被鉴定,如水稻、小麦、玉米、苹果、葡萄和番茄等。生物胁迫(如病害、虫害和杂草危害等)是作物面临的重大挑战,开展作物MAPK级联信号通路在生物胁迫下的机理研究至关重要。本文对植物MAPK级联及其3个成员MAPKKK、MAPKK、MAPK基因进行分类,并简要介绍MAPKKK、MAPKK、MAPK各亚家族的成员和基本特征。此外,对近些年模式植物拟南芥,大田作物水稻、玉米、小麦和马铃薯等以及一些重要的园艺作物苹果、葡萄、香蕉和梨等的MAPK信号通路响应生物胁迫(如病原菌感染、病毒攻击)进行分析和归纳总结,并对其进一步的研究工作进行展望,为MAPK级联调控响应生物胁迫在未来的研究过程中提供参考。
关键词:MAPK级联;作物;生物胁迫;信号转导
中图分类号:S184文献标志码:A
文章编号:1002-1302(2024)06-0001-10
收稿日期:2023-04-18
基金项目:宁夏自然科学基金(编号:2022AAC03010);宁夏重点研发计划(编号:2022BBF03004)。
作者简介:马红义(1998—),男,宁夏隆德人,硕士研究生,从事果树分子育种相关研究。E-mail:mhy15709587677@163.com。
通信作者:尹 晓,博士,讲师,从事果树分子育种教学和相关研究。E-mail:yinxiao90@nxu.edu.cn。
水稻(Oryza sativa L.)、玉米(Zea mays L.)、小麦(Triticum aestivum L.)、马铃薯(Solanum tuberosum L.)等主要大田作物,蔬菜、果树等园艺作物在世界各地都具有重要的经济价值。然而,在生长发育过程中,它们经常受到生物胁迫的影响,严重影响品质和产量[1]。为了提高作物的抗性水平,作物通常会在抵抗生物胁迫的过程中进化出非常精密又有效的防御机制,包括信号感知、信号转导、转录调控和免疫反应,以减少或避免损伤[2]。在真核生物中,促分裂原活化蛋白激酶(mitogen actived protein kinase,简称MAPK)级联是主要的信号转导通路之一,它控制植物中各种生物胁迫[3]及其他机制如细胞分化[4-5]、成熟转导[6]和生长发育[7]。生物胁迫与非生物胁迫一样,也会通过损害植物来响应生物胁迫[8]。已有研究证明MAPK在拟南芥(Arabidopsis thaliana L.)、马铃薯、水稻、玉米、葡萄(Vitis vinifera L.)、番茄(Lycopersicon esculentum Mill.)和蘋果(Malus domestica Borkh.)等不同植物的生物胁迫防御中发挥着关键作用[9]。目前,研究生物胁迫对作物的伤害以及作物对生物胁迫的响应机制已成为作物抗病性研究的热点之一。
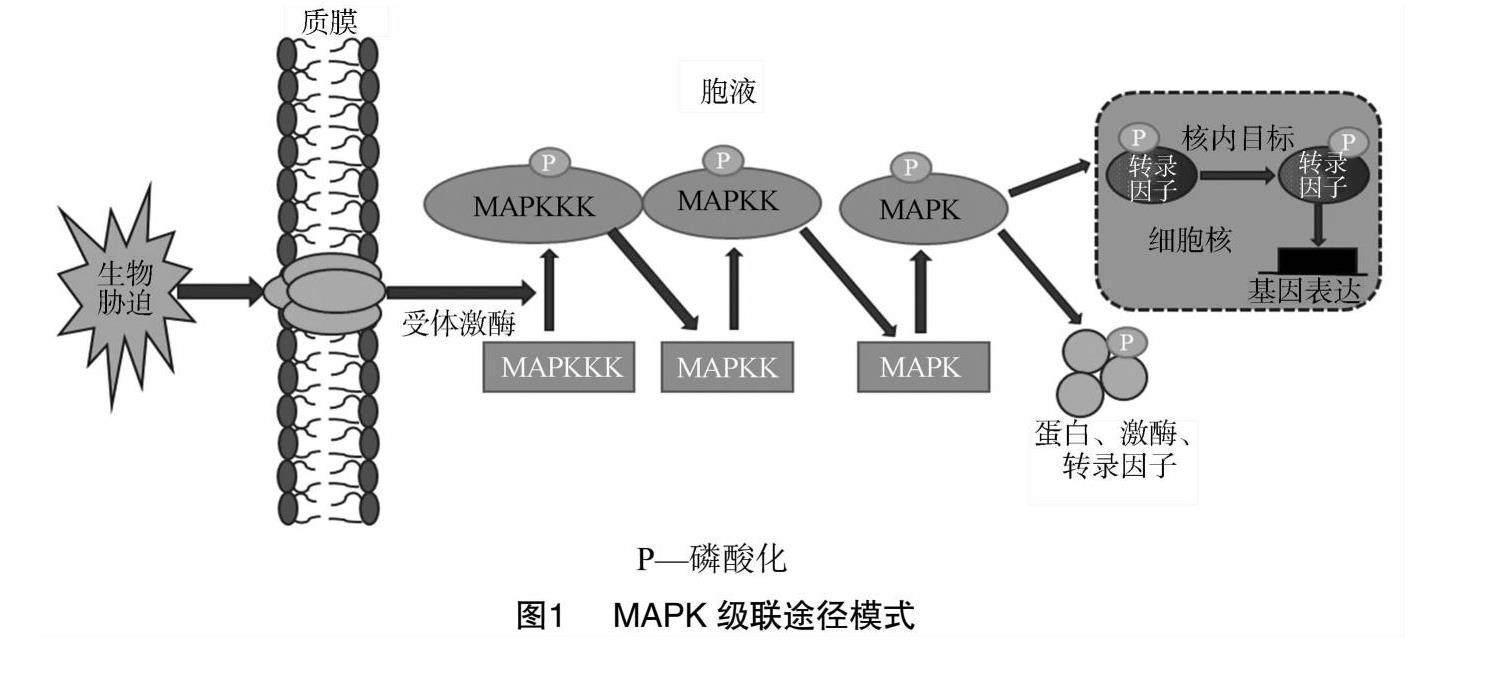
MAPK级联途径是一种特殊的信号转导机制,在许多植物中具有重要作用。典型的MAPK级联由MAPK(MPK)、MAPK激酶(MAPKK、MAP2K、MKK或MEK)和MAPK激酶激酶(MAPKKK、MAP3K或MEKK)组成[10-11]。在经典的MAPK级联信号中,MAPKKK被受刺激的质膜受体激活并向下游传输信号[12],它是通过对其结构域S/T-XXXXX-S/T(S/T是丝氨酸/苏氨酸,X是任意氨基酸)进行磷酸化而激活的。然后,MAPKK将MAPK活化环中的TXY(T为苏氨酸,Y为酪氨酸,X为任意氨基酸)基序磷酸化,从而激活MAPK[13]。最后,MAPK激活下游激酶、转录因子、酶和其他反应因子,并将细胞外环境信号传递到细胞中。通过逐级磷酸化,MAPK级联将信号传递到下游蛋白并激活抗性基因的表达[14](图1)。大量研究表明,MAPK级联通路与作物生长周期的基本发育过程有关,当作物受到生物胁迫时,它能够刺激作物产生生物学响应,以确保植物存活[15-16]。植物中的MAPK级联信号通路具有2个主要特征。首先,刺激信号通过MAPK级联通路磷酸化的过程逐级向下传递,达到信号放大的效果,从而触发细胞内的一系列反应[17]。其次,MAPK级联3个成员之间的相互作用在不同的细胞活动(如细胞分裂、分化和程序性死亡以及对生物胁迫的各种反应)中是特异性的。越来越多的研究表明,调控MAPK表达量可以增强植物对生物胁迫的耐受性[18]。近年来,园艺作物和大田作物中的MAPK级联功能受到广泛关注。本文综述了大田作物和园艺作物中MAPK级联的组成、分类及其在生物胁迫应答中的作用,为研究作物抵抗生物胁迫提供依据。
1 作物MAPK级联的组成与分类
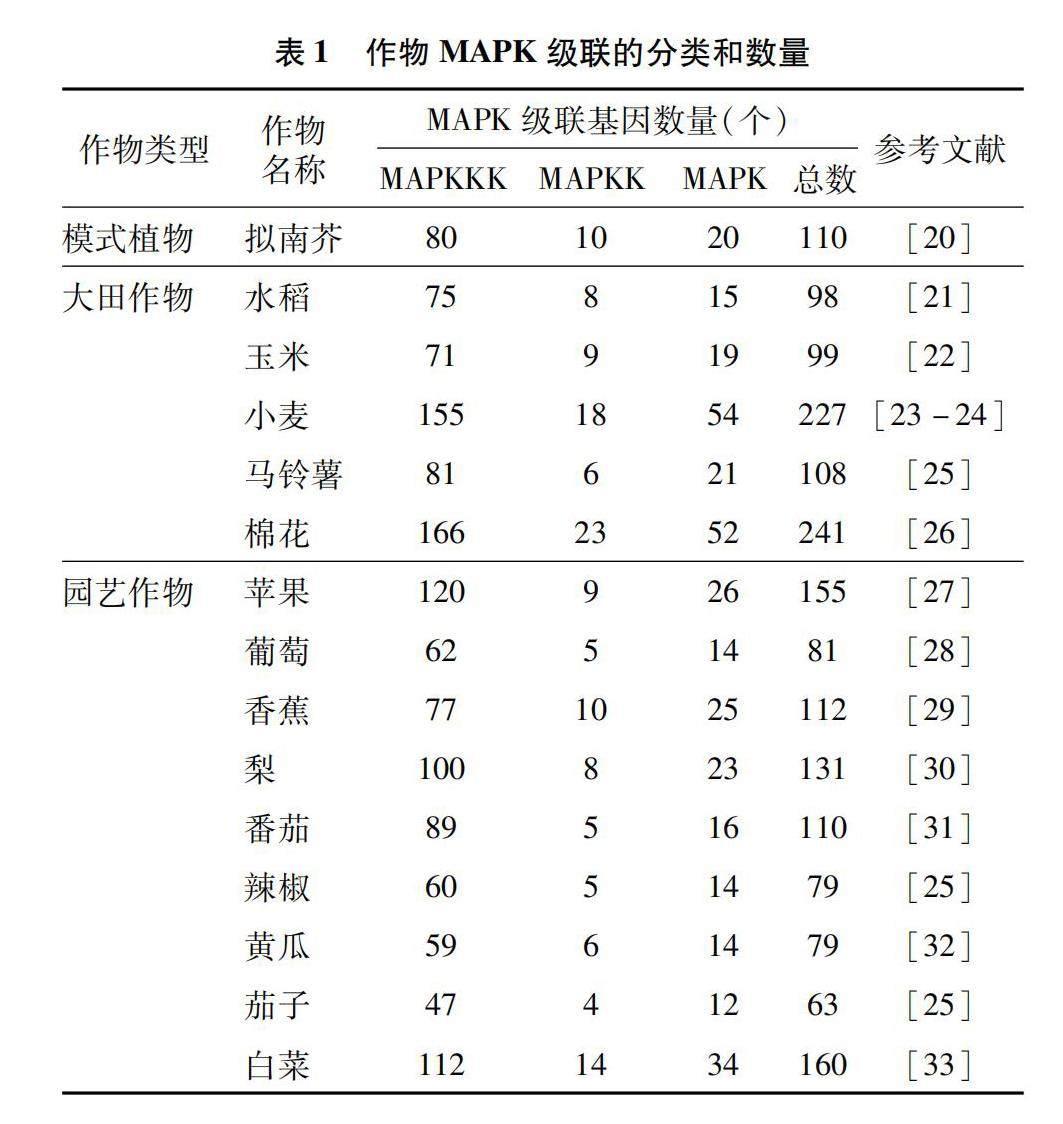
作物MAPK级联通常由3个部分组成:MAPKKK、MAPKK、MAPK[19]。作物基因组中的数量在MAPK级联家族中最多,其次是MAPK,最少的是MAPKK。近几年来,人们已经陆续从作物中鉴定出许多MAPK级联组分(表1)。在拟南芥中报道了80个MAPKKK、10个MAPKK和20个MAPK[20]。大田作物中,水稻存在75个MAPKKK、8个MAPKK和15个MAPK[21];玉米中有71个MAPKKK、9个MAPKK和19个MAPK[22];小麦中有155个MAPKKK、18个MAPKK和54个MAPK[23-24];马铃薯基因组中共鉴定出21个MAPK基因、6个MAPKK基因和81个MAPKKK基因[25];棉花(Gossypium herbaceum L.)中有166个MAPKKK、23个MAPKK和52个MAPK[26]。另外,在园艺作物中也有相关报道。苹果基因组中存在120个MAPKKK、9个MAPKK和26个MAPK[27];葡萄基因组包含14个MAPK、5个MAPKK和62个MAPKKK[28];香蕉(Musa acumate L.)中报道了77个MAPKKK、10个MAPKK和25个MAPK[29];梨(Pyrus bretschneideri R.)中有100个MAPKKK、8个MAPKK和23个MAPK[30];在番茄中找到89个MAPKKK、5个MAPKK和16个MAPK[31];辣椒(Capsicum annuum L.)中有60个MAPKKKK、5个MAPKK和14个MAPK[25];在黄瓜(Cucumis sativus L.)基因组测序中,发现59个MAPKKK、6个MAPKK和14个MAPK[32];茄子(Solanum melongena L.)基因组中包含47个MAPKKK、4个MAPKK和12个MAPK[25];在白菜(Brassica campestris L.)中找到112个MAPKKK基因、14个MAPKK和34个MAPK基因[33]。
1.1 MAPKKK
MAPKKK位于MAPK级联途径的最上游,目前在MAPK级联家族中它的基因数量最多(表2)。MAPKKK在高等植物中分为3类:MEKK亚型、Raf亚型、ZIK亚型[34]。在MEKK亚型中,鉴定到1个具有G(T/S)Px(W/Y/F)MAPEV的蛋白激酶结构域,大部分ZIK亚型都含有GTPEFMAPE(L/V)Y结构域,而Raf亚型则含有GTxx(W/Y)MAPE结构域。在拟南芥中有80个MAPKKK基因,其中有21个属于MEKK亚型,48个属于Raf亚型,11个属于ZIK亚型[20]。随后,人们也相继对大田作物的MAPKKK基因进行了系统发育分析,发现水稻的75个MAPKKK基因中分别有22个MEKK亚型、43个Raf亚型、10个ZIK亚型[21];玉米中MAPKKK有71个成员,其中26个属于MEKK亚型,37个属于Raf亚型,8个属于ZIK亚型[22];在小麦中有155个MAPKKK基因,29个属于MEKK亚型,115个属于Raf亚型,11个属于ZIK亚型[23];在马铃薯中有81个MAPKKK基因,22个属于MEKK亚型,43个属于Raf亚型,16个属于ZIK亚型[25];棉花的166个MAPKKK基因中有44个属于MEKK亚型,98个属于Raf亚型,24个属于ZIK亚型[26]。也有研究对很多园艺植物进行了分析,发现苹果的120个MAPKKK基因中分别有11个MEKK亚型、72个Raf亚型、37个ZIK亚型[27];在葡萄中鉴定出62个MAPKKK,21个属于MEKK亚型,只有12个属于ZIK亚型,29个被归入Raf亚型[28];香蕉中MAPKKK有77个成员,14个属于MEKK亚型,48个属于Raf亚型,15个属于ZIK亚型[29];在梨中,Raf亚型中共有57个,ZIK亚型中有19个,MEKK亚型中有24个[30];番茄的89个MAPKKK成员中,MEKK亚型有33个,Raf亚型有40个,ZIK亚型有16个[31];在辣椒中有60个MAPKKK基因,17个属于MEKK亚型,37个属于Raf亚型,6个属于ZIK亚型[25];黄瓜的59个MAPKKK基因中分别有18个MEKK亚型、31个Raf亚型、10个ZIK亚型[32];在茄子中有47个MAPKKK基因,14个属于MEKK亚型,28个属于Raf亚型,5个属于ZIK亚型[25];白菜的112个MAPKKK基因中分别有22个MEKK亚型、72个Raf亚型、18个ZIK亚型[33]。
1.2MAPKK
MAPKK共包含11个保守的亚型,按照它的蛋白催化区和结构将它分为4个不同的亚型,除了D亚型之外,其他3种亚型在它的第7个和第8个亚结构域之间都包含着1个非常保守的S/TxxxxxS/T基序。
目前,对于MAPKK的发现并不多(表3),拟南芥中仅有10个MAPKK成员,其中3个为A亚型,1个为B亚型,2个为C亚型,4个为D亚型[20]。在大田作物中,水稻有8个MAPKK成员,A、C亚型各有2个成员,B亚型1个成员,D亚型3个成员[21];9个玉米MAPKK成员中,A、C、D亚型分别含有2个MAPKK成员,B亚型含有3个[22];小麦共有18个MAPKK成员,4个亚型分别有3、2、1、12个[24];马铃薯的5个MAPKK成员中,A亚型有2个,B、C、D亚型各有1个[25];棉花中有23个MAPKK成员,其中8个为A亚型,2个为B亚型,4个为C亚型,9个为D亚型[26]。对园艺作物MAPKK基因进行系统发育分析,发现苹果中A、B、C、D亚型分别占3、1、2、3个[27];在葡萄MAPKK家族成员中,VvMAPKK2和VvMAPKK3与拟南芥A组MAPKK(AtMAPKK1、AtMAPKK2和AtMAPKK6)高度同源,VvMAPKK5与拟南芥B组MAPKK(AtMAPKK3)高度同源,VvMAPKK4与拟南芥C组MAPAPKK(AtMAPKK4和AtMAPKK5)高度同源,VvMAPKK1与拟南芥D组MAPKK(AtMAPKK8)高度同源[28];在香蕉的10个MAPKK成员中,A亚型只有1个,其他3种亚型各占3个[29];梨中有8个MAPKK成员,其中2个为A亚型,1个为B亚型,2个为C亚型,3个为D亚型[30];在5个番茄MAPKK中发现,SlMAPKK1和SlMAPKK3属于A亚型,SlMAPKK5属于B亚型,SlMAPKK2属于C亚型,SlMAPKK4属于D亚型[31];辣椒的5个MAPKK成员中,只有A亚型有2个,其他3种亚型各有1个[25];6个黄瓜MAPKK成员中,B、C、D亚型各有1个,A亚型有3个[32];茄子的4个MAPKK成员中,每个亚型分别有1个[25];14个白菜MAPKK成员中,A、C亚型各有4个,B亚型有1个,D亚型有5个[33]。
1.3 MAPK
MAPK是一类广泛存在的丝氨酸/苏氨酸蛋白酶和磷酸化底物,已在40多个物种鉴定出来。MAPK按照其所依赖的TXY结构域分成2类,一类含有TEY结构域,一类含有TDY结构域,其中TEY基序的亚型可根据其结构特征和序列分为3组[35]。因此,MAPK成员也分为A、B、C、D等4个亚型,其中D亚型成员较多。在拟南芥的20个MAPK基因中就有8个D亚型[20];水稻中含有15个MAPK,其中有10个为D亚型[21];玉米的19个MAPK中,D亚型有11个[22];小麦中共有54个MAPK,36个为D亚型[24];马铃薯中有21个MAPK,14个为D亚型[25];棉花中有52个MAPK,19个为D亚型[26]。与其他作物相比,苹果中的MAPK基因家族是迄今為止最大的,A、C亚型均有5个,其次是B亚型,有6个,D亚型构成最大的进化支,包含10个MdMAPK[27]。虽然葡萄基因组包含的MAPK少于拟南芥基因组,但VvMAPK已分为5个亚型,这与其他植物不同,其中VvMAPK12和VvMAPK14属于A亚型,VvMAPK9、VvMAPK11、VvMAPK13属于B亚型,VvMAPK4和VvMAPK8属于C亚型,D亚型MAPK包括VvMAPK1、VvMAPK3、VvMAPK5、VvMAPK6和VvMAPK7,以及VvMAPK2和VvMAPK10属于E亚型[28]。香蕉和梨中分别有25、23个MAPK成员[29-30];在番茄基因组中,3个MAPK基因属于A亚型,4个MAPK基因属于B亚型,2个MAPK基因属于C亚型,7个MAPK基因属于D亚型[31]。辣椒、黄瓜、茄子和白菜中分别有14、14、12、34个MAPK成员[25,32-33]。
2 生物胁迫下不同作物MAPK级联的作用
作物在生长和发育的过程中,除了受多种非生物胁迫的影响,还受病原体入侵、昆虫取食等生物胁迫的威脅[36]。生物胁迫不仅会损害作物,而且还会减缓其在各个阶段的生长和发育。在过去,很多植物完全被细菌和真菌病害破坏,MAPK基因家族在响应病原体攻击中就发挥了重要作用,并在各种生物胁迫下调节植物生长和发育[37]。有研究发现,植物的长期进化形成了一系列抵抗病原体感染的防御机制,如程序性细胞死亡、细胞壁增厚、活性氧(ROS)积累、致病相关蛋白合成、防御基因的转录激活等[38]。通常情况下,植物在遇到一般危害(如H2O2)时,水杨酸诱导的蛋白激酶(SA-induced protein kinase,简称SIPK)和ROS共同参与的系统获得抗性(systemic acquired resistance,SAR)后相互协同,构建的体系能长期维持对各种病原菌的抵抗力;当受到诸如病原菌侵染等伤害时,会触发氧化爆发(oxidative burst,简称 OXB)并产生过敏性反应。在发生氧化爆发的时候,植物细胞能够生成大量的活性氧,并将与防御基因有关的信号转导通路激活;过敏反应是病原菌胁迫下植物细胞最典型的防御反应之一[39]。在各种作物中,MAPK级联已被用于生物胁迫(表4),并在作物生长发育过程中起着关键作用。
2.1 模式植物
在拟南芥中,MEKK1不仅在植物生长和对非生物胁迫的反应中起作用,而且在对细菌和真菌病原体的反应中也起作用。Asai等确定了完整的植物MAPK级联通路(MEKK1、MKK4/MKK5和MPK3/MPK6),它在鞭毛蛋白受体FLAGELLIN-SENSING2(FLS2)的下游发挥作用,FLS2是一种富含亮氨酸重复受体激酶[40]。该结果也证实,MAPK通路的活化导致拟南芥对病原菌的耐受性,说明由多种病害引起的信号转导过程会汇集在一起形成一个完整的MAPK通路。另一项研究表明,MEKK1、MKK1/MKK2和MPK4形成MAPK级联通路,负向调节植物免疫反应[41]。Raf基因AtEDR1负向调节防御并直接调节MKK4/MKK5-MPK3/MPK6级联以微调作物免疫。此外,EDR1突变体具有高度活化的MPK3/MPK6激酶活性和比野生型更高水平的MPK3/MP6蛋白,显示EDR1负向影响MKK4/MKK5蛋白水平[42]。MPK3和MPK6对ACS2和ACS6转录和翻译后上调,对于病原体诱导的乙烯生物合成至关重要[43]。真菌病原菌灰葡萄孢菌(Botrytis cinerea)诱导的拟南芥乙烯生物合成受乙烯信号通路的负反馈调控,进一步发现乙烯反应因子ERF1A作用于乙烯信号下游,通过间接抑制ACS2和ACS6的表达,负调控灰葡萄孢诱导的乙烯生物合成。ERF1A是MPK3和MPK6的底物,MPK3和MPK6通过磷酸化激活ERF1A,增强ERF1A抑制乙烯合成和诱导防御素基因表达的功能[43]。最近的研究表明,MEKK3/MEKK5-MKK4/MKK5-MPK3/MPK6级联路径在植物防御病原体的过程中涉及多条途径,主要包括乙烯与植物保护素的合成、吲哚硫代葡萄糖苷生物合成途径和气孔免疫[44-47]。由此可见,MAPK级联途径交互作用构建了拟南芥的防御系统,增强了拟南芥对病原菌的抗性。
2.2 大田作物
在稻瘟病菌(Magnaporthe oryzae)侵染水稻过程中,内质网胁迫能够活化MoAtg1(核心自噬机制中唯一确定的激酶),且能够特异性地磷酸化MoMKK1(酿酒酵母MKK1/MKK2的同源基因),而这种磷酸化是稻瘟菌细胞完整性(CWI)通路的激活和致病性的关键[48]。在水稻白叶枯病中,过量表达OsMKK3和OsMPK7可提高水稻对白叶枯病的抗性,并激活OsMKK3-OsMPK7级联反应[49]。OsMPKK10.2的表达在受水稻条斑病细菌(Xanthomonas oryzae pv. oryzicola)侵染后明显升高,且 OsMPKK10.2-OsMPK6级联能够正向调节水稻对条斑病的抗性[50]。另外,水稻中AtEDR1的同源基因可被茉莉酸(JA)、水杨酸(SA)和内皮素诱导。EDR1抑制基因敲除植物在叶子上出现自发性病变,增强水稻对枯萎病的抵抗性,这种抵抗性与SA和JA的积累有关[51]。与水稻中的另一个Raf基因EDR1相似,ILA1也负向调节免疫反应。ILA1主要磷酸化MAPKK4的N末端结构域的苏氨酸,这可能影响MAPKK4的稳定性。ILA1可以通过磷酸化MAPKK4的N末端结构域来抑制下游MAPKK4-MAPK级联通路,从而增强水稻对细菌引起的白叶枯病的抗性[52]。在研究水稻病毒胁迫方面,水稻被黑条矮缩病毒(rice black-streaked dwarf virus,RBSDV)侵染后,会显著诱导受体类蛋白OsRLP1的表达。通过对T-DNA突变体、过表达转基因以及敲除突变体接种病毒,发现OsRLP1在作物防御病毒侵染中发挥重要作用。进一步研究表明,OsRLP1主要通过影响PTI相关基因的表达和MAPK的激活,参与病毒诱导的PTI反应[53]。玉米大斑病是由玉米大斑病菌(Setosphaeria turcica)引起的重要玉米病害,研究克隆玉米大斑病菌CWI-MAPK途径中的一个MAPKKK基因,命名为StBCK1,通过试验分析发现玉米大斑病菌StBCK1基因调控病菌的致病性[54]。另外,从玉米中分离出1个新的D组MAPK基因ZmMPK17,发现过表达ZmMPK17的植物对病毒病原体的抗性增强,致病相关基因的表达显著增加,表明ZmMPK17可能参与SA介导的病原体防御信号通路[55]。小麦专化型条形柄锈菌(Puccinia striiformis f. sp. tritici,Pst)利用毒力效应物干扰寄主免疫,引起毁灭性的条锈病。Hasp98(Pst效应因子)与小麦丝裂原活化蛋白激酶TaMAPK4相互作用,TaMAPK4是作物抗条锈病的正调节因子。另外,还证明了Hasp98抑制TaMAPK4的激酶活性,并且TaMAPK4的稳定沉默损害了小麦对条锈菌的抗性。这也表明Hasp98作为一种毒力效应因子干扰小麦MAPK信号通路,从而促进条锈菌侵染[56]。在马铃薯致病疫霉的情况下,研究了名为StMEK1-StMPK1/StWIPK(拟南芥AtMEK4/AtMEK5-AtMPK6/AtMPK3的直系同源物)的MAPK级联,其在生物胁迫下有助于增强马铃薯中的免疫性[57]。StMKK1的马铃薯负性免疫调节因子也被致病疫霉RXLR效应子稳定和靶向[58]。另外,StMKK1通过负调控PTI(PAMP-triggered immunity)反应以及水杨酸(SA)信号通路,降低马铃薯对致病疫霉(Phytophthora infestans)和青枯假单胞杆菌(Ralstonia solanacearum)的抗性,提高马铃薯对灰霉菌(Botrytis cinerea)的抗性,从而在植物免疫中发挥双重功能[59]。同时,对马铃薯StMKK1的上游 MAPK蛋白进行研究,结果表明,StMPK7与StMKK1之间存在着相互作用,并被StMKK1磷酸化,所以StMPK7是StMKK1的直接上游信号分子,而且StMPK7还对致病疫霉菌和寄生疫霉菌(P. parasitica)的抗性进行正调控[60];同时,组成性激酶活性的StMPK7在本氏烟草叶片中过表达能够触发依赖于SGT1/RAR1基因的植物细胞死亡,而StMPK7引发的植物细胞死亡则可以被水杨酸羟化酶(NahG)完全抑制,这说明StMPK7可以通过对水杨酸信号途径的影响来调节植物的免疫反应[60]。在马铃薯中也鉴定出3种MAPK:StMPK4、StMPK6和StMPK7/WRY33,它们是拟南芥属MAPK AtMPK4、AtMPK5、AtMPK11和AtMPK12的直系同源物[61];同样,活化的MPK3/MPK6随后增强防御相关基因的表达,如编码果糖激酶FRK1和转录因子WRKY22和WRKY29的基因,从而提高马铃薯对细菌和真菌的免疫力[62]。在对马铃薯Y病毒的应答中,StMKK6是受最强调控的基因,被一些转录因子如SIMK和SAMK激活。通过亚细胞定位研究发现,StMKK6在马铃薯防御反应中的参与被证实[63]。在棉花中,GhMAP3K65通过SA/JA/ET和ROS信号通路响应病原体感染。GhMAP3K65基因沉默可增强棉花对青枯假单胞杆菌的抗性。相反,GhMAP3K65的过表达增强了对青枯假单胞杆菌的易感性[64]。又有研究利用病毒介导的基因沉默(VIGS)技术,分别获得转基因植株GhMKK4、GhMPK20、GhWRKY40,并通过酵母双杂交、免疫共沉淀等方法验证三者之间的互作关系;随后,在烟草中过表达GhMKK4、MPK20、GhWRKY40,发现其对枯萎病高度敏感,证明GhMKK4、MPK20、WRKY40对枯萎病抗性具有负向调节作用[65]。
2.3 园艺作物
有研究在易感苹果品种Gala中发现了由果生炭疽菌(Colletotrichum fructicola)感染顯著诱导的转录因子MdWRKY17,过表达MdWRKY17转基因Gala表现出对炭疽菌的易感性增强,MdMPK3直接与MdWRKY17相互作用并磷酸化,这说明MAPK在调节苹果病原菌防御中有着重要作用[66]。在葡萄中,由生物营养型子囊菌引起的白粉病对葡萄树生长、浆果品质和葡萄产量具有不利影响[67]。葡萄在受到白粉菌(Erysiphe necator Schw)侵染时,导致大多数MAPKKK基因(VviMAPKKK46、VviMAPKKK50、VviMAPKKK31、VviMAPKKK32、VviMAPKKK39、VviMAPKKK38和VviMAPKKK34)上调表达,尤其是VviMAPKKK50显示出最高表达量。一些MAPKKK基因(VviMAPKKK4、VviMAPKKK54和VviMAPKKK51)由于白粉病病菌感染而显著下调,尤其是VviMAPKKK54[68];导致VvMAPK5和VvMAPK6基因下调表达,VvMAPK1和VvMAPK10在被侵染12、48 h后上调表达,VvMAPK9基因的表达量还随着被侵染时间而提高[69]。此外,有研究发现,VdMAPK7基因受尖孢炭疽菌(Colletotrichum acutatum)侵染后,其表达量呈递增趋势,表明VdMAPK7基因过表达能提高番茄对尖孢炭疽菌的抗性[70]。人们在研究香蕉抗病原菌时,从香蕉根中克隆了6个香蕉MAPK基因(MaMAPK1、MaMAPK2、MaMAPK3、MaMAPK4、MaMAPK5和MaMAPK6),经激素诱导MaMAPKs后,发现MaMAPK1、MaMAPK2、MaMAPK3和MaMAPK6基因在接种尖孢镰刀菌4号生理小种(Fusarium Oxysporum f. sp cubense Tropical Race 4,FocTR4)后,在抗性品种中的表达显著上调,表明这些基因可能参与了香蕉对FocTR4的抗性,MaMAPKs可能在香蕉对FocTR4感染的抗性中发挥了重要作用[71]。梨在受到链格孢菌(Alternaria alternate)侵染时,发现大多数MAPKKK基因(PbrMAPKKK12、PbrMAPKKK13、PbrMAPKKK53、PbrMAPKKK60、PbrMAPKKK65、PbrMAPKKK82、PbrMAPKKK83和PbrMAPKKK96)与黑斑病抗性相关。另外一些MAPKKK基因(PbrMAPKKK3、PbrMAPKKK9、PbrMAPKKK11、PbrMAPKKK34、PbrMAPKKK80、PbrMAPKKK81、PbrMAPKKK99和PbrMAPKKK100)与黑斑病易感性相关,而PbrMAPKKK基因正响应梨对黑斑病的抗性生命过程。此外,病毒诱导的基因沉默(VIGS)表明PbrMAPKKK82基因增强了对梨黑斑病的抗性[72]。另外,也有研究特别证实了MAPK信号通路中转录因子可能在青霉菌侵染梨果实中发挥重要作用,但是尚无具体的MAPK基因功能研究[73]。在研究番茄抵抗生物胁迫时,人们发现番茄中的MAP3Kε可激活MEK2、创伤诱导蛋白激酶(WIPK)、水杨酸诱导蛋白激酶(SIPK)等下游因子,从而正向调节与作物免疫相关的细胞死亡,增强作物免疫力。MAP3Kε基因的敲除,降低了番茄对野油菜黄单胞菌(Xanthomonas campestris)和丁香假单胞菌(Pseudomonas syringae)的抗性。与MAP3Kε相似,MAP3Kα也属于MEKK亚家族,它是过敏反应和对丁香假单胞菌抗性所必需的。MAP3Kα和MAP3Kε均通过激活MEK2-WIPK/SIPK来调控细胞死亡[74-76]。研究表明,SlMPK1、SlMPK2和SlMPK3通过调节番茄茉莉酸的合成和茉莉酸依赖的防御基因表达,在系统素介导的番茄对昆虫取食的应答中发挥重要作用[77]。SlMAPKKK通过介导SlMAPKKK-MEK2-WIPK/SIPK级联反应,参与过敏反应(HR)诱导的番茄细胞死亡和对革兰氏阴性细菌(Gram-negative bacteria)病原体的抗病性。SlMAPKKK的沉默降低了番茄对野油菜黄单胞菌和丁香假单胞菌(Pseudomonas syringae)菌株,导致疾病症状的出现和细菌生长的增强[76]。研究发现,MPK7在辣椒中参与ROS解毒、孢囊萌发、有性卵孢子产生和大豆疫霉菌(Phytophthora sojae)感染[78]。应激激活的MAPK、SAK1相对表达随着自身DNA的应用而增加,但MPK7没有。SAK1相对表达的增加表明自身DNA介导的信号影响该MAPK。SAK1参与游动孢子的发育并且是疫霉菌的致病性所必需的。由此可以预测MPK7的类似组成型表达在辣椒疫霉菌(Phytophthora capsici)中[79]。黄瓜中木霉诱导的MAPK参与真菌防御反应[80]。此外,使用qRT-PCR分析来检查CsMAPK基因响应于古巴疫霉菌(Phytophthora cubana)的表达水平。结果表明,所有检测的CsMAPKs在古巴疫霉菌处理后均下调,并且CsMAPKKs的表达水平在古巴疫霉菌处理后不规则地增加或减小[32]。在研究茄子青枯病时,发现SmTCP7a正向调节由青枯菌引起的青枯病。本研究涉及苯丙素生物合成、MAPK信号通路、作物激素信号转导和作物病原体之间的相互作用,并且MAPK信号通路在茄子抵抗青枯假单胞杆菌侵染时起到重要作用[81]。有研究对白菜进行了生理、生化和转录组学分析,发现大丽轮枝孢激活蛋白(Verticillium dahliae Aspf2-like protein,简称VDAL)侵染核盘菌(Sclerotinia sclerotiorum)的抗性作物时,VDAL处理的叶片基因差异性表达,这些都是MAPK信号通路、作物激素信号转导和作物病原体相互作用,并且与作物免疫相关,表明VDAL具有增强白菜作物抗真菌性的巨大潜力[82]。
3 展望
生物胁迫是大田作物和园艺作物生长发育的主要障碍。MAPK级联反应通过磷酸化和去磷酸化增强和传递多种应激信号给下游的应答因子,引起一系列应激反应。为了提高作物的生物胁迫耐受性,基因工程技术提供了各种应用[83];MAPK级联及其作用机制至关重要。
大量的MAPKs基因已被用于研究不同的生物胁迫。有很多试验尽管已在其他作物如玉米、葡萄、马铃薯、水稻、番茄中,进行了多种MAPKs基因研究,但很多仅研究了一些基因,这些基因需要鉴定和分析它们在各种生物胁迫条件下的功能仍需进一步研究。在不久的将来,转录组学、蛋白质组学、代谢组学、生物信息学、基因沉默、基因编辑、microRNA技术、基因突变、DNA测序等先进方法被用于调控网络的功能分析,可通过在作物中鉴定更多的MAPKs基因来控制生物胁迫响应。此外,利用这些先进的方法可以进一步对MAPKs进行鉴定和功能分析,获得MAPKs突变体和基因工程基因家族,并将其转化到作物中,使其耐受生物胁迫,从而提高大田作物与园艺作物的产量和品质。
参考文献:
[1]陈永快,王 涛,廖水兰,等. 逆境及生长调节剂对作物抗逆性的影响综述[J]. 江苏农业科学,2019,47(23):68-72.
[2]刘长英. 桑树G蛋白信号基因的鉴定与非生物胁迫调控分子机理研究[D]. 重庆:西南大学,2018:19-29.
[3]朱晓果. 小麦条锈菌MAPK信号通路介导的致病机理及其在抗锈育种中的应用[D]. 杨凌:西北农林科技大学,2017:16-29.
[4]陈 亮,侯岁稳. 植物气孔发育的分子遗传调控[J]. 中国科学(生命科学),2017,47(8):798-807.
[5]Zhao F Y,Hu F,Zhang S Y,et al. MAPKs regulate root growth by influencing auxin signaling and cell cycle-related gene expression in cadmium-stressed rice[J]. Environmental Science and Pollution Research,2013,20(8):5449-5460.
[6]许 燕. OsMPK4在早期胚胎形成中的功能及水稻MAPK功能获得型系统构建[D]. 杭州:浙江大学,2020:13-30.
[7]单鸿轩,付 畅. 逆境胁迫下植物MAPK级联反应途径研究新进展[J]. 核农学报,2017,31(4):680-688.
[8]Lee H K,Cho S K,Son O,et al. Drought stress-induced Rma1H1,a RING membrane-anchor E3 ubiquitin ligase homolog,regulates aquaporin levels via ubiquitination in transgenic Arabidopsis plants[J]. The Plant Cell,2009,21(2):622-641.
[9]郝丽芬,燕孟娇,房永雨,等. 黑胫病菌侵染过程中油菜响应基因的表达分析[J]. 西北植物学报,2021,41(2):197-211.
[10]刘亚菲,张 帆,梁卫红. 水稻MAPK级联的功能和作用机制[J]. 中国生物化学与分子生物学报,2021,37(12):1569-1576.
[11]Cristina M,Petersen M,Mundy J.Mitogen-activated protein kinase signaling in plants[J]. Annual Review of Plant Biology,2010,61:621-649.
[12]张文宣,梁晓梅,戴 成,等. 利用CRISPR/Cas9技术突变BnaMPK6基因降低甘藍型油菜的耐盐性[J]. 作物学报,2023,49(2):321-331.
[13]张振才,梁 燕,李 翠. 植物MAPK级联途径及其功能研究进展[J]. 西北农林科技大学学报(自然科学版),2014,42(4):207-214.
[14]Xie C,Yang L,Gai Y P.MAPKKKs in plants:multidimensional regulators of plant growth and stress responses[J]. International Journal of Molecular Sciences,2023,24(4):4117.
[15]Zhou H Y,Ren S Y,Han Y F,et al. Identification and analysis of mitogen-activated protein kinase (MAPK) cascades in Fragaria vesca[J]. International Journal of Molecular Sciences,2017,18(8):1766.
[16]de Zelicourt A,Colcombet J,Hirt H.The role of MAPK modules and ABA during abiotic stress signaling[J]. Trends in Plant Science,2016,21(8):677-685.
[17]Zhou M Y,Zhao B B,Li H S,et al. Comprehensive analysis of MAPK cascade genes in sorghum (Sorghum bicolor L.) reveals SbMPK14 as a potential target for drought sensitivity regulation[J]. Genomics,2022,114(2):110311.
[18]Salisu B S. 陸地棉非生物胁迫相关MAPK基因的功能分析[D]. 北京:中国农业科学院,2021:19-23.
[19]濮 雪,王凯彤,张 宁,等. 马铃薯StMAPKK4基因表达分析及互作蛋白筛选与鉴定[J]. 作物学报,2023,49(1):36-45.
[20]Colcombet J,Hirt H. Arabidopsis MAPKs:a complex signalling network involved in multiple biological processes[J]. Biochemical Journal,2008,413(2):217-226.
[21]Rohila J S,Yang Y N. Rice mitogen-activated protein kinase gene family and its role in biotic and abiotic stress response[J]. Journal of Integrative Plant Biology,2007,49(6):751-759.
[22]周秒依,任 雯,赵冰兵,等. 植物MAPK级联途径应答的非生物胁迫研究进展[J]. 中国农业科技导报,2020,22(2):22-29.
[23]Wang M,Yue H,Feng K W,et al. Genome-wide identification,phylogeny and expressional profiles of mitogen activated protein kinase kinase kinase (MAPKKK) gene family in bread wheat (Triticum aestivum L.)[J]. BMC Genomics,2016,17(1):668.
[24]Zhan H S,Yue H,Zhao X,et al. Genome-wide identification and analysis of MAPK and MAPKK gene families in bread wheat (Triticum aestivum L.)[J]. Genes,2017,8(10):284.
[25]Iftikhar H,Naveed N,Virk N,et al. In silico analysis reveals widespread presence of three gene families,MAPK,MAPKK and MAPKKK,of the MAPK cascade from crop plants of Solanaceae in comparison to the distantly-related syntenic species from Rubiaceae,coffee[J]. Peer J,2017,5:e3255.
[26]Yin Z J,Zhu W D,Zhang X P,et al. Molecular characterization,expression and interaction of MAPK,MAPKK and MAPKKK genes in upland cotton[J]. Genomics,2021,113(1):1071-1086.
[27]Sun M H,Xu Y,Huang J G,et al. Global identification,classification,and expression analysis of MAPKKK genes:functional characterization of MdRaf5 reveals evolution and drought-responsive profile in apple[J]. Scientific Reports,2017,7:13511.
[28]akr B,Klkaya O.Mitogen-activated protein kinase cascades in Vitis vinifera[J]. Frontiers in Plant Science,2015,6:556.
[29]Wang L Z,Hu W,Tie W W,et al. The MAPKKK and MAPKK gene families in banana:identification,phylogeny and expression during development,ripening and abiotic stress[J]. Scientific Reports,2017,7:1159.
[30]Liang Q,Lin X J,Liu J H,et al. Genome-wide identification of MAPKK and MAPKKK gene family members and transcriptional profiling analysis during bud dormancy in pear (Pyrus×bretschneideri)[J]. Plants,2022,11(13):1731.
[31]Kong F L,Wang J,Cheng L,et al. Genome-wide analysis of the mitogen-activated protein kinase gene family in Solanum lycopersicum[J]. Gene,2012,499(1):108-120.
[32]Wang J,Pan C T,Wang Y,et al. Genome-wide identification of MAPK,MAPKK,and MAPKKK gene families and transcriptional profiling analysis during development and stress response in cucumber[J]. BMC Genomics,2015,16(1):386.
[33]Wu P,Wang W L,Li Y,et al. Divergent evolutionary patterns of the MAPK cascade genes in Brassica rapa and plant phylogenetics[J]. Horticulture Research,2017,4:17079.
[34]李 娜. 條斑紫菜PyMAPK2/3在逆境胁迫下的表达分析及MAPKKK基因家族的特性解析[D]. 青岛:中国海洋大学,2018:6-27.
[35]许机分,陈泓妃,王 娜,等. 真菌Hog1 MAPK信号通路研究进展[J]. 生物技术通报,2022,38(11):32-40.
[36]李子正,隋鲁鹏,张蕾蕾,等. 植物内生昆虫病原真菌在病虫害防治中的研究进展[J]. 中国植保导刊,2022,42(12):18-28.
[37]周 琪,付 畅. 植物MAPK基因及其在逆境胁迫下的作用[J]. 黑龙江农业科学,2015(5):149-152.
[38]柯晶晶. 青枯菌果胶外切酶PehC介导的番茄免疫与应用潜能[D]. 武汉:华中农业大学,2022:1-28.
[39]钱恒伟,迟梦宇,赵 颖,等. 稻瘟菌Rac1蛋白的原核表达与纯化[J]. 青岛农业大学学报(自然科学版),2017,34(2):126-132.
[40]Asai T,Tena G,Plotnikova J,et al. MAP kinase signalling cascade in Arabidopsis innate immunity[J]. Nature,2002,415(6875):977-983.
[41]Kong Q,Qu N,Gao M,et al. The MEKK1-MKK1/MKK2-MPK4 kinase cascade negatively regulates immunity mediated by a mitogen-activated protein kinase kinase kinase in Arabidopsis[J]. Plant Cell,2012,24(5),2225-2236.
[41]Kong Q,Qu N,Gao M H,et al. The MEKK1-MKK1/MKK2-MPK4 kinase cascade negatively regulates immunity mediated by a mitogen-activated protein kinase kinase kinase in Arabidopsis[J]. The Plant Cell,2012,24(5):2225-2236.
[42]Zhao C Z,Nie H Z,Shen Q J,et al. EDR1 physically interacts with MKK4/MKK5 and negatively regulates a MAP kinase cascade to modulate plant innate immunity[J]. PLoS Genetics,2014,10(5):e1004389.
[43]Wang X Y,Meng H C,Tang Y X,et al. Phosphorylation of an ethylene response factor by MPK3/MPK6 mediates negative feedback regulation of pathogen-induced ethylene biosynthesis in Arabidopsis[J]. Journal of Genetics and Genomics,2022,49(8):810-822.
[44]Sun T J,Nitta Y,Zhang Q,et al. Antagonistic interactions between two MAP kinase cascades in plant development and immune signaling[J]. EMBO Reports,2018,19(7):e45324.
[45]Xu J,Meng J,Meng X Z,et al. Pathogen-responsive MPK3 and MPK6 reprogram the biosynthesis of indole glucosinolates and their derivatives in Arabidopsis immunity[J]. The Plant Cell,2016,28(5):1144-1162.
[46]Su J B,Zhang M M,Zhang L,et al. Regulation of stomatal immunity by interdependent functions of a pathogen-responsive MPK3/MPK6 cascade and abscisic acid[J]. The Plant Cell,2017,29(3):526-542.
[47]Bi G Z,Zhou Z Y,Wang W B,et al. Receptor-like cytoplasmic kinases directly link diverse pattern recognition receptors to the activation of mitogen-activated protein kinase cascades in Arabidopsis[J]. The Plant Cell,2018,30(7):1543-1561.
[48]Yin Z Y,Feng W Z,Chen C,et al. Shedding light on autophagy coordinating with cell wall integrity signaling to govern pathogenicity of Magnaporthe oryzae[J]. Autophagy,2020,16(5):900-916.
[49]Jalmi S K,Sinha A K.Functional involvement of a mitogen activated protein kinase module,OsMKK3-OsMPK7-OsWRK30 in mediating resistance against Xanthomonas oryzae in rice[J]. Scientific Reports,2016,6:37974.
[50]Ma H G,Chen J E,Zhang Z Z,et al. MAPK kinase 10.2 promotes disease resistance and drought tolerance by activating different MAPKs in rice[J]. The Plant Journal,2017,92(4):557-570.
[51]Shen X L,Liu H B,Yuan B,et al. OsEDR1 negatively regulates rice bacterial resistance via activation of ethylene biosynthesis[J]. Plant,Cell & Environment,2011,34(2):179-191.
[52]Chen J,Wang L H,Yang Z Y,et al. The rice raf-like MAPKKK OsILA1 confers broad-spectrum resistance to bacterial blight by suppressing the OsMAPKK4-OsMAPK6 cascade[J]. Journal of Integrative Plant Biology,2021,63(10):1815-1842.
[53]Zhang H H,Chen C H,Li L L,et al. A rice LRR receptor-like protein associates with its adaptor kinase OsSOBIR1 to mediate plant immunity against viral infection[J]. Plant Biotechnology Journal,2021,19(11):2319-2332.
[54]王梅娟. 玉米大斑病菌CWI-MAPK級联途径中StBCK1基因功能的研究[D]. 保定:河北农业大学,2012:10-13.
[55]Pan J W,Zhang M Y,Kong X P,et al. ZmMPK17,a novel maize group D MAP kinase gene,is involved in multiple stress responses[J]. Planta,2012,235(4):661-676.
[56]Wei J P,Wang X D,Hu Z Y,et al. The Puccinia striiformis effector Hasp98 facilitates pathogenicity by blocking the kinase activity of wheat TaMAPK4[J]. Journal of Integrative Plant Biology,2023,65(1):249-264.
[57]Yamamizo C,Kuchimura K,Kobayashi A,et al. Rewiring mitogen-activated protein kinase cascade by positive feedback confers potato blight resistance[J]. Plant Physiology,2006,140(2):681-692.
[58]Du Y,Chen X K,Guo Y L,et al. Phytophthora infestans RXLR effector PITG20303 targets a potato MKK1 protein to suppress plant immunity[J]. The New Phytologist,2021,229(1):501-515.
[59]Chen X K,Wang W B,Cai P P,et al. The role of the MAP kinase-kinase protein StMKK1 in potato immunity to different pathogens[J]. Horticulture Research,2021,8:117.
[60]Zhang H X,Li F F,Li Z Z,et al. Potato StMPK7 is a downstream component of StMKK1 and promotes resistance to the oomycete pathogen Phytophthora infestans[J]. Molecular Plant Pathology,2021,22(6):644-657.
[61]Virk N,Liu B,Zhang H J,et al. Tomato SlMPK4 is required for resistance against Botrytis cinerea and tolerance to drought stress[J]. Acta Physiologiae Plantarum,2013,35(4):1211-1221.
[62]刘 杰. 马铃薯种质资源的晚疫病抗性评价及转录组分析[D]. 呼和浩特:内蒙古农业大学,2019:1-15.
[63]Majeed Y,Zhu X,Zhang N,et al. Functional analysis of mitogen-activated protein kinases (MAPKs) in potato under biotic and abiotic stress[J]. Molecular Breeding,2022,42(6):31.
[64]Zhai N,Jia H H,Liu D D,et al. GhMAP3K65,a cotton raf-like MAP3K gene,enhances susceptibility to pathogen infection and heat stress by negatively modulating growth and development in transgenic Nicotiana benthamiana[J]. International Journal of Molecular Sciences,2017,18(11):2462.
[65]Wang C,He X W,Li Y Z,et al. The cotton MAPK kinase GhMPK20 negatively regulates resistance to Fusarium oxysporum by mediating the MKK4-MPK20-WRKY40 cascade[J]. Molecular Plant Pathology,2018,19(7):1624-1638.
[66]Shan D Q,Wang C Y,Zheng X D,et al. MKK4-MPK3-WRKY17-mediated salicylic acid degradation increases susceptibility to Glomerella leaf spot in apple[J]. Plant Physiology,2021,186(2):1202-1219.
[67]鄭 婷. 葡萄伤流期树液成分鉴定及其抗病功能研究[D]. 南京:南京农业大学,2019:15-31.
[68]Wang G,Lovato A,Polverari A,et al. Genome-wide identification and analysis of mitogen activated protein kinase kinase kinase gene family in grapevine (Vitis vinifera)[J]. BMC Plant Biology,2014,14:219.
[69]王 刚. 葡萄MAPK类基因家族的鉴定、表达分析及部分基因的功能验证[D]. 南京:南京农业大学,2014:65-115.
[70]雷 龑,陈 婷,刘鑫铭,等. 刺葡萄VdMAPK7参与炭疽病胁迫响应的功能分析[J]. 果树学报,2022,39(11):2036-2045.
[71]Wang Z,Jia C H,Li J P,et al. Identification of six mitogen-activated protein kinase (MAPK) genes in banana (Musa acuminata L. AAA group,cv.Cavendish) under infection of Fusarium Oxysporum f.sp cubense Tropical Race 4[J]. Acta Physiologiae Plantarum,2015,37(6):115.
[72]Zhang Z,Jia L T,Chen Q M,et al. Genome-wide identification of the mitogen-activated protein kinase kinase kinase (MAPKKK) in pear (Pyrus bretschneideri) and their functional analysis in response to black spot[J]. Planta,2023,257(1):5.
[73]Zhao L N,Shu Y L,Quan S H,et al. Screening and regulation mechanism of key transcription factors of Penicillium expansum infecting postharvest pears by ATAC-seq analysis[J]. Foods,2022,11(23):3855.
[74]Xu Y,Shang K J,Wang C C,et al. WIPK-NtLTP4 pathway confers resistance to Ralstonia solanacearum in tobacco[J]. Plant Cell Reports,2022,41(1):249-261.
[75]Tajti J,Németh E,Glatz G,et al. Pattern of changes in salicylic acid- induced protein kinase (SIPK) gene expression and salicylic acid accumulation in wheat under cadmium exposure[J]. Plant Biology,2019,21(6):1176-1180.
[76]Melech-Bonfil S,Sessa G.Tomato MAPKKKε is a positive regulator of cell-death signaling networks associated with plant immunity[J]. The Plant Journal,2010,64(3):379-391.
[77]Kandoth P K,Ranf S,Pancholi S S,et al. Tomato MAPKs LeMPK1,LeMPK2,and LeMPK3 function in the systemin-mediated defense response against herbivorous insects[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(29):12205-12210.
[78]Gao J,Cao M N,Ye W W,et al. PsMPK7,a stress-associated mitogen-activated protein kinase (MAPK) in Phytophthora sojae,is required for stress tolerance,reactive oxygenated species detoxification,cyst germination,sexual reproduction and infection of soybean[J]. Molecular Plant Pathology,2015,16(1):61-70.
[79]Ferrusquía-Jiménez N I,Serrano-Jamaica L M,Martínez-Camacho J E,et al. Extracellular self-DNA plays a role as a damage-associated molecular pattern (DAMP) delaying zoospore germination rate and inducing stress-related responses in Phytophthora capsici[J]. Plant Pathology,2022,71(5):1066-1075.
[80]王淑霞. 木霉誘导黄瓜对灰霉病的系统抗性及其机理研究[D]. 石家庄:河北师范大学,2012:11-53.
[81]Xiao X O,Lin W Q,Feng E Y,et al. Genome-wide identification of binding sites for SmTCP7a transcription factors of eggplant during bacterial wilt resistance by ChIP-seq[J]. International Journal of Molecular Sciences,2022,23(12):6844.
[82]Jiang S F,Zheng W W,Li Z W,et al. Enhanced resistance to Sclerotinia sclerotiorum in Brassica rapa by activating host immunity through exogenous Verticillium dahliae Aspf2-like protein (VDAL) treatment[J]. International Journal of Molecular Sciences,2022,23(22):13958.
[83]崔 雯,白雪松,王 建,等. 脱落酸调控与植物抗病相关次生代谢产物生物合成的研究进展[J]. 植物医学,2022,1(6):1-11.

