ST段抬高型心肌梗死后心力衰竭病人血清Gal-3和sST2水平变化及其与超声心动图参数的相关性分析
周文杰 曹勇 丁晓云

摘要 目的:探讨ST段抬高型心肌梗死后心力衰竭病人血清半乳糖凝集素3(Gal-3)和可溶性生长刺激表达基因2蛋白(sST2)水平变化及其与超声心动图参数的相关性。方法:选取2020年1月—2022年1月我院收治的ST段抬高型心肌梗死病人,将其中并发心力衰竭102例纳入A组,未并发心力衰竭101例纳入B组。另外选取同期于我院健康体检者30名纳入C组。采用超声心动图测定心功能,酶联免疫吸附法检测3组血清Gal-3、sST2水平。比较3组血清Gal-3、sST2水平差异,分析其与ST段抬高型心肌梗死后心力衰竭病人心力衰竭程度及超声心动图参数的关系。结果:3组血清Gal-3、sST2水平比较,差异有统计学意义(P<0.001);A组血清Gal-3、sST2水平高于B组、C组,B组血清Gal-3、sST2水平高于C组,差异有统计学意义(P<0.05)。血清Gal-3、sST2联合评估ST段抬高型心肌梗死后心力衰竭发生的受试者工作特征(ROC)曲线下面积为0.896,高于Gal-3、sST2单独检测曲线下面积0.801,0.797(P<0.05)。不同心功能分级病人血清Gal-3、sST2水平比较,差异有统计学意义(P<0.001);Killip分级Ⅳ级组血清Gal-3、sST2水平高于Ⅱ级组、Ⅲ级组,Ⅲ级组血清Gal-3、sST2水平高于Ⅱ级组,差异有统计学意义(P<0.05)。ST段抬高型心肌梗死后心力衰竭病人血清Gal-3、sST2与Killip分级呈正相关(P<0.05)。A组左室舒张末期内径(LVEDD)、左室舒张末期室间隔厚度(IVST)高于B组,左室射血分数(LVEF)、左室短轴缩短率(LVFS)低于B组(P<0.05)。Pearson相关性分析结果显示:ST段抬高型心肌梗死后心力衰竭病人血清Gal-3、sST2水平与超声心动图参数LVEDD、IVST呈正相关(P<0.05),与LVEF、LVFS呈负相关(P<0.05)。结论:ST段抬高型心肌梗死后心力衰竭病人血清Gal-3、sST2呈高表达,其表达水平与病人心力衰竭程度呈正相关,血清Gal-3、sST2与超声心动图参数LVEDD、IVST呈正相关,与LVEF、LVFS呈负相关。
关键词 ST段抬高型心肌梗死;心力衰竭;半乳糖凝集素3;可溶性生长刺激表达基因2;超声心动图参数;相关性
doi:10.12102/j.issn.1672-1349.2024.05.025
基金项目 2021年度南通市卫生健康委员会科研项目(No.MB2021084)
作者单位 如皋市人民医院(江苏如皋 226500),E-mail:zzz555123@126.com
引用信息 周文杰,曹勇,丁晓云.ST段抬高型心肌梗死后心力衰竭病人血清Gal-3和sST2水平变化及其与超声心动图参数的相關性分析[J].中西医结合心脑血管病杂志,2024,22(5):903-906.
心肌梗死是导致心力衰竭的主要原因之一,心力衰竭病人中70%以上患有心肌梗死,心肌梗死后冠状动脉供血急剧减少、中断,使其供血范围内的心肌急性缺血,发生心肌梗死,梗死后局部心肌收缩功能减低甚至消失,在心室腔压力下,梗死区心室壁变薄、扩张、膨出,引起心腔改变[1]。正常心肌受损后激活多种神经内分泌因子,心肌细胞病理性肥大,促使心肌细胞凋亡,细胞外基质过度纤维化等一系列心肌重构的发生,进而引起心室形态改变,心室收缩、心功能受损,同时恶化的心功能又进一步促进神经内分泌因子的释放,形成恶性循环,最终导致心力衰竭发生[2]。心肌梗死后心力衰竭病人心肌受损,通过血清标志物可早期识别和诊断,及时评估病情,并予以干预,有利于改善预后。半乳糖凝集素-3(galectin-3,Gal-3)属于半乳糖凝集素家族,是体内一种稳定标志物,既往研究显示,Gal-3参与心肌损害、心血管重构及各类自身免疫与炎症反应过程[3]。可溶性生长刺激表达基因2(sST2)属于心肌细胞应激标志物,心肌细胞受到某些刺激时,如缺血缺氧再灌注等情况,可迅速高表达[4]。本研究分析ST段抬高型心肌梗死后心力衰竭病人血清Gal-3和sST2水平变化及其与心力衰竭程度及超声心动图参数的关系,旨在为ST段抬高型心肌梗死后心力衰竭的诊断与治疗提供参考。
1 资料与方法
1.1 临床资料
选取2020年1月—2022年1月我院收治的ST段抬高型心肌梗死病人,其中并发心力衰竭102例纳入A组,未并发心力衰竭101例纳入B组。A组,男53例,女49例;年龄44~79(61.72±7.70)岁;植入支架1~3(1.89±0.40)个;梗死部位:高侧壁梗死36例,前间壁梗死10例,前壁梗死17例,下壁梗死39例。B组,男51例,女50例;年龄45~78(60.95±8.02)岁;植入支架1~3(1.82±0.39)个;梗死部位:高侧壁梗死34例,前间壁梗死11例,前壁梗死16例,下壁梗死40例。另外选取同期于我院健康体检者30名纳入C组,其中男16名,女14名;年龄44~79(60.40±7.55)岁。3组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究获得医院伦理委员会批准,研究对象均签署知情同意书。
纳入标准:符合中华医学会心血管病学分会《急性ST段抬高型心肌梗死诊断和治疗指南》[5]中ST段抬高型心肌梗死的诊断标准;冠状动脉造影显示1支以上冠状动脉血管狭窄>50%;年龄18~80岁;本研究经医院伦理委员会批准,病人及家属知情同意。排除标准:急性创伤所致胸痛;合并心脏瓣膜疾病;合并主动脉夹层、肺栓塞等导致的胸痛;合并结缔组织疾病、类风湿性关节炎等;心肌炎、心脏瓣膜病、内分泌疾病等导致的心力衰竭;恶性肿瘤病人;慢性阻塞性肺疾病急性加重期;合并未控制的感染。
1.2 心力衰竭诊断及严重程度评估标准
参照《中国心力衰竭诊断和治疗指南2018》[6],具有心力衰竭症状和体征:肺循环、体循环淤血、低灌注、心源性休克、呼吸衰竭;血浆氨基末端脑钠肽前体呈高表达,符合以下任1项及以上:1)左心室肥厚或/和左心房扩大;2)心脏舒张异常。Killip分级:Ⅰ级无心力衰竭症状与体征;Ⅱ级存在心力衰竭症状与体征,50%以下肺野湿啰音,第三心音奔马律;Ⅲ级为严重心力衰竭症状与体征,肺水肿严重,50%以上肺野湿啰音;Ⅳ级为心源性休克。
1.3 观察指标
1.3.1 超声心动图测量
采用GE VIVID E9彩色多普勒超声对A组与B组病人进行测量,实时三维心脏探头,频率1.0~4.0 MHz。检查前,连接心电图,病人左侧卧位,屏气,full-volume模式采集图像,测定左室舒张末期内径(LVEDD)、左室舒张末期室间隔厚度(IVST)、左室射血分数(LVEF)、左室短轴缩短率(LVFS)。
1.3.2 血清sST2、Gal-3水平检测
真空采血管采集所有研究对象空腹静脉血5 mL,以3 000 r/min离心10 min,血清分离,置于EP管中,在-80 ℃冰箱保存,采用酶联免疫吸附法检测血清sST2、Gal-3 水平,试剂盒购自杭州联科生物技术有限公司。
1.4 统计学处理
采用SPSS 20.0统计软件进行数据分析,符合正态分布的定量资料以均数±标准差(x±s)表示,多组间比较采用F检验,两组间比较采用独立样本t检验;定性资料以例数、百分比(%)表示,采用χ2检验。使用受试者工作特征曲线(receiver operating characteristics,ROC)评估诊断效能,采用Pearson或Spearman法进行相关性分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 3组血清Gal-3、sST2水平比较
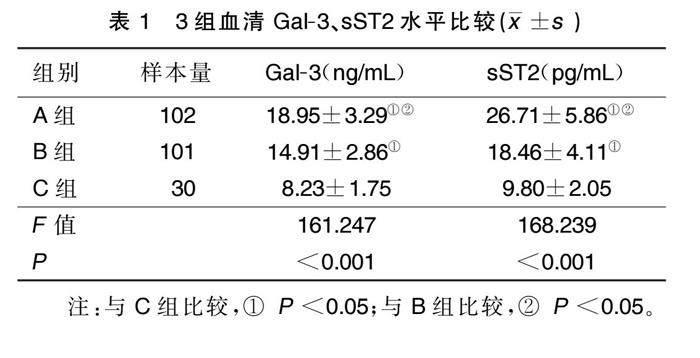
3组血清Gal-3、sST2水平比较,差异有统计学意义(P<0.001);A组血清Gal-3、sST2水平高于B组、C组,B组血清Gal-3、sST2水平高于C组,差异有统计学意义(P<0.05)。详见表1。
2.2 血清Gal-3、sST2诊断ST段抬高型心肌梗死病人心力衰竭发生的临床效能
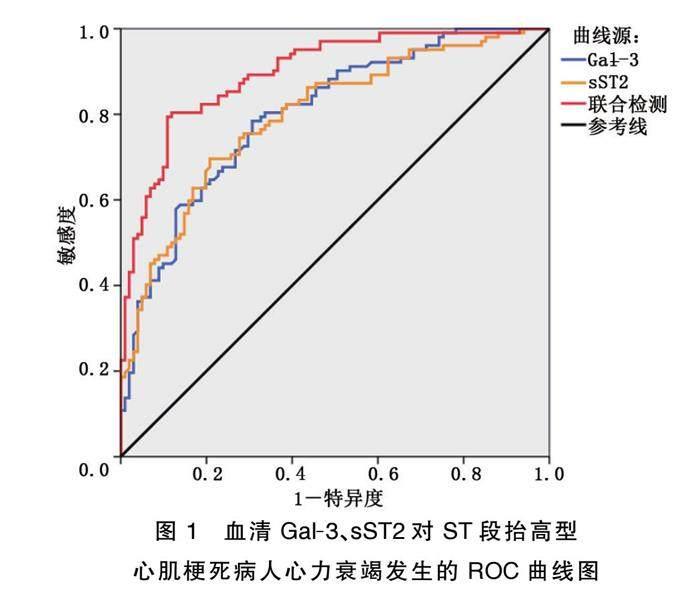
血清Gal-3、sST2联合评估ST段抬高型心肌梗死病人发生心力衰竭的ROC曲线下面积(AUC)为0.896,高于各指标单独检测曲线下面积0.801,0.797(P<0.05)。详见表2、图1。
2.3 不同心功能分级ST段抬高型心肌梗死后心力衰竭病人血清Gal-3、sST2水平比较
不同心功能分级病人血清Gal-3、sST2水平比较,差异有统计学意义(P<0.001);Killip分级Ⅳ级组血清Gal-3、sST2水平高于Ⅱ级组、Ⅲ级组,Ⅲ级组血清Gal-3、sST2水平高于Ⅱ級组,差异有统计学意义(P<0.05)。Spearman相关性分析结果显示ST段抬高型心肌梗死后心力衰竭病人血清Gal-3、sST2与Killip分级呈正相关(r值分别为0.416,0.387,P<0.05)。详见表3。
2.4 A组与B组超声心动图参数比较
A组LVEDD、IVST高于B组,LVEF、LVFS低于B组,差异有统计学意义(P<0.05)。详见表4。
2.5 ST段抬高型心肌梗死后心力衰竭病人血清Gal-3、sST2与超声心动图参数的相关性
Pearson相关性分析结果显示:ST段抬高型心肌梗死后心力衰竭病人血清Gal-3、sST2水平与超声心动图参数LVEDD、IVST呈正相关(P<0.05),与LVEF、LVFS呈负相关(P<0.05)。详见表5。
3 讨 论
心肌梗死发病急骤,冠状动脉闭塞引起心肌组织血供中断,导致心肌缺血严重,左室收缩舒张功能损害,因此常伴发心力衰竭[7]。急性心力衰竭是急性心肌梗死院内的常见并发症,严重时导致病人休克,疾病发生后,病人病情危重,预后较差。
Gal-3参与机体多种生理与病理过程,促进巨噬细胞迁移、成纤维细胞增殖、胶原合成,其高表达是成纤维细胞、巨噬细胞活化的象征,也是心室重构的重要标志之一[8]。本研究结果显示,3组血清Gal-3、sST2水平比较,差异有统计学意义(P<0.001);A组血清Gal-3、sST2水平高于B组、C组,B组血清Gal-3、sST2水平高于C组,差异有统计学意义(P<0.05)。相较于健康人群,心肌梗死病人血清Gal-3水平升高,心肌梗死的发生、发展与炎症反应关系密切,血清炎性因子水平与病程相关。Gal-3作为炎症信号,介导血管壁损害,巨噬细胞是Gal-3的主要来源,Gal-3反之又刺激巨噬细胞生成大量促炎和趋化因子;Gal-3可激活还原型辅酶Ⅱ,刺激超氧化物生成,激发中性粒细胞呼吸链,加重组织缺血和再灌注损伤,促进病变血管进一步损伤[9-10]。心肌梗死并发心力衰竭病人血清Gal-3表达水平升高,血清Gal-3评估ST段抬高型心肌梗死病人心力衰竭发生的AUC为0.801,具有较高的评估价值。Gal-3在心肌梗死后心肌纤维化、心室重构中发挥着重要作用,促进梗死后心力衰竭发生发展过程。
本研究采用Killip分级评估病人心力衰竭程度,结果显示,随着疾病程度增加,病人血清Gal-3表达水平升高,二者呈正相关,进一步表明Gal-3在心肌梗死后心力衰竭进展中发挥着重要作用。超声心动图是一种可重复操作的心脏功能检查方式,本研究中ST段抬高型心肌梗死后心力衰竭病人Gal-3水平与超声心动图参数LVEDD、IVST呈正相关,与LVEF、LVFS呈负相关。心肌梗死后心力衰竭涉及多条神经内分泌通路和机体代偿,心功能越低提示心脏舒张、收缩功能越差,从而增加心脏负荷,加重心肌重构,Gal-3合成和分泌增加,病人超声心动图参数表现为LVEDD、IVST升高、LVEF、LVFS降低[11]。
生长刺激表达基因2(growth stimulation expressed gene 2,ST2)分为跨膜型形式(ST2L)、可溶性形式(sST2),直接参与心血管疾病发生、发展。sST2在机械应力诱导下,由心肌细胞生成,参与心室重构、间质纤维化调控[12]。党璋等[13]研究显示,急性心肌梗死病人血清sST2水平升高,且与梗死面积、心室功能有相关。同时本研究结果显示,ST段抬高型心肌梗死病人血清sST2表达水平高于健康人群,急性心肌梗死发生后,心肌缺血缺氧,超负荷下引起心肌重构,促进机体生成sST2。血清sST2评估ST段抬高型心肌梗死病人心力衰竭发生的AUC为0.797。心肌细胞过度收缩或拉伸,诱导白细胞介素(IL)-33生成,IL-33是ST2L功能性配体,可拮抗血管緊张素Ⅱ、去甲肾上腺素,介导心肌肥厚。心脏压力增大时,IL-33/ST2L信号通路发挥保护作用使心脏免受损害,但sST2可对上述信号通路造成干扰,sST2中和IL-33,阻断ST2L和IL-33结合,减弱IL-33/ST2L信号通路的心肌细胞保护作用,引起心肌重构,加重心力衰竭。
本研究中ST段抬高型心肌梗死后心力衰竭病人血清sST2表达水平与Killip分级呈正相关,sST2表达升高,竞争性结合IL-33,负反馈调节IL-33/ST2L通路,拮抗心脏保护效应,促进心肌细胞凋亡、心肌纤维化、心室功能障碍,加速心功能恶化[14]。本研究中ST段抬高型心肌梗死后心力衰竭病人sST2水平与超声心动图参数LVEDD、IVST呈正相关,与LVEF、LVFS呈负相关。既往研究显示,ST2基因敲除导致严重心肌肥厚与间质纤维化,抗sST2抗体抑制sST2可减弱心肌肥厚、间质纤维化[15]。
综上所述,ST段抬高型心肌梗死后心力衰竭病人血清Gal-3、sST2呈高表达,其表达水平与病人心力衰竭程度呈正相关,血清 Gal-3、sST2与超声心动图参数LVEDD、IVST呈正相关,与LVEF、LVFS呈负相关。检测Gal-3、sST2有助于ST段抬高型心肌梗死后心力衰竭疾病诊断和病人病情评估。
参考文献:
[1] NAZIR S,MINHAS A M K,KAMAT I S,et al.Patient characteristics and outcomes of type 2 myocardial infarction during heart failure hospitalizations in the United States[J].The American Journal of Medicine,2021,134(11):1371-1379.
[2] LI C,XIA W,WANG L,et al.Effect of renal denervation on cardiac function and inflammatory factors in heart failure after myocardial infarction[J].Journal of Cardiovascular Pharmacology,2020,76(5):602-609.
[3] 张建新,郝同琴,石金河,等.慢性心力衰竭患者血清超敏C反应蛋白、胱抑素C、半乳糖凝集素-3水平变化与急性心力衰竭发作的关系[J].中国老年学杂志,2017,37(16):3965-3966.
[4] NAH E H,CHO S,KIM S,et al.Reference interval and the role of soluble suppression of tumorigenicity 2(sST2) in subclinical cardiac dysfunction at health checkups[J].Journal of Clinical Laboratory Analysis,2020,34(11):e23461.
[5] 中华医学会心血管病学分会,中华心血管病杂志编辑委员会.急性ST段抬高型心肌梗死诊断和治疗指南(2019)[J].中华心血管病杂志,2019,47(10):766-783.
[6] 中华医学会心血管病学分会心力衰竭学组,中国医师协会心力衰竭专业委员会,中华心血管病杂志编辑委员会,等.中国心力衰竭诊断和治疗指南2018[J].中华心血管病杂志,2018,46(10):760-789.
[7] WANG D D,LV L Y,XU Y,et al.Cardioprotection of Panax Notoginseng saponins against acute myocardial infarction and heart failure through inducing autophagy[J].Biomedicine & Pharmacotherapy,2021,136:111287.
[8] FENTON-NAVARRO B,GARDUO ROS D,TORNER L,et al.Melatonin decreases circulating levels of galectin-3 and cytokines,motor activity,and anxiety following acute global cerebral ischemia in male rats[J].Archives of Medical Research,2021,52(5):505-513.
[9] XU G R,ZHANG C,YANG H X,et al.Modified citrus pectin ameliorates myocardial fibrosis and inflammation via suppressing galectin-3 and TLR4/MyD88/NF-κB signaling pathway[J].Biomedecine & Pharmacotherapie,2020,126:110071.
[10] JERING K S,CLAGGETT B,PFEFFER M A,et al.Prospective ARNI vs ACE inhibitor trial to determine superiority in reducing heart failure events after myocardial infarction(PARADISE-MI):design and baseline characteristics[J].European Journal of Heart Failure,2021,23(6):1040-1048.
[11] 徐晶,白净,邢玉洁,等.左西孟旦合曲美他嗪对心衰介入治疗术后患者血清galectin-3和syndecan-4表达水平及心功能的影响[J].现代生物医学进展,2021,21(24):4747-4750;4764.
[12] ZHANG Y,FAN Z X,LIU H,et al.Correlation of plasma soluble suppression of tumorigenicity-2 level with the severity and stability of coronary atherosclerosis[J].Coronary Artery Disease,2020,31(7):628-635.
[13] 党璋,吴琼,王娟,等.GDF-15、sST2及cTnI在急性心肌梗死患者中的表达及其对预后的预测价值研究[J].临床误诊误治,2021,34(2):49-53.
[14] ZHAO Y N,LI H,ZHAO C,et al.ST2 silencing aggravates ventricular remodeling and chronic heart failure in rats by mediating the IL-33/ST2 axis[J].Journal of Tissue Engineering and Regenerative Medicine,2020,14(9):1201-1212.
[15] OPINC A,SARNIK J,BRZEZISKA O,et al.Interleukin-33/suppression of tumorigenicity 2(IL-33/ST2) axis in idiopathic inflammatory myopathies and its association with laboratory and clinical parameters:a pilot study[J].Rheumatology International,2020,40(7):1133-1141.
(收稿日期:2022-06-18)
(本文編辑薛妮)

