SGLT2抑制剂对射血分数保留的心力衰竭的保护作用及机制研究进展
高棣英 吴铿
【摘要】心力衰竭(心衰)是心血管疾病发展的终末阶段和主要死因,其患病率、再住院率、病死率均较高,防治难度极大。其中射血分数保留的心力衰竭(HFpEF)是心衰的主要类型,目前约占心衰总患病人数的50%,在65岁以上人群中超过70%。随着新型抗心衰药物的出现,射血分数降低的心力衰竭患者的再住院率和死亡率逐渐降低,但HFpEF仍面临治疗困境。据报道,钠-葡萄糖共转运蛋白2抑制剂可独立作用于心脏,并通过多种机制治疗心衰患者,但其提供临床益处的生物学机制尚未完全阐明。
【关键词】心力衰竭;射血分数保留的心力衰竭;钠-葡萄糖共转运蛋白2抑制剂
【DOI】10.16806/j.cnki.issn.1004-3934.2024.03.008
Protective Effect and Mechanism of SGLT2 Inhibitor on Heart Failure with Preserved Ejection Fraction
GAO Diying,WU Keng
(The Affiliated Hospital of Guangdong Medical University,Zhanjiang 524001,Guangdong,China)
【Abstract】Heart failure is the terminal stage and the main cause of death in the development of cardiovascular disease,with a high prevalence rate,rehospitalization rate and mortality rate,making the prevention and treatment extremely difficult.Among them,heart failure with preserved ejection fraction(HFpEF) is the main type of heart failure,accounting for about 50% of the total number of heart failure,and more than 70% of people over 65 years old.With the emergence of new anti-heart failure drugs,the patients rehospitalization rate and mortality rate of heart failure with reduced ejection fraction have gradually decreased,but HFpEF still faces a treatment dilemma.It has been reported that sodium-glucose co-transporter 2 inhibitor act independently on the heart,and treat heart failure patients through multiple mechanisms,but the biological mechanisms that provide clinical benefits have not been fully elucidated.
【Keywords】Heart failure;Heart failure with preserved ejection fraction;Sodium-glucose co-transporter 2 inhibitor
心血管疾病負担日益加重,已成为全球严重的公共健康问题。最新资料[1]显示,中国约有3.3亿人受到心血管疾病影响,其中心力衰竭(心衰)患者约890万。年龄≥35岁人群中心衰患病率约1.3%;年龄≥25岁人群中心衰患病率约1.1%,1年全因死亡率为8.5%[2]。射血分数保留的心衰(heart failure with preserved ejection fraction,HFpEF)是由高血压、衰老和肥胖等高危因素作用于心脏而导致,这些高危因素的发生率在增加,因此预计未来HFpEF发病率会上升[3]。钠-葡萄糖共转运蛋白2(sodium-glucose co-transporter 2,SGLT2)抑制剂在心衰治疗中具有很好的临床疗效,现就SGLT2抑制剂对HFpEF的保护作用及机制予以综述。
1 SGLT2抑制剂概述
SGLT2抑制剂最初为治疗2型糖尿病而研发,主要是通过抑制近曲肾小管中的SGLT2,减少肾葡萄糖的重吸收,以达到降糖作用。DAPA-HF试验[4]是SGLT2抑制剂在心衰治疗领域的第一次革命性突破。该研究纳入4 744例左室射血分数(left ventricular ejection fraction,LVEF)≤40%的心衰患者[LVEF<26%(n=1 143),LVEF 26%~30%(n=1 018),LVEF 31%~35%(n=1 187),LVEF>35%(n=1 396)],将患者随机分配至达格列净组(10 mg/d)或安慰剂组,中位随访时间为18.2个月。该研究发现基线LVEF每降低5个点,心血管死亡风险增加20%,心衰住院风险增加20%,全因死亡风险增加13%,但达格列净对射血分数降低的心衰(heart failure with reduced ejection fraction,HFrEF)总体死亡率、发病率结局或症状的有利影响在整个LVEF≤40%的范围内是一致的。DELIVER试验[5]共纳入6 263例LVEF>40%的心衰患者,中位随访时间2.3年。该研究发现达格列净组的主要终点事件(心衰恶化和心血管死亡)、心衰恶化和心血管死亡风险较安慰剂组分别降低了18%、21%和12%。Ismayl等[6]的一项研究纳入15 989例LVEF>40%的患者,该研究同样发现恩格列净治疗显著降低了HFpEF患者住院或心血管死亡的联合风险。目前多项研究共同表明SGLT2抑制剂不仅对HFrEF有显著疗效,对HFpEF同样有相似的疗效。由此认为,心衰患者应及早使用SGLT2抑制剂,以便更有效地降低病死率和住院率,更好地缓解患者症状。
2 SGLT2抑制剂在HFpEF患者中潜在的作用机制
2.1 改善肾脏结局
估算肾小球滤过率降低或蛋白尿增多等肾功能不全在HFpEF患者中非常常见,并通常与不良心脏重构和轻微收缩功能障碍有关。肾脏调节水和盐平衡,也是利尿钠肽和肾素-血管紧张素-醛固酮系统的下游靶器官。另外,肾功能衰竭后,各种有毒代谢产物在体内蓄积可损害心脏,引起或加重心衰。综上所述,肾脏保护很可能是SGLT2抑制剂治疗HFpEF患者的关键作用之一。Cao等[7]对6项包含2 167例参与者的试验分析结果显示,在晚期慢性肾脏病患者中,SGLT2抑制剂将主要肾脏结局(肾功能恶化、终末期肾病或肾脏死亡)的风险降低了23%,并减缓估算肾小球滤过率的年下降速度。同时也降低了复合心血管死亡率或因心衰住院率,这与DAPA-CKD试验结论相一致[8]。同样,既往相关研究[9]也证实SGLT2抑制剂可阻断钠在近端小管中的重吸收,使流经远端致密斑中的钠浓度增加,使异常的肾小管-肾小球反馈得以恢复,有助于降低肾小球高滤过率和肾小球内压,缓解高蛋白尿和慢性缺氧状态,有利于肾小球的保护。目前除血管紧张素转化酶抑制剂和血管紧张素Ⅱ受体阻滞剂,很少有药物被证明可减缓慢性肾脏病的进展及降低生存率。上述研究发现SGLT2抑制剂降低了慢性肾脏病患者的几种重要临床结果的风险,这是一个突破,未来可根据该研究的结果进行更深入的探讨。
2.2 改善钠水潴留
血浆容量扩张被认为是HFpEF患者的主要病理生理机制,其中容量扩张与右心扩张和心脏总容量增加有关,导致心包受限性增加及心室相互作用加强,左心室充盈压增高,舒张能力减弱[10]。Griffin等[11]对20例心衰患者进行恩格列净与安慰剂对照交叉研究,结果发现恩格列净单药治疗显著增加钠排泄分数,且恩格列净利钠作用持续存在,导致血容量和血浆容量显著下降,但未显著升高尿渗透压,提出恩格列净的利钠作用不是由尿葡萄糖负荷驱动的,表现为直接利钠作用,降低心脏前后负荷,缓解心衰进展。但该研究数据少,追踪时间短,并不能反映长期结局。同样,Shiina等[12]对一项纳入233例患者(约70%为HFpEF)的多中心前瞻性试验分析发现与格列美脲相比,卡格列净显著降低了两组患者的血浆容量,但肾功能无恶化。上述研究均证实SGLT2抑制剂可通过降低心衰患者心脏负荷,达到保护心脏的作用。
2.3 改善心室舒张功能
HFpEF的主要特征是舒张功能障碍。因此,改善舒张功能应是HFpEF患者的最终治疗策略。越来越多证据表明SGLT2抑制剂可能针对舒张功能障碍有较好疗效。Sakai等[13]对某三级医院184例HFpEF患者进行前瞻性研究,分别接受恩格列净、鲁格列净或托格列净治疗12周。该研究发现SGLT2抑制剂短期治疗改善了心室舒张功能,并提出这可能与胰岛素抵抗的改善和一氧化氮(nitric oxide,NO)产生的增加有关。另外,Shim等[14]纳入60例左心室舒张功能不全患者给予达格列净治疗24周,结果也发现达格列净组患者左心室舒张储备显著改善。Connelly等[15]和Moellmann等[16]在HFpEF的啮齿动物研究模型中同样发现恩格列净显著改善了心室增加的壁应力和受损的舒张功能,降低了心衰死亡率,并提出舒张功能的改善可能是由自发性舒张肌质网钙释放减少介导的。上述研究均证实SGLT2抑制剂可改善HFpEF患者心室舒张功能,更好地证实了SGLT2抑制剂对HFpEF独特的疗效,为心衰治疗提供了新的重要信息。但上述研究对于改善心室舒张功能的机制未作详细阐述,需进一步研究来评估晚期治疗是否也可能逆转HFpEF已建立的异常结构和功能。
2.4 调节氧化应激
氧化应激与HFpEF及其相关合并症的发展密切相关。冠状动脉微血管内皮功能障碍导致心肌蛋白激酶G(protein kinase G,PKG)活性和NO生物利用度下降,造成左心室重塑及功能异常,最终可导致HFpEF[17]。Kolijn等[18]在HFpEF患者左心室的活检中发现,恩格列净(0.5 μmol/L)治疗1 h后显著降低了炎症因子(细胞间黏附分子、血管细胞间黏附分子、肿瘤坏死因子-α和白细胞介素-6)和氧化参数(H2O2、3-硝基酪氨酸、谷胱甘肽和过氧化脂质),并通过减少PKGⅠa氧化和聚合来逆转NO-sGC-cGMP-PKG途径,导致NO利用度增加和PKG活性增强,消除病理性心脏僵硬,从而改善人心肌舒张功能。同样,Kondo等[19]在364例心脏手术患者中获取右心耳组织进行分析,首次发现卡格列净可能通过SGLT1/AMPK/Rac1信号通路抑制心肌NADPH氧化酶活性,改善NO合酶复偶联,从而在人心肌中产生抗炎和抗凋亡作用,揭示了卡格列净作用于心臟治疗的新机制。目前HFpEF患者的治疗选择非常有限,但上述研究强调了调节氧化应激对HFpEF疗效的重要性。因此,这些研究结果可能会鼓励未来进一步的研究,探索更具体的方法来有效治疗HFpEF患者。
2.5 优化心脏能量代谢
代谢性HFpEF的发展与能量平衡的破坏密切相关。因此,心脏代谢的改变在HFpEF的进展中至关重要。正常心脏中,葡萄糖和脂肪酸氧化贡献约90%的ATP。当脂肪酸和葡萄糖氧化受损时,心脏能量代谢向酮体代谢转变已被证实是产生更多ATP的高效替代途径[20]。相关研究[21]发现SGLT2抑制剂可促进心肌氧释放以及通过增加葡萄糖在肾脏中的流失,模拟饥饿状态,诱导衰竭心肌中支链氨基酸降解,提高脂肪酸和酮体水平,为心肌细胞提供充足燃料。Li等[22]对雄性小鼠的研究发现恩格列净显著增加了小鼠心脏中葡萄糖和脂肪酸氧化,最终增加了小鼠心脏中总ATP的产生。该研究还发现恩格列净是直接结合葡萄糖转运蛋白以减少葡萄糖摄取和糖酵解,重新平衡心肌氧化磷酸化,从而增强衰竭心脏的心肌细胞钙瞬变和收缩力。同样,刘海浪等[23]纳入结扎冠状动脉大鼠,喂服达格列净后取心脏组织进行研究。该研究发现两组大鼠心脏形态、功能及微RNA表达均存在显著差异,并提出猜想,达格列净可能通过微RNA调控心肌细胞的能量代谢,改善心脏预后。综上所述,能量代谢在HFpEF发展中的地位很重要,而SGLT2抑制剂可能通过多种途径在这方面使患者获益。SGLT2抑制剂改善心衰结局的确切机制仍是进一步研究的重要领域。
2.6 抗炎和抗纤维化
间质纤维化、心肌炎症是HFpEF的常见因素,二者都与舒张功能受损有关。另外,M1型巨噬细胞是促炎细胞,M2型巨噬细胞可抗炎,因此M2型巨噬细胞向M1型巨噬细胞转变也被认为是HFpEF患者心室重塑的主要因素之一[24]。Lee等[25]对心肌梗死大鼠进行研究,结果发现达格列净组M2型巨噬细胞的百分比增加了4.5倍并显著提高了M2/M1比值。该研究还提出,SGLT2抑制剂可能通过活性氮氧化物/信号转导及转录激活因子3依赖性途径使巨噬细胞由M1型向M2型转变达到抗炎及抗纤维化作用。同样Abdollahi等[26]的研究也提出达格列净通过抑制内皮细胞中Toll样受体4的过表达和核因子κB活化,调节巨噬细胞极化为抗炎M2表型。另外,Kang等[27]获取心房成纤维细胞,暴露于不同浓度恩格列净72 h,结果发现暴露在恩格列净的肌成纤维细胞体积更小,长度更短,延伸次数更少。此外,关键促纤维化标志物(Ⅰ型胶原蛋白α1、α肌动蛋白2、结缔组织生长因子、纤连蛋白1和基质金属蛋白酶2)也受到显著抑制。同样,Lee等[28]对HFpEF动物的研究也发现恩格列净显著减轻了胶原沉积和心脏组织中的纤维化。总体而言,SGLT2抑制剂可能通过多种途径达到抗炎、抗纤维化及抗病理性重构的目的。心脏炎症和纤维化可最终导致左心室舒张功能障碍,上述研究阐述了SGLT2抑制剂可能针对这方面引起的HFpEF有较好的疗效。但上述研究数据少,观察时间短,未来仍需更大的试验继续研究。
2.7 增加红细胞压积
有研究[28]证实红细胞压积与心血管死亡率下降的相关性极强。SGLT2抑制剂可减少钠钾ATP酶消耗,从而减轻近端小管周围微环境的缺氧,这可能会使肌成纤维细胞逆转为产生促红细胞生成素(erythropoietin,EPO)的成纤维细胞,使造血功能增强和红细胞压积增加[29]。Mazer等[30]测量90例心脏病患者血浆中EPO水平,分析数据发现经达格列净治疗后EPO水平均显著升高,另外红细胞压积也增加了2.34%,且EPO水平与红细胞压积呈显著相关性。该研究还提出SGLT2抑制剂可能通过增强肾脏EPO分泌而增强多效细胞因子作用,该因子可能有利地影响心肌细胞线粒体功能、血管生成和细胞增殖,增强心肌氧输送。同样,Ghanim等[31]和Fuchs Andersen等[32]最新研究也表明达格列净或恩格列净治疗后肾脏EPO分泌及血浆血细胞比容均顯著增加,并提出达格利净可能通过抑制铁调素和其他铁调节蛋白来增加红细胞生成和血细胞比容。但上述研究仅对SGLT2抑制剂引起EPO及红细胞升高的机制作出了假设,尚未证实,仍需大量试验进一步验证。
2.8 减少心外膜脂肪组织
心外膜脂肪组织(epicardial adipose tissue,EAT)是心脏周围的一种白色脂肪组织,与心肌发育起源相似并共享血供,因此积累的EAT衍生促炎因子可渗透到心肌组织,破坏心脏超微结构和电生理特性,导致左心室肥大,最终导致HFpEF[33]。van Woerden等[34]和Rossi等[35]对105例HFpEF患者进行分析,发现与HFrEF患者相比,HFpEF患者EAT含量明显偏高,且EAT与全因死亡率和心衰住院率显著相关。因此,减少EAT有望成为SGLT2抑制剂保护心脏的机制之一。Sato等[36]招募40例连续接受冠状动脉疾病常规治疗的患者进行分组研究,结果显示达格列净治疗6个月后,患者体重、EAT体积及肿瘤坏死因子-α水平均明显下降,EAT体积与体重和肿瘤坏死因子-α水平变化均呈显著正相关。该研究提出SGLT2抑制剂可能通过减少脂肪堆积、改善心肌炎症而改善心脏功能。另外,Myasoedova等[37]对纳入了1 064例患者的18项研究进行分析,同样发现SGLT2抑制剂对EAT减少有显著影响。同样,Mullens等[38]的研究也提出SGLT2抑制剂可促进葡萄糖在肾脏消除,继发引起血浆胰岛素水平降低和胰高血糖素水平升高,这种整体代谢作用有利于脂肪分解,从而减少EAT堆积来缓解心室舒张受限和改善心室舒张功能。但上述研究中EAT体积的减小是否仅由SGLT2抑制剂引起尚不清楚,因为可通过减肥来实现,另外在无冠状动脉疾病史的患者中是否会观察到类似的结果尚不清楚。因此,还需进一步研究验证此结论的权威性。
3 小结
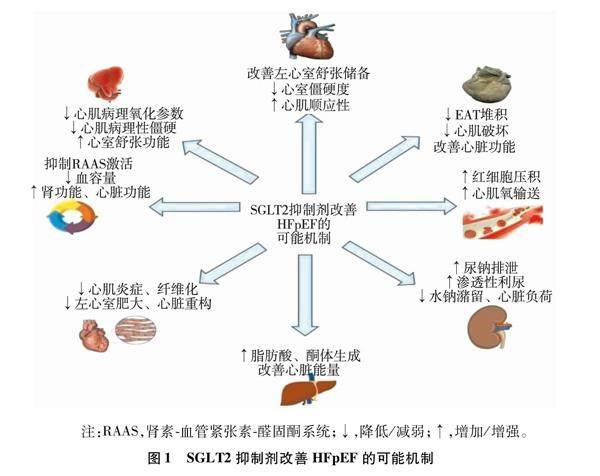
在心衰的几种类型中,HFpEF以患病率高、预后差且以往无明确有效治疗而受到重视,其发病机制复杂。研究显示SGLT2抑制剂对HFpEF有确切保护作用,成为HFpEF治疗的新方向和新方法。综合本文SGLT2抑制剂可能通过减少脂肪堆积、抗炎、抗纤维化、改善代谢、调节氧化应激等机制使HFpEF患者获益(见图1)。据报道,炎症或氧化应激增加可能是心肌纤维化或肥大的潜在因素,EAT的减少伴随着心肌纤维化和相关炎症标志物减少。由此猜想,这些机制之间是否存在某种联系及某种共同途径使心衰患者获益。本文涉及相关研究仅对各机制作出了假设,无大型试验探讨其之间的联系。未来需更多临床试验和基础实验,为其对心血管系统的保护机制进一步补充,为心衰治疗提供更扎实的基础。
参考文献
[1]In China TWCOTROCHAD,Hu SS.Report on cardiovascular health and diseases in China 2021:an updated summary[J].J Geriatr Cardiol,2023,20(6):399-430.
[2]Cai A,Qiu W,Zhou Y,et al.Clinical characteristics and 1-year outcomes in hospitalized patients with heart failure with preserved ejection fraction:results from the China Cardiovascular Association Database-Heart Failure Center Registry[J].Eur J Heart Fail,2022,24(11):2048-2062.
[3]Savarese G,Stolfo D,Sinagra G,et al.Heart failure with mid-range or mildly reduced ejection fraction[J].Nat Rev Cardiol,2022,19(2):100-116.
[4]Dewan P,Solomon SD,Jhund PS,et al.Efficacy and safety of sodium-glucose co-transporter 2 inhibition according to left ventricular ejection fraction in DAPA-HF[J].Eur J Heart Fail,2020,22(7):1247-1258.
[5]Solomon SD,Vaduganathan M,Claggett BL,et al.Baseline characteristics of patients with HF with mildly reduced and preserved ejection fraction:DELIVER trial[J].JACC Heart Fail,2022,10(3):184-197.
[6]Ismayl M,Abbasi MA,Al-Abcha A,et al.Sodium-glucose cotransporter-2 inhibitors in heart failure with mildly reduced or preserved ejection fraction:a systematic review and meta-analysis of randomized controlled trials[J].Curr Probl Cardiol,2023,48(5):101597.
[7]Cao H,Rao X,Jia J,et al.Effects of sodium-glucose co-transporter-2 inhibitors on kidney,cardiovascular,and safety outcomes in patients with advanced chronic kidney disease:a systematic review and meta-analysis of randomized controlled trials[J].Acta Diabetol,2023,60(3):325-335.
[8]Wheeler DC,Stefánsson BV,Jongs N,et al.Effects of dapagliflozin on major adverse kidney and cardiovascular events in patients with diabetic and non-diabetic chronic kidney disease:a prespecified analysis from the DAPA-CKD trial[J].Lancet Diabetes Endocrinol,2021,9(1):22-31.
[9]DeFronzo RA,Reeves WB,Awad AS.Pathophysiology of diabetic kidney disease:impact of SGLT2 inhibitors[J].Nat Rev Nephrol,2021,17(5):319-334.
[10]周京敏,王華,黎励文.射血分数保留的心力衰竭诊断与治疗中国专家共识2023[J].中国循环杂志,2023,38(4):375-393.
[11]Griffin M,Rao VS,Ivey-Miranda J,et al.Empagliflozin in heart failure:diuretic and cardiorenal effects[J].Circulation,2020,142(11):1028-1039.
[12]Shiina K,Tomiyama H,Tanaka A,et al.Canagliflozin independently reduced plasma volume from conventional diuretics in patients with type 2 diabetes and chronic heart failure:a subanalysis of the CANDLE trial[J].Hypertens Res,2023,46(2):495-506.
[13]Sakai T,Miura S.Effects of sodium-glucose cotransporter 2 inhibitor on vascular endothelial and diastolic function in heart failure with preserved ejection fraction—Novel prospective cohort study[J].Circ Rep,2019,1(7):286-295.
[14]Shim CY,Seo J,Cho I,et al.Randomized,controlled trial to evaluate the effect of dapagliflozin on left ventricular diastolic function in patients with type 2 diabetes mellitus:the IDDIA trial[J].Circulation,2021,143(5):510-512.
[15]Connelly KA,Zhang Y,Visram A,et al.Empagliflozin improves diastolic function in a nondiabetic rodent model of heart failure with preserved ejection fraction[J].JACC Basic Transl Sci,2019,4(1):27-37.
[16]Moellmann J,Klinkhammer BM,Droste P,et al.Empagliflozin improves left ventricular diastolic function of db/db mice[J].Biochim Biophys Acta Mol Basis Dis,2020,1866(8):165807.
[17]Sanders-van Wijk S,van Empel V,Davarzani N,et al.Circulating biomarkers of distinct pathophysiological pathways in heart failure with preserved vs.reduced left ventricular ejection fraction[J].Eur J Heart Fail,2015,17(10):1006-1014.
[18]Kolijn D,Pabel S,Tian Y,et al.Empagliflozin improves endothelial and cardiomyocyte function in human heart failure with preserved ejection fraction via reduced pro-inflammatory-oxidative pathways and protein kinase Gα oxidation[J].Cardiovasc Res,2021,117(2):495-507.
[19]Kondo H,Akoumianakis I,Badi I,et al.Effects of canagliflozin on human myocardial redox signalling:clinical implications[J].Eur Heart J,2021,42(48):4947-4960.
[20]Takahara S,Soni S,Maayah ZH,et al.Ketone therapy for heart failure:current evidence for clinical use[J].Cardiovasc Res,2022,118(4):977-987.
[21]Santos-Gallego CG,Requena-Ibanez JA,San Antonio R,et al.Empagliflozin ameliorates adverse left ventricular remodeling in nondiabetic heart failure by enhancing myocardial energetics[J].J Am Coll Cardiol,2019,73(15):1931-1944.
[22]Li X,Lu Q,Qiu Y,et al.Direct cardiac actions of the sodium glucose co-transporter 2 inhibitor empagliflozin improve myocardial oxidative phosphorylation and attenuate pressure-overload heart failure[J].J Am Heart Assoc,2021,10(6):e018298.
[23]劉海浪,张立,胡婷婷,等.达格列净保护缺血性心力衰竭大鼠心脏的微小RNA表达谱系研究[J].中国心血管杂志,2021,26(5):477-482.
[24]Triposkiadis F,Xanthopoulos A,Starling RC,et al.Obesity,inflammation,and heart failure:links and misconceptions[J].Heart Fail Rev,2022,27(2):407-418.
[25]Lee TM,Chang NC,Lin SZ.Dapagliflozin,a selective SGLT2 inhibitor,attenuated cardiac fibrosis by regulating the macrophage polarization via STAT3 signaling in infarcted rat hearts[J].Free Radic Biol Med,2017,104:298-310.
[26]Abdollahi E,Keyhanfar F,Delbandi AA,et al.Dapagliflozin exerts anti-inflammatory effects via inhibition of LPS-induced TLR-4 overexpression and NF-κB activation in human endothelial cells and differentiated macrophages[J].Eur J Pharmacol,2022,918:174715.
[27]Kang S,Verma S,Hassanabad AF,et al.Direct effects of empagliflozin on extracellular matrix remodelling in human cardiac myofibroblasts:novel translational clues to explain EMPA-REG OUTCOME results[J].Can J Cardiol,2020,36(4):543-553.
[28]Lee HC,Shiou YL,Jhuo SJ,et al.The sodium-glucose co-transporter 2 inhibitor empagliflozin attenuates cardiac fibrosis and improves ventricular hemodynamics in hypertensive heart failure rats[J].Cardiovasc Diabetol,2019,18(1):45.
[29]Varadhan A,Stephan K,Gupta R,et al.Growing role of SGLT2i in heart failure:evidence from clinical trials[J].Expert Rev Clin Pharmacol,2022,15(2):147-159.
[30]Mazer CD,Hare GMT,Connelly PW,et al.Effect of empagliflozin on erythropoietin levels,iron stores,and red blood cell morphology in patients with type 2 diabetes mellitus and coronary artery disease[J].Circulation,2020,141(8):704-707.
[31]Ghanim H,Abuaysheh S,Hejna J,et al.Dapagliflozin suppresses hepcidin and increases erythropoiesis[J].J Clin Endocrinol Metab,2020,105(4):dgaa057.
[32]Fuchs Andersen C,Omar M,Glenthj A,et al.Effects of empagliflozin on erythropoiesis in heart failure:data from the Empire HF trial[J].Eur J Heart Fail,2023,25(2):226-234.
[33]Nalliah CJ,Bell JR,Raaijmakers AJA,et al.Epicardial adipose tissue accumulation confers atrial conduction abnormality[J].J Am Coll Cardiol,2020,76(10):1197-1211.
[34]van Woerden G,van Veldhuisen DJ,Manintveld OC,et al.Epicardial adipose tissue and outcome in heart failure with mid-range and preserved ejection fraction[J].Circ Heart Fail,2022,15(3):e009238.
[35]Rossi VA,Gruebler M,Monzo L,et al.The different pathways of epicardial adipose tissue across the heart failure phenotypes:from pathophysiology to therapeutic target[J].Int J Mol Sci,2023,24(7):6838.
[36]Sato T,Aizawa Y,Yuasa S,et al.The effect of dapagliflozin treatment on epicardial adipose tissue volume and P-wave indices:an ad-hoc analysis of the previous randomized clinical trial[J].J Atheroscler Thromb,2020,27(12):1348-1358.
[37]Myasoedova VA,Parisi V,Moschetta D,et al.Efficacy of cardiometabolic drugs in reduction of epicardial adipose tissue:a systematic review and meta-analysis[J].Cardiovasc Diabetol,2023,22(1):23.
[38]Mullens W,Martens P.Empagliflozin-induced changes in epicardial fat:the centerpiece for myocardial protection?[J].JACC Heart Fail,2021,9(8):590-593.
收稿日期:2023-08-08
基金項目:国家自然科学基金(81670348)
通信作者:吴铿,E-mail:zjwukeng@163.com

