内质网应激与内皮功能障碍关系及临床治疗研究进展
付亚萌 张光明

【摘要】内皮功能障碍作为动脉粥样硬化的早期关键事件,不仅贯穿动脉粥样硬化病变全程,还与其他多种心血管疾病的发病密切相关。近年来有研究发现,内质网应激(ERS)相关蛋白在心血管疾病中的表达呈上升趋势,ERS可能通过促进内皮功能障碍加重心血管疾病的进展。现总结ERS与内皮功能障碍及动脉粥样硬化发病机制的关系,并介绍一些缓解ERS的药物,有望为临床实现内皮功能障碍及心血管疾病的治疗提供一定参考价值。
【关键词】内质网应激;未折叠蛋白质反应;内皮功能障碍;动脉粥样硬化
【DOI】10.16806/j.cnki.issn.1004-3934.2024.03.012
The Relationship Between Endoplasmic Reticulum Stress and Endothelial Dysfunction and Its Clinical Treatment
FU Yameng,ZHANG Guangming
(Department of Cardiology,The Second Hospital of Hebei Medical University,Shijiazhuang 050000,Hebei,China)
【Abstract】As an early critical event in atherosclerosis (AS), endothelial dysfunction runs throughout the AS process and is closely related to the pathogenesis of many other cardiovascular diseases.It has been found that the expression of endoplasmic reticulum stress (ERS)-related proteins is increasing in cardiovascular disease,and ERS may exacerbate the progression of cardiovascular disease by promoting endothelial dysfunction.ERS may aggravate the progression of cardiovascular disease by promoting endothelial dysfunction.This article summarizes the research progress of the relationship between ERS and endothelial dysfunction and AS,and introduces some drugs to alleviate ERS,which is expected to provide certain reference value for the clinical treatment of endothelial dysfunction and cardiovascular diseases.
【Keywords】Endoplasmic reticulum stress;Unfolded protein response;Endothelial dysfunction;Atherosclerosis
动脉粥样硬化(atherosclerosis,AS)作为冠心病最重要的病理改变,是一种发生在大动脉和中动脉内膜的慢性炎症反应和退行性病变。内皮功能障碍与AS发病密切相关,现已证实可作为冠心病的独立危险预测因子。生理情况下,机体通过特殊机制维持蛋白质的合成稳定性。当机体长期处于高血糖、高血脂、氧化应激等病理条件下时,细胞蛋白质合成稳定性受损,发生内质网应激(endoplasmic reticulum stress,ERS)。ERS不仅参与内皮功能障碍,加重AS进展,在缺血性心脏病、糖尿病心肌病、心力衰竭、血管钙化、高血压等其他心血管疾病的发病中同样发挥着重要作用[1]。缓解ERS有助于减缓心血管疾病进展,ERS涉及的多种反应通路有望成为未来治疗心血管疾病的重要靶点。
1 内质网及其生理功能
20世纪中期,Porter等[2]在光学显微镜下观察鸡细胞时第一次在镜下发现“延展整个细胞质的细花边状物质”。1954年,Palade和Porter[3]将其命名为内质网。内质网主要由分支小管和扁平囊组成,参与细胞合成、折叠和转运各种分泌蛋白和膜蛋白[4]。除了调控蛋白质生物合成外,内质网在钙储存、脂质生物合成、解毒和能量代谢以及细胞核-细胞质信号传导中也发挥着重要作用。
内质网作为體内蛋白质合成的重要场所,蛋白质生物合成的异常升高、二硫键形成的抑制、代谢能耗竭以及N-糖基化的扰动等任何蛋白质合成过程的异常中断,都会导致错误折叠蛋白的形成,且蛋白质错误折叠速率与合成蛋白质的复杂程度和数量成正比[5]。为了帮助多肽正确折叠或选择性降解错误折叠的蛋白,细胞衍生出一套内质网质量控制系统控制蛋白质合成。葡萄糖调节蛋白78(glucose regulated protein 78,GRP78),又称为免疫球蛋白重链结合蛋白质(immunoglobulin heavy chain binding protein,BiP),作为内质网质量控制系统中最重要的一种伴侣分子,对错误蛋白质的识别具有高度敏感性,在蛋白质合成过程中发挥着重要作用[6]。
2 内质网蛋白稳定调控中心
多种遗传和环境有害因素破坏细胞正确折叠和修饰蛋白质的能力,造成细胞器中大量未折叠或错误折叠蛋白异常累积,扰乱内质网稳态,引起经典意义上的ERS[7]。ERS影响细胞内功能性转录和翻译过程,与多种临床疾病的发生密切相关[8]。当细胞受高血脂、氧化应激、高血糖等因素刺激时,首先激活细胞内一种被称为未折叠蛋白质反应(unfolded protein response,UPR)的信号传导途径。
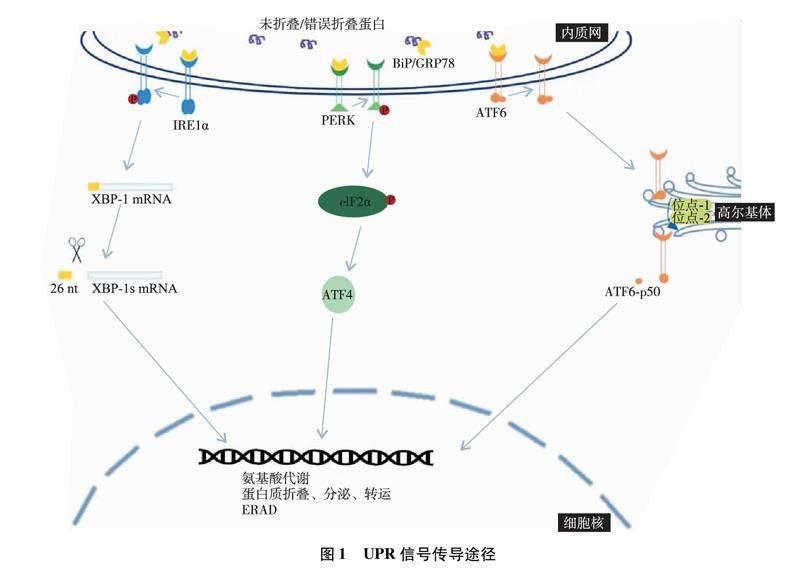
哺乳动物UPR传感器分为肌醇需求酶1α(inositol-requiring enzyme 1α, IRE1α)、PKR样内质网激酶(PKR-like endoplasmic reticulum kinase,PERK)和 转录激活因子(activating transcription factor,ATF)6[9]。UPR传感器主要与BiP相结合维持其非活性状态[6]。IRE1α的胞质尾区为丝氨酸/苏氨酸激酶结构域和核糖核酸内切酶结构域。细胞发生ERS时,错误折叠蛋白与BiP结合,IRE1α与BiP解离并发生磷酸化,磷酸化IRE1α的核糖核酸内切酶从编码X盒结合蛋白1(X-box binding protein 1,XBP-1)转录因子的mRNA中切除26 nt内含子形成XBP-1s。随后XBP-1s转位到细胞核诱导多种基因的转录,增加内质网功能,初步恢复内质网的稳态。PERK作为一种内质网跨膜蛋白,包括腔内内质网应力传感结构域和胞质激酶结构域,含有单一胞质激酶。ERS时,BiP与错误折叠蛋白结合,PERK与BiP解离发生自磷酸化。磷酸化的PERK进一步选择性磷酸化真核翻译起始因子2α(eukaryotic initiation factor 2α,eIF2α),eIF2α控制蛋白质的合成,eIF2α磷酸化导致细胞内蛋白质翻译速度减慢,细胞获得更多的时间进行蛋白重新折叠。BiP结合错误折叠的蛋白,致使ATF6与BiP解离并易位到高尔基体,被位点-1和位点-2蛋白酶裂解以释放其胞质尾区所含ATF6(N)转录因子。被切割的ATF6-p50继而进入到细胞核后,促进有关GRP78合成、蛋白折叠以及内质网相关蛋白降解(endoplasmic reticulum-associated degradation,ERAD)相关基因的转录表达,以增强蛋白质的折叠、分泌、修饰功能。
UPR作为细胞内蛋白稳定性的调控中心,维持内质网内蛋白折叠的稳定性。UPR通路的激活在ERS早期初步恢复细胞的蛋白合成稳定性,有助于细胞存活(见图1)。但在不可补救的ERS环境中,UPR将转变为一种被称为终末UPR的替代信号平台,主动促进细胞死亡[10]。
3 ERS与内皮功能障碍
内皮细胞参与调节血管张力、免疫反应、炎症反应、止血、物质交换等重要生理过程。其分泌的舒血管性因子、缩血管性因子、血小板活化因子及纤溶酶原激活物抑制剂等物质生理条件下维持动态平衡。内皮细胞受各种因素刺激发生功能障碍,不仅引起上述因子的失衡,还与临床多种心血管疾病的发生和发展密切相关。且内皮功能障碍发生先于显性心血管疾病的临床表现,可作为心血管事件及死亡率的强有力的独立预测因子[11]。
Gargalovic等[12]最早发现ERS与内皮细胞功能紊乱之间存在相关性。ERS可能通过直接作用于内皮衍生的血管活性物质或通过激活其他致病细胞网络如炎症和氧化应激来破坏内皮功能。UPR慢性激活引起的ERS已被证实是内皮功能障碍的重要发病机制之一。
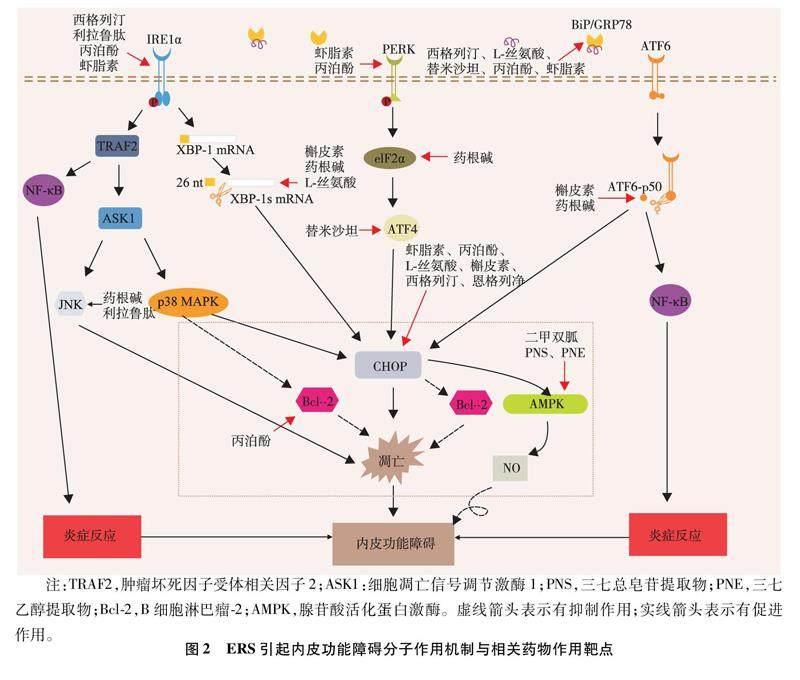
在对肥胖成年人建立内皮功能障碍的研究[13]发现,UPR的三种传感器PERK、IRE1α和ATF6均不同程度地参与内皮功能障碍的发生。当各种因素刺激引起细胞内发生不可挽救的ERS时,IRE1α发生同源寡聚化,这将引起数百个内质网定位的含有N-末端信号序列的mRNA的核酸内裂解衰变,加剧细胞ERS。同时,IRE1α与肿瘤坏死因子受体相关因子2相互作用,通过活化核因子κB(nuclear factor-κB,NF-κB)促进炎症因子的产生及内皮细胞炎症反应[14]。肿瘤坏死因子受体相关因子2还可进一步刺激细胞凋亡信号调节激酶1,增强p38丝裂原活化蛋白激酶的活性,触发肿瘤坏死因子受体相关因子2/细胞凋亡信号调节激酶1/c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路,抑制凋亡蛋白B细胞淋巴瘤-2基因在内等多种编码抗凋亡蛋白基因的表达,最终引起下游炎症信号的激活以及内皮细胞凋亡[15]。ERS时,PERK选择性磷酸化eIF2α的同时也减弱了NF-κB的抑制剂IκB的翻译,这一结果导致细胞核内NF-κB水平升高,同样促进细胞发生炎症反应[14]。ATF4作为一种翻译效率较高的转录因子,控制细胞内氨基酸合成与转运、促凋亡等基因的表达,其活性不受eIF2α磷酸化的影响。eIF2α被PERK磷酸化后上调ATF4的表达,ATF4转位入核,促进细胞核内CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)的转录。细胞内PERK/eIF2α/ATF4/CHOP通路的持续激活,其最终结果是引起CHOP过表达导致的细胞凋亡[9]。同样,ATF6转位到细胞核后,在促进蛋白折叠相关基因转录的同时也将促进CHOP和NF-κB的转录,一定程度上也参与细胞凋亡和炎症反应的发生(见图2)[14]。除此之外,UPR还可作为与其他因素引起内皮功能障碍的共同反应通路。同型半胱氨酸作为甲硫氨酸在体内的主要代谢产物,具有诱导内皮细胞炎症反应与凋亡的作用,已被多项研究证实参与血管内皮功能障碍,是心血管疾病的独立危险因素。近年来有研究[16]发现,同型半胱氨酸诱导的内皮功能障碍可能与PERK和IRE1α磷酸化、CHOP表达水平以及炎症因子的增加有关。
ERS还可通过影响体内其他分子水平引起内皮功能障碍。内皮细胞通过释放一氧化氮(nitric oxide,NO)参与调节血管张力,其活性依赖于内皮细胞的完整性。ERS增加内皮细胞炎症反应与凋亡,引起NO生物利用度降低,损伤血管内皮依赖性舒张功能。环氧二十碳三烯酸作为内皮细胞产生的一种具有内皮源性超极化因子特性的强效血管扩张剂,具有抑制炎症和血小板聚集以及维持血管稳态的重要作用。环氧二十碳三烯酸在体内被可溶性环氧化合物水解酶(soluble epoxide hydrolase,sEH)水解失去生理活性。有研究[17]发现,ERS通过介导血管紧张素Ⅱ诱导的血管内皮细胞sEH的上调,增加环氧二十碳三烯酸水解,損伤血管功能。在另一项对缺血再灌注小鼠模型的研究[18]发现,ERS可能通过IRE1α/JNK-c-Jun/AP-1-sEH信号轴上调sEH表达,引起心肌损伤与内皮依赖性舒张功能受损,进一步证实了ERS在内皮功能障碍发病机制中的作用。
4 ERS與AS
AS的形成和发展包括内皮功能障碍、局部炎症反应、动脉壁脂质堆积和斑块破裂等病理过程。脂质摄取、泡沫细胞形成和炎症反应是启动AS的关键事件,同时提供了触发细胞ERS的条件。
越来越多的证据表明ERS在AS发病过程中发挥着重要作用。不同的心血管疾病虽然有不同的临床表现,但其发病机制均与蛋白质稳态破坏导致的内质网中未折叠或错误折叠蛋白异常累积相关[19]。氧化低密度脂蛋白作为一种重要致病因素参与AS病理过程。有研究[20]发现,氧化低密度脂蛋白通过上调细胞凋亡信号调节激酶1表达和诱导内皮细胞ERS,激活NOD样受体热蛋白结构域相关蛋白3炎症小体,损伤内皮细胞。CHOP与ATF4在AS早期阶段的平滑肌细胞和巨噬细胞中高度表达,与NOD样受体热蛋白结构域相关蛋白3炎症小体激活后介导的基质金属蛋白酶上调共同作用促进斑块破裂,与临床急性冠脉综合征的发生密切相关[21]。正常血管壁弹性维持一定张力,血液与管壁之间形成低剪切应力可直接诱导内皮ERS[22]。低剪切应力增加内皮细胞对ERS的敏感性,加速AS的炎症反应[23]。除此之外,低剪切应力还可能参与白细胞介素-1受体相关激酶2/CHOP信号通路介导的ERS,引起动脉内皮细胞凋亡。
5 总结和展望
内皮功能障碍是AS发生和进展的标志,与AS病变周围的炎症、活性氧(reactive oxygen species,ROS)和细胞凋亡增加以及NO生物利用度降低密切相关[24]。ERS参与内皮功能障碍,加重AS的进展,还与其他多种心血管疾病的发病密切相关,可作为心血管疾病的调节因子[25]。近年来有研究发现,部分药物或化合物通过抑制ERS,可以有效改善内皮功能障碍,发挥抗AS作用,进一步证实了ERS与内皮功能障碍及AS的发病关系,同时也为未来可能开展的针对内皮功能障碍的治疗提供一定的临床指导价值(见表1和图2)。下调ERS对于改善血管内皮功能障碍和延缓心血管疾病的进展具有重要意义,有望为未来心血管疾病的治疗提供潜在治疗价值。
利益冲突 所有作者均申明无利益冲突
作者贡献声明 付亚萌:文章内容构思、文献查找与阅读、文章撰写;张光明:文章的内容审核、修订,对文章整体负责,全程监督
参考文献
[1]Liu MQ,Chen Z,Chen LX.Endoplasmic reticulum stress:a novel mechanism and therapeutic target for cardiovascular diseases[J].Acta Pharmacol Sin,2016,37(4):425-443.
[2]Porter KR,Claude A,Fullam EF.A study of tissue culture cells by electron microscopy:methods and preliminary observations[J].J Exp Med,1945,81(3):233-246.
[3]Palade GE,Porter KR.Studies on the endoplasmic reticulum.I.Its identification in cells in situ[J].J Exp Med,1954,100(6):641-656.
[4]Yang Y,Zhou Q,Gao A,et al.Endoplasmic reticulum stress and focused drug discovery in cardiovascular disease[J].Clin Chim Acta,2020,504:125-137.
[5]Hasnain SZ,Lourie R,Das I,et al.The interplay between endoplasmic reticulum stress and inflammation[J].Immunol Cell Biol,2012,90(3):260-270.
[6]Brocchieri L,Conway de Macario E,Macario AJ.Hsp70 genes in the human genome: conservation and differentiation patterns predict a wide array of overlapping and specialized functions[J].BMC Evol Biol,2008,8:19.
[7]Ajoolabady A,Kaplowitz N,Lebeaupin C,et al.Endoplasmic reticulum stress in liver diseases[J].Hepatology,2023,77(2):619-639.
[8]Back SH,Kaufman RJ.Endoplasmic reticulum stress and type 2 diabetes[J].Ann Rev Biochem,2012,81:767-793.
[9]Tabas I,Ron D.Integrating the mechanisms of apoptosis induced by endoplasmic reticulum stress[J].Nat Cell Biol,2011,13(3):184-190.
[10]So JS.Roles of endoplasmic reticulum stress in immune responses[J].Mol Cells,2018,41(8):705-716.
[11]Widlansky ME,Gokce N,Keaney JF Jr,et al.The clinical implications of endothelial dysfunction[J].J Am Coll Cardiol,2003,42(7):1149-1160.
[12]Gargalovic PS,Gharavi NM,Clark MJ,et al.The unfolded protein response is an important regulator of inflammatory genes in endothelial cells[J].Arterioscler Thromb Vasc Biol,2006,26(11):2490-2496.
[13]Kaplon RE,Chung E,Reese L,et al.Activation of the unfolded protein response in vascular endothelial cells of nondiabetic obese adults[J].J Clin Endocrinol Metab,2013,98(9):E1505-E1509.
[14]Osman A,Benameur T,Korashy HM,et al.Interplay between endoplasmic reticulum stress and large extracellular vesicles (microparticles) in endothelial cell dysfunction[J].Biomedicines,2020,8(10):409.
[15]Cao SS,Kaufman RJ.Endoplasmic reticulum stress and oxidative stress in cell fate decision and human disease[J].Antioxid Redox Signal,2014,21(3):396-413.
[16]Ji C,Yi H,Huang J,et al.Propofol alleviates inflammation and apoptosis in HCY-induced HUVECs by inhibiting endoplasmic reticulum stress[J].Mol Med Rep,2021,23(5):333.
[17]Mak SK,Yu CM,Sun WT,et al.Tetramethylpyrazine suppresses angiotensin Ⅱ-induced soluble epoxide hydrolase expression in coronary endothelium via anti-ER stress mechanism[J].Toxicol Appl Pharmacol,2017,336:84-93.
[18]Xue HM,Sun WT,Chen HX,et al.Targeting IRE1α-JNK-c-Jun/AP-1-sEH signaling pathway improves myocardial and coronary endothelial function following global myocardial ischemia/reperfusion[J].Int J Med Sci,2022,19(9):1460-1472.
[19]Ren J,Bi Y,Sowers JR,et al.Endoplasmic reticulum stress and unfolded protein response in cardiovascular diseases[J].Nat Rev Cardiol,2021,18(7):499-521.
[20]Hang L,Peng Y,Xiang R,et al.Ox-LDL causes endothelial cell injury through ASK1/NLRP3-mediated inflammasome activation via endoplasmic reticulum stress[J].Drug Des Devel Ther,2020,14:731-744.
[21]Li W,Jin K,Luo J,et al.NF-κB and its crosstalk with endoplasmic reticulum stress in atherosclerosis[J].Front Cardiovasc Med,2022,9:988266.
[22]Chung J,Kim KH,Lee SC,et al.Ursodeoxycholic acid (UDCA) exerts anti-atherogenic effects by inhibiting endoplasmic reticulum (ER) stress induced by disturbed flow[J].Mol Cells,2015,38(10):851-858.
[23]Bailey KA,Moreno E,Haj FG,et al.Mechanoregulation of p38 activity enhances endoplasmic reticulum stress-mediated inflammation by arterial endothelium[J].FASEB J,2019,33(11):12888-12899.
[24]Hong J,Park E,Lee J,et al.Exercise training mitigates ER stress and UCP2 deficiency-associated coronary vascular dysfunction in atherosclerosis[J].Sci Rep,2021,11(1): 15449.
[25]Shanahan CM,Furmanik M.Endoplasmic reticulum stress in arterial smooth muscle cells:a novel regulator of vascular disease[J].Curr Cardiol Rev,2017,13(2): 94-105.
[26]Chen C,Kassan A,Castaeda D,et al.Metformin prevents vascular damage in hypertension through the AMPK/ER stress pathway[J].Hypertens Res,2019,42(7): 960-969.
[27]Campeau MA,Leask RL.Empagliflozin mitigates endothelial inflammation and attenuates endoplasmic reticulum stress signaling caused by sustained glycocalyx disruption[J].Sci Rep,2022,12(1):12681.
[28]Cao Q,Xu D,Chen Y,et al.Sitagliptin reduces endothelial dysfunction and apoptosis induced by high-fat diet and palmitate in thoracic aortas and endothelial cells via ROS-ER stress-CHOP pathway[J].Front Pharmacol,2021,12:670389.
[29]Bretón-Romero R,Weisbrod RM,Feng B,et al.Liraglutide treatment reduces endothelial endoplasmic reticulum stress and insulin resistance in patients with diabetes mellitus[J].J Am Heart Assoc,2018,7(18):e009379.
[30]Menikdiwela KR,Ramalingam L,Allen L,et al.AngiotensinⅡincreases endoplasmic reticulum stress in adipose tissue and adipocytes[J].Sci Rep,2019,9(1):8481.
[31]Eisvand F,Tajbakhsh A,Seidel V,et al.Quercetin and its role in modulating endoplasmic reticulum stress:a review[J].Phytother Res,2022,36(1):73-84.
[32]Zhou Y,Wang Y,Vong CT,et al.Jatrorrhizine improves endothelial function in diabetes and obesity through suppression of endoplasmic reticulum stress[J].Int J Mol Sci,2022,23(20):12064.
[33]Sim WC,Han I,Lee W,et al.Inhibition of homocysteine-induced endoplasmic reticulum stress and endothelial cell damage by l-serine and glycine[J].Toxicol In Vitro,2016,34:138-145.
[34]Ei ZZ,Benjakul S,Buamard N,et al.Shrimp lipid prevents endoplasmic reticulum-mediated endothelial cell damage[J].Foods,2022,11(19):3076.
[35]Zhang X,Zhou C,Miao L,et al.Panax notoginseng protects against diabetes-associated endothelial dysfunction:comparison between ethanolic extract and total saponin[J].Oxid Med Cell Longev,2021,2021:4722797.收稿日期:2023-06-27
基金項目:2020河北省直医疗卫生机构老年病防治项目(303163320)
通信作者:张光明,E-mail:zhangguangming76@sina.com

