铁死亡的调控机制及其在蒽环类药物心脏毒性中的研究进展
赵珂 陈晓姝 魏希进 张娟 刘杨 卞雨敬 袁杰
【摘要】铁死亡是由铁介导的脂质过氧化累积引起的一种新的细胞死亡模式,在心血管疾病中发挥重要作用。蒽环类药物是最常用的化疗药物之一,用于治疗多种癌症。虽然药物有效,但其益处有时会受到急性和/或迟发性心脏毒性副作用(尤其是心力衰竭)的影响。证据表明蒽环类药物心脏毒性与心肌细胞铁死亡密切相关,现就铁死亡在蒽环类药物心脏毒性发生过程中的机制及潜在的治疗靶点进行综述,以期为减弱蒽环类化疗药物所致心肌损伤提供新的治疗靶点与研究方向。
【关键词】铁死亡;蒽环类药物;心脏毒性;脂质过氧化;铁积累
【DOI】10.16806/j.cnki.issn.1004-3934.2024.03.016
Regulatory Mechanism of Ferroptosis and Its Progress in Anthracycline-Induced Cardiotoxicity
ZHAO Ke1,CHEN Xiaoshu2,WEI Xijin3,ZHANG Juan3,LIU Yang3,BIAN Yujing1,YUAN Jie3
(1.First Clinical Medical College,Shandong University of Traditional Chinese Medicine,Jinan 250000,Shandong,China;2.Dongming County Health Bureau,Heze 274000,Shandong,China;3.Affiliated Hospital of Shandong University of Traditional Chinese Medicine,Jinan 250000,Shandong,China)
【Abstract】Ferroptosis is a new mode of cell death caused by iron-mediated accumulation of lipid peroxidation,which plays an important role in cardiovascular diseases.Anthracyclines are one of the most commonly used chemotherapeutic agents for the treatment of cancers.Although the drugs are effective,their benefits are sometimes compromised by acute and/or delayed cardiotoxic side effects,especially heart failure.Evidence suggests that anthracycline-induced cardiotoxicity is closely related to cardiomyocyte ferroptosis,and the mechanisms of ferroptosis in the development of anthracycline-induced cardiotoxicity and potential therapeutic targets are reviewed.We hope to provide new therapeutic target and research direction for attenuating the myocardial damage caused by anthracyclines.
【Keywords】Ferroptosis;Anthracycline;Cardiotoxicity;Lipid peroxidation;Iron accumulation
抗腫瘤药的研发显著改善了癌症患者的临床生存结局,蒽环类药物作为一种广泛使用的化疗药物,已被用于治疗乳腺癌、白血病和许多其他类型的恶性肿瘤。随着无进展生存期和总生存期的延长,长期应用蒽环类药物后的不良事件越来越受到临床医生的重视。蒽环类药物相关的主要药物不良反应包括心脏毒性、骨髓抑制、胃肠道反应和肝/肾损伤。其中,蒽环类药物心脏毒性(anthracycline-induced cardiotoxicity,AIC)被认为是最突出和最严重的不良反应。AIC随药物剂量的增加而增加,呈剂量依赖性心肌损伤。相关领域的研究[1]表明,当阿霉素累积剂量分别为550和700 mg/m2时,AIC的发生率为26%和48%。目前在常规临床实践中没有美国食品药品监督管理局批准的遗传生物标志物用于预测AIC,市场上只有一种药物右雷佐生(dexrazoxane,DXZ)被批准用于降低AIC的发生率。由于AIC发生率不断上升且缺乏有效的治疗方法,需更深入地了解AIC的潜在机制。铁死亡是近年来发现的一种新的细胞死亡类型,在细胞死亡过程中常伴有大量的铁代谢异常和脂质过氧化,本质上是一种铁依赖性氧化损伤[2]。维持氧化还原稳态对于维持正常的心肌细胞功能至关重要,研究[3-4]发现蒽环类药物能影响细胞内的铁代谢,破坏心肌细胞内的氧化还原平衡,最终导致心肌细胞死亡。本文综述了铁死亡的发生机制及其在AIC中的作用,并为AIC的治疗靶点提供新方向。
1 铁死亡的机制
铁死亡的调节机制涉及一系列代谢途径和信号分子。本文总结了细胞铁死亡的分子机制,包括铁代谢与铁积累、脂质代谢与脂质过氧化、抗氧化系统的异常。
1.1 铁代谢与铁积累
人体内铁有两种氧化状态:亚铁(Fe2+)或三价铁(Fe3+)。细胞外的Fe3+与转铁蛋白结合被细胞膜上的转铁蛋白受体识别,并被输入细胞质。然后Fe3+在前列腺跨膜上皮抗原3的作用下转化为Fe2+。Fe2+通过二价金属转运蛋白1从内吞体内释放到细胞质中,从而提高胞内Fe2+的浓度[5]。在正常情况下,胞内的铁一般储存在铁储存蛋白包括铁蛋白轻链和铁蛋白重链中,以保持细胞中相对低的Fe2+浓度,多余的铁通过铁转运蛋白1从细胞中去除,以维持细胞内氧化稳态。铁死亡中过量的Fe2+积累直接通过芬顿反应产生过多的活性氧(reactive oxygen species,ROS),从而导致氧化损伤[6]。此外,Fe2+积累还可能会激活脂质代谢酶,促进脂质过氧化,因此,铁代谢异常引起的铁积累是铁死亡的主要特征。
1.2 脂质代谢与脂质过氧化
脂质广泛分布在细胞器中,是细胞内所有膜的关键成分。脂质过氧化是铁死亡的重要特征,是指氧分子或过氧化氢提供过氧化氢基团,然后将过氧化氢基团插入到脂质分子中。游离多不饱和脂肪酸,特别是花生四烯酸或肾上腺酸可酯化成膜磷脂。酰基辅酶A合成酶长链家族成员4和溶血磷脂胆碱酰基转移酶3分别将膜磷脂转化为花生四烯酸或肾上腺酸辅酶A和花生四烯酸或肾上腺素-磷脂酰乙醇胺[7]。花生四烯酸或肾上腺素-磷脂酰乙醇胺通过脂氧合酶的酶途径和ROS的非酶途径合成脂质过氧化物花生四烯酸或肾上腺素-氢过氧化物-磷脂酰乙醇胺,统称为脂质过氧化物。铁积累导致过量的脂质过氧化物产生,会破环细胞内膜结构,引起细胞死亡。研究[8]发现,线粒体膜损伤导致线粒体代谢功能、线粒体电子传递链和三羧酸循环异常,进一步产生过量的ROS参与细胞脂质过氧化的发生。
1.3 抗氧化系统的异常
System Xc--谷胱甘肽(glutathione,GSH)-谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)轴是铁死亡发生过程中最重要的抗氧化系统。System Xc-是一种氨基酸反向转运蛋白,由催化亚基SLC7A11和伴侣亚基SLC3A2两个亚基组成;胱氨酸和谷氨酸以1:1的比例通过System Xc-运输(一个单位的胱氨酸进入细胞,伴随着一个单位的谷氨酸离开细胞),胱氨酸被递送到细胞中,随后被还原为半胱氨酸,当与谷氨酸和甘氨酸结合时形成GSH。GPX4是唯一一种能在复杂的细胞膜环境中催化有毒脂质过氧化物转化为无毒脂质醇的硒酶。GSH是一种主要的内源性抗氧化因子,GPX4通过抗氧化作用将GSH氧化为氧化GSH,同时将脂质过氧化物还原[9]。抑制System Xc-影响胱氨酸的摄取,从而限制GSH的生物合成,最终导致GSH耗竭,促进铁死亡的发生[10]。
铁死亡抑制蛋白1是一种GSH非依赖性铁死亡抑制因子,可通过烟酰胺腺嘌呤二核苷酸磷酸催化輔酶Q10转化为泛醇,泛醇是磷脂和脂蛋白中的一种自由基捕获抗氧化剂,能独立于GPX4清除细胞内的脂质过氧化物[11]。除此之外,核转录因子红系2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)相关抗氧化通路也被证明可在铁死亡过程中发挥抗氧化作用,以抑制铁死亡中的脂质过氧化[12]。
2 AIC和铁死亡
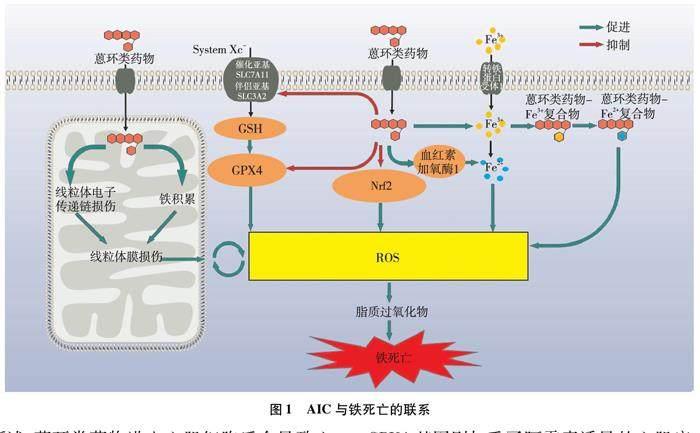
AIC与心肌细胞的铁死亡关系密切,现阶段研究认为蒽环类药物进入心肌细胞后对细胞内的铁积累、脂质过氧化、抗氧化系统以及线粒体功能具有明显的影响(见图1)。
2.1 铁积累和AIC
心肌细胞中的Fe2+主要参与维持正常的线粒体能量代谢和氧化还原稳态,Fe2+对于支持心脏功能至关重要,但过度积累具有细胞毒性。早期研究[13-14]发现,通过高铁饮食或基因改造介导的小鼠全身铁积累显著增加了对阿霉素诱导的心脏毒性的易感性,缺铁饮食的小鼠阿霉素诱导的心脏毒性风险更低,存活率更高,这表明以调节心脏铁水平的代谢途径为目标可能是治疗化疗药物相关心肌病的临床有效策略。
就阿霉素如何影响心肌细胞中铁代谢而言,研究[15]发现阿霉素能影响转铁蛋白受体1的表达与活性,从而增加细胞对铁的摄取。与此同时,阿霉素会诱导心肌细胞内储铁蛋白的表达,这可能是细胞对阿霉素诱导心肌细胞铁积累的一种自我保护措施[16]。阿霉素诱导小鼠的心肌损伤会被心肌细胞线粒体铁蛋白的表达上调所缓解,而线粒体铁蛋白基因缺失增加了心肌细胞对阿霉素诱导铁死亡的敏感性[17]。除此之外,研究发现在阿霉素诱导的小鼠心肌病过程中,血红素加氧酶1出现上调,导致心肌细胞内血红素降解和Fe2+的释放,进而导致氧化脂质的产生。而铁死亡抑制剂(Ferrostatin-1,Fer-1)与DXZ(一种特殊的铁螯合剂)能显著降低阿霉素诱导的心肌损伤[14]。
综上所述,蒽环类药物进入心肌细胞后会导致心肌细胞铁代谢紊乱,引起细胞内铁积累,而铁螯合剂可通过结合细胞内游离铁,从而缓解蒽环类药物所引起的心肌毒性。
2.2 脂质过氧化和AIC
细胞内脂质过氧化的发生与脂质代谢酶和ROS密切相关。脂质代谢异常是脂质过氧化的必要条件,研究[18]发现阿霉素处理的心肌细胞中脂质代谢的关键酶酰基辅酶A合成酶长链家族成员4表达明显上调,这意味着阿霉素处理导致心肌细胞内发生了脂质代谢异常,而酰基辅酶A合成酶长链家族成员4的上调明显促进了心肌细胞内的脂质过氧化。但脂质过氧化并不是铁死亡唯一的病理变化,其他多种调节性细胞死亡中也包括脂质过氧化的发生,但铁依赖性的脂质过氧化是铁死亡所具备的最独特的特征。更深入的研究[19]发现阿霉素进入心肌细胞后能与Fe3+生成复合物,随后生成阿霉素-Fe2+复合物,阿霉素-Fe2+复合物导致细胞内具有氧化活性的ROS产生,从而发生脂质过氧化。
综上所述,这些研究证明了以阿霉素为代表的蒽环类药物正是通过铁依赖性的脂质过氧化引起心肌细胞毒性。
2.3 抗氧化系统和AIC
正常情况下,细胞代谢产生的脂质过氧化物可被细胞内抗氧化系统还原为无毒的脂质醇,从而避免细胞内脂质过氧化的发生。
研究表明,阿霉素治疗可下调心脏中GPX4的表达,导致脂质过氧化。此外,有实验[4]证明了在小鼠中过表达GPX4可阻止阿霉素诱导的心肌病,而敲低GPX4基因则加重了阿霉素诱导的心肌病。另一项研究[20]通过RNA测序分析发现铁死亡是阿霉素诱导的慢性心脏毒性的潜在机制,并通过小鼠体内实验证明阿霉素可通过抑制System Xc-中的SLC7A11亚基,导致GSH合成减少,从而降低System Xc--GSH-GPX4系统对脂质过氧化物的清除率,进而促进铁死亡的发生。
另一项研究[21]发现,E3泛素蛋白连接酶基因敲除小鼠对阿霉素诱导的心脏毒性和细胞死亡具有保护作用,而E3泛素蛋白连接酶能负调节Nrf2介导的抗氧化途径。Nrf2相关的其他抗氧化机制也被证明可抑制阿霉素诱导的心肌损伤[22-23]。
综上所述,多项体内外研究证明蒽环类药物会破坏心肌细胞内的抗氧化系统,且抗氧化系统的破坏与心肌细胞铁死亡以及AIC的发生密切相关。
2.4 线粒体和AIC
线粒体是心肌细胞重要的能量来源,同时是细胞内ROS生成的主要来源,也是ROS导致氧化损伤的主要靶标。有研究[24]认为蒽环类药物进入细胞后主要聚积在心肌细胞线粒体中,特别是与线粒体内膜中的心磷脂结合,这种结合会导致线粒体电子传输链的损伤,进而导致线粒体功能障碍产生过量的ROS,促进线粒体膜脂质过氧化,使线粒体膜形态破坏与功能紊乱,进一步导致ROS的过量产生,形成恶性循环。
除了与ROS有关,线粒体也是蒽环类药物诱导铁积累发生的主要部位。阿霉素被证明通过插入线粒体DNA在线粒体中积累,通过下调5-氨基乙酰丙酸合酶1破坏血红素合成,从而损害铁的利用,导致心肌细胞中线粒体铁过载[25]。另一项研究[26]发现阿霉素处理的心肌细胞中,阿霉素浓缩在线粒体中,导致线粒体内铁增加,进一步通过上调线粒体铁输出蛋白的表达或螯合铁治疗能降低阿霉素诱导的心脏毒性。而Tadokoro等[4]研究发现阿霉素诱导的脂质过氧化发生在线粒体中,并发现心肌细胞内GPX4几乎完全在线粒体中表达,进一步证实了线粒体依赖性铁死亡在阿霉素诱导的心脏毒性中具有主要致病作用。
综上所述,现阶段研究结果认为线粒体是蒽环类药物诱导心肌细胞铁死亡相关膜损伤发生的主要场所,蒽环类药物诱导的铁积累、脂质过氧化、抗氧化系统的异常都被证明发生于线粒体之中,靶向线粒体环节铁死亡可能是未来降低AIC的方向。
3 铁死亡通路在治疗蒽环类药物心肌损伤中的应用
3.1 铁螯合疗法
DXZ作为铁螯合剂,是唯一获得美国食品药品监督管理局批准的,对于计划接受大剂量蒽环类药物化疗的癌症患者的正式预防药物[27]。DXZ在体内能通过螯合鐵来发挥其心脏保护作用,从而防止或减少具有细胞损害性的氧自由基的产生。此外,除了螯合铁直接发挥作用,DXZ还被证明可逆转阿霉素诱导的H2c9细胞中铁蛋白重链的减少,促进游离铁的生理性储存[28]。另一项研究[29]还证明DXZ可通过调节心肌细胞中铁代谢相关的蛋白质水平,逆转柔红霉素诱导的血红素加氧酶1的上调,它可能抑制了血红素铁向非血红素铁的转化,从而降低心肌细胞中Fe2+的含量。尽管DXZ通常被认为可降低AIC,并被推荐为唯一批准的心脏保护剂,但其有效性与可能存在的副作用也存在较大的质疑,欧洲心脏病学会[27]只推荐晚期或转移性乳腺癌患者接受的阿霉素累积剂量超过300 mg/m2时使用。
去铁胺(deferoxamine,DFO)是另一种广泛使用的铁螯合剂,DFO还被视为线粒体通透性的保护剂,因为它削弱了阿霉素-铁复合物或游离铁诱导的钙离子通道的开放,减少了Fe2+在线粒体中的积累,从而保护线粒体功能[30]。DFO的心脏保护益处与剂量密切相关,剂量的偏倚则会减弱其心脏保护能力,同时DFO的副作用,如低血压和肾功能不全,限制了其临床应用。综上所述,铁螯合疗法被证明是AIC的有效治疗策略。铁螯合疗法在铁死亡概念出现之前就已作为AIC的治疗手段之一,随着AIC被证明与心肌细胞铁死亡密切相关,铁螯合疗法也成为了缓解AIC的重点研究方向。
3.2 抗氧化疗法
Fer-1是一种自由基捕获抗氧化剂,能通过减少脂质ROS的积累来抑制脂质过氧化,从而抑制铁死亡。多项研究[31-32]证明Fer-1能明显缓解阿霉素诱导的心肌细胞铁死亡的发生。除此之外,Fer-1还被证明可通过影响铁积累过程以缓解AIC。Fer-1可通过下调Nrf2/血红素加氧酶1来抑制阿霉素诱导的心肌细胞中非血红素铁的升高,从而抑制铁死亡[14]。另一项研究[28]证明Fer-1增加了铁蛋白重链的表达和铁的储存量,从而逆转了阿霉素诱导的心肌细胞内游离铁的积累。在铁死亡相关研究中被证明有效的其他自由基捕获抗氧化剂,包括利普司他丁-1、α-生育酚、辅酶Q10等能发挥与Fer-1相似的效果,但这些自由基捕获抗氧化剂目前缺乏蒽环类药物诱导心肌损伤方面的临床研究证据。
天然提取物的抗铁死亡作用也被证明可减弱AIC,如白藜芦醇、黄芪甲苷Ⅳ等,都因其优秀的抗氧化作用被证明对阿霉素诱导的心肌细胞铁死亡起抑制作用[33-34]。这也许可以解释中医药改善蒽环类药物心肌损伤的临床应用与潜在机制。
AIC的主要机制之一是铁积累诱导的氧化应激,通过药物抑制氧化应激下的脂质过氧化是抗氧化疗法缓解蒽环类药物心肌损伤的主要机制。综上所述,通过靶向铁死亡相关氧化损伤通路,维持心肌细胞内的氧化还原平衡,也被证明可作为缓解AIC的另一个研究方向。
3.3 其他
根据最近的研究[35],蒽环类药物心肌损伤也与胰岛素信号传导失衡和心脏胰岛素抵抗有关。二甲双胍、西格列汀和恩格列净已被证明对蒽环类药物诱导的心肌毒性具有保护作用[36-38]。
总之,基于这些铁死亡发生机制的抗AIC治疗主要包括两个方面:铁螯合疗法和抗氧化疗法。尽管许多实验表明,靶向铁死亡降低AIC可通过抑制脂质过氧化和铁积累来实现,但这些药物对临床应用的有效性和安全性仍需临床试验的验证。胰岛素相关通路缓解AIC的研究似乎可对AIC的临床药物应用带来一定启发。
4 总结与展望
铁死亡是近几年来发现的一种新的病理生理途径,也为心血管疾病的洞察提供了一个不同的视角。蒽环类药物用于治疗恶性肿瘤疗效显著,但受到其心脏毒性作用的限制。本文概述了铁死亡的调节机制,并进一步探讨了铁死亡和AIC的联系。铁死亡在多种心血管疾病中已得到充分证实,铁死亡与AIC关系密切。但目前的研究仍有许多问题未得到回答:AIC中有关铁死亡的其他确切机制;AIC中铁死亡的关键靶点;AIC中其他形式的细胞死亡,如细胞凋亡、自噬和铁死亡之间的关系;以及针对铁死亡的药物能否在预防AIC的临床应用中发挥重要作用。虽然将靶向铁死亡治疗AIC转化为临床治疗之前还有许多工作要做,但对铁死亡的深入研究将为多种药物心脏毒性的预防与治疗干预提供新机会。
參考文献
[1]Magdy T,Jouni M,Kuo HH,et al.Identification of drug transporter genomic variants and inhibitors that protect against doxorubicin-induced cardiotoxicity[J].Circulation,2022,145(4):279-294.
[2]Dixon SJ,Lemberg KM,Lamprecht MR,et al.Ferroptosis:an iron-dependent form of nonapoptotic cell death[J].Cell,2012,149(5):1060-1072.
[3]Antoniak S,Phungphong S,Cheng Z,et al.Novel mechanisms of anthracycline-induced cardiovascular toxicity:a focus on thrombosis,cardiac atrophy,and programmed cell death[J].Front Cardiovasc Med,2022,8:817977.
[4]Tadokoro T,Ikeda M,Ide T,et al.Mitochondria-dependent ferroptosis plays a pivotal role in doxorubicin cardiotoxicity[J].JCI Insight,2020,5(9):e132747.
[5]Masaldan S,Bush AI,Devos D,et al.Striking while the iron is hot:iron metabolism and ferroptosis in neurodegeneration[J].Free Radic Biol Med,2019,133:221-233.
[6]Galaris D,Barbouti A,Pantopoulos K.Iron homeostasis and oxidative stress:an intimate relationship[J].Biochim Biophys Acta Mol Cell Res,2019,1866(12):118535.
[7]Gaschler MM,Stockwell BR.Lipid peroxidation in cell death[J].Biochem Biophys Res Commun,2017,482(3):419-425.
[8]Gao M,Yi J,Zhu J,et al.Role of mitochondria in ferroptosis[J].Mol Cell,2019,73(2):354-363.e3.
[9]Liu MR,Zhu WT,Pei DS.System Xc-:a key regulatory target of ferroptosis in cancer[J].Invest New Drugs,2021,39(4):1123-1131.
[10]Song X,Zhu S,Chen P,et al.AMPK-mediated BECN1 phosphorylation promotes ferroptosis by directly blocking system Xc- activity[J].Curr Biol,2018,28(15):2388-2399.e5.
[11]Doll S,Freitas FP,Shah R,et al.FSP1 is a glutathione-independent ferroptosis suppressor[J].Nature,2019,575(7784):693-698.
[12]Thimmulappa RK,Mai KH,Srisuma S,et al.Identification of Nrf2-regulated genes induced by the chemopreventive agent sulforaphane by oligonucleotide microarray[J].Cancer Res,2002,62(18):5196-5203.
[13]Panjrath GS,Patel V,Valdiviezo CI,et al.Potentiation of Doxorubicin cardiotoxicity by iron loading in a rodent model[J].J Am Coll Cardiol,2007,49(25):2457-2464.
[14]Fang X,Wang H,Han D,et al.Ferroptosis as a target for protection against cardiomyopathy[J].Proc Natl Acad Sci U S A,2019,116(7):2672-2680.
[15]Zhuang S,Ma Y,Zeng Y,et al.METTL14 promotes doxorubicin-induced cardiomyocyte ferroptosis by regulating the KCNQ1OT1-miR-7-5p-TFRC axis[J].Cell Biol Toxicol,2023,39(3):1015-1035.
[16]Asensio-López MC,Sánchez-Más J,Pascual-Figal DA,et al.Involvement of ferritin heavy chain in the preventive effect of metformin against doxorubicin-induced cardiotoxicity[J].Free Radic Biol Med,2013,57:188-200.
[17]Maccarinelli F,Gammella E,Asperti M,et al.Mice lacking mitochondrial ferritin are more sensitive to doxorubicin-mediated cardiotoxicity[J].J Mol Med (Berl),2014,92(8):859-869.
[18]Wang Y,Ying X,Wang Y,et al.Hydrogen sulfide alleviates mitochondrial damage and ferroptosis by regulating OPA3-NFS1 axis in doxorubicin-induced cardiotoxicity[J].Cell Signal,2023,107:110655.
[19]Simu。nek T,Stérba M,Popelová O,et al.Anthracycline-induced cardiotoxicity:overview of studies examining the roles of oxidative stress and free cellular iron[J].Pharmacol Rep,2009,61(1):154-171.
[20]Li X,Liang J,Qu L,et al.Exploring the role of ferroptosis in the doxorubicin-induced chronic cardiotoxicity using a murine model[J].Chem Biol Interact,2022,363:110008.
[21]Hou K,Shen J,Yan J,et al.Loss of TRIM21 alleviates cardiotoxicity by suppressing ferroptosis induced by the chemotherapeutic agent doxorubicin[J].EBioMedicine,2021,69:103456.
[22]Li D,Liu X,Pi W,et al.Fisetin attenuates doxorubicin-induced cardiomyopathy in vivo and in vitro by inhibiting ferroptosis through SIRT1/Nrf2 signaling pathway activation[J].Front Pharmacol,2021,12:808480.
[23]Guo F,Wang Y,Wang J,et al.Choline protects the heart from doxorubicin-induced cardiotoxicity through vagal activation and Nrf2/HO-1 pathway[J].Oxid Med Cell Longev,2022,2022:4740931.
[24]Li Y,Lin R,Peng X,et al.The role of mitochondrial quality control in anthracycline-induced cardiotoxicity:from bench to bedside[J].Oxid Med Cell Longev,2022,2022:3659278.
[25]Abe K,Ikeda M,Ide T,et al.Doxorubicin causes ferroptosis and cardiotoxicity by intercalating into mitochondrial DNA and disrupting Alas1-dependent heme synthesis[J].Sci Signal,2022,15(758):eabn8017.
[26]Ichikawa Y,Ghanefar M,Bayeva M,et al.Cardiotoxicity of doxorubicin is mediated through mitochondrial iron accumulation[J].J Clin Invest,2014,124(2):617-630.
[27]Zamorano JL,Lancellotti P,Rodriguez Muoz D,et al.2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines:The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC)[J].Eur Heart J,2016,37(36):2768-2801.
[28]Zhang H,Wang Z,Liu Z,et al.Protective effects of dexazoxane on rat ferroptosis in doxorubicin-induced cardiomyopathy through regulating HMGB1[J].Front Cardiovasc Med,2021,8:685434.
[29]Jirkovsk E,Lencˇová-Popelová O,Hroch M,et al.Early and delayed cardioprotective intervention with dexrazoxane each show different potential for prevention of chronic anthracycline cardiotoxicity in rabbits[J].Toxicology,2013,311(3):191-204.
[30]Fedotcheva TA,Fedotcheva NI.Protectors of the mitochondrial permeability transition pore activated by iron and doxorubicin[J].Curr Cancer Drug Targets,2021,21(6):514-525.
[31]Liu Y,Zeng L,Yang Y,et al.Acyl-CoA thioesterase 1 prevents cardiomyocytes from Doxorubicin-induced ferroptosis via shaping the lipid composition[J].Cell Death Dis,2020,11(9):756.
[32]Wang Y,Yan S,Liu X,et al.PRMT4 promotes ferroptosis to aggravate doxorubicin-induced cardiomyopathy via inhibition of the Nrf2/GPX4 pathway[J].Cell Death Differ,2022,29(10):1982-1995.
[33]Yu W,Chen C,Xu C,et al.Activation of p62-NRF2 axis protects against doxorubicin-induced ferroptosis in cardiomyocytes:a novel role and molecular mechanism of resveratrol[J].Am J Chin Med,2022,50(8):2103-2123.
[34]Luo LF,Guan P,Qin LY,et al.Astragaloside IV inhibits adriamycin-induced cardiac ferroptosis by enhancing Nrf2 signaling[J].Mol Cell Biochem,2021,476(7):2603-2611.
[35]Russo M,Della Sala A,Tocchetti CG,et al.Metabolic aspects of anthracycline cardiotoxicity[J].Curr Treat Options Oncol,2021,22(2):18.
[36]Sheta A,Elsakkar M,Hamza M,et al.Effect of metformin and sitagliptin on doxorubicin-induced cardiotoxicity in adult male albino rats[J].Hum Exp Toxicol,2016,35(11):1227-1239.
[37]Quagliariello V,de Laurentiis M,Rea D,et al.The SGLT-2 inhibitor empagliflozin improves myocardial strain,reduces cardiac fibrosis and pro-inflammatory cytokines in non-diabetic mice treated with doxorubicin[J].Cardiovasc Diabetol,2021,20(1):150.
[38]Asensio-Lopez MC,Sanchez-Mas J,Pascual-Figal DA,et al.Ferritin heavy chain as main mediator of preventive effect of metformin against mitochondrial damage induced by doxorubicin in cardiomyocytes[J].Free Radic Biol Med,2014,67:19-29.
收稿日期:2023-07-19
基金項目:山东省自然科学基金联合基金重点支持项目(ZR2021LZY038);齐鲁医派中医药特色技术整理推广项目(鲁卫函〔2022〕93号);山东省老年医学学会2021年科技攻关项目(LKJGG2021W106)
通信作者:袁杰,E-mail:zyyuanjie2007@163.com

