心肌梗死相关转录本与心血管疾病关系的研究进展
唐赛赛 王莉莉 汤滢秀 李宝燕 林浩
基金项目:校级科研基金项目(编号:2018ky28)
作者简介:唐赛赛,硕士研究生,讲师,研究方向:冠心病与心肌梗死的遗传易感。E-mail:876159912@qq.com
【摘要】心肌梗死相关转录本(MIAT)是一类转录本超过200 Bq的RNA,存在于多种细胞和组织中,其生物学功能多种多样,在心血管系统中发挥重要作用。近年来,多项研究表明,MIAT通过细胞凋亡、增殖、氧化、自噬等多条通路参与高血压(HT)、冠状动脉粥样硬化心脏病(CHD)、急性心肌梗死(AMI)、心肌肥厚(HCM)、心肌病等心血管疾病的发展。本研究将总结MIAT与心血管疾病关系的研究进展,探究其成为心血管疾病诊疗新型标志物的可能性,作如下综述。
【关键词】心肌梗死相关转录本;心血管疾病;表达调控
【中图分类号】R541 【文献标识码】A 【文章编号】2096-2665.2024.02.0.04
DOI:10.3969/j.issn.2096-2665.2024.02.033
心肌梗死相关转录本(myocardial infarction association transcript,MIAT)最早发现于2000年,位于22q12.1[1]。2006年,Ishii 等[2]通过大规模病例对照关联研究发现1个与心肌梗死(myocardial infarction,MI)密切相关的长链非编码RNA,命名为MIAT。有研究表明MIAT与内分泌系统疾病、心血管系统疾病[如心肌病、高血压(hypertension,HT)、冠状动脉粥样硬化性心脏病(coronary atherosclerotic heart disease,CHD;简称冠心病)、MI、微血管功能障碍等]密切相关[3-4]。本研究将总结MIAT与心血管疾病关系的研究进展,探究其成为心血管疾病诊疗新型标志物的可能性,现作如下综述。
1 心血管疾病与MIAT的关系
1.1 动脉粥样硬化与MIAT 动脉粥样硬化(atherosclerosis, AS)是CHD、MI和卒中等心血管疾病的主要病理基础,特点为弹性动脉内膜出现纤维组织和脂质沉积,导致血栓形成、血管壁增厚和动脉硬化[5-6],主要为巨噬、内皮等细胞的变化和相互作用。斑块破裂和栓子脱落是AS发生的重要原因,但机制尚未明确,临床上也无特异防治药物,精准的靶向治疗是一种具有广阔前景的防治AS手段。MIAT在调节内皮细胞功能中起重要作用,MIAT与血管内皮生长因子、miR-150组成反馈环,可促进血管内皮细胞的增殖和异常血管的形成[7]。Li等[8]发现在miR-214-3p/Caspase-1信号轴中可通过敲除MIAT基因减轻AS发展过程中内皮细胞的损伤。Ye等[9]研究发现,MIAT与miR-149-5p结合,可上调CD47的表达,进而抑制晚期AS的胞葬作用。任成龙等[10]研究发现,血管内皮细胞中增加TNF-α刺激时间和浓度会使MIAT表达增加,认为MIAT可能参与血管内皮细胞炎症反应。也有研究发现,MIAT调控人颈动脉平滑肌细胞的增殖、凋亡、表型改变,并参与晚期AS的形成[11]。以上研究都证实了MIAT在AS病变中有调节作用。
1.2 冠心病與MIAT CHD是由于脂质沉积于动脉内膜、粥样脂类物质堆积形成白色斑块,导致动脉管腔狭窄、血流受阻,严重可致心肌细胞缺血、缺氧或坏死。冠状动脉血管造影是目前诊断CHD的金标准,但有创且费用高。因此需寻找一种无创、简便、价格低廉的确诊方法。Tan等[12]研究发现与健康组患者血清MIAT相比,CHD患者MIAT明显增多,且分析发现MIAT是CHD的独立危险因素。还有研究发现,MIAT在检测冠状动脉病变严重程度方面较灵敏[13]。因此,MIAT在预测CHD及冠状动脉病变严重程度具有诊断意义,有可能成为一种新型CHD非侵入性诊断标志物。
1.3 急性心肌梗死与MIAT 急性心肌梗死(acute myocardial infarction,AMI)是在冠状动脉病变基础上冠状动脉血供急剧减少或中断,导致相应心肌严重且持续缺血的疾病。此病好发于老年群体,近年来伴随着老龄化加剧,急性心肌梗死发病率逐年增加,严重威胁患者生命健康[14]。因此,早识别、快诊断、积极治疗对延缓AMI进程、挽救濒死心肌及改善患者预后非常重要。目前,临床将血清心肌肌钙蛋白(cTn)作为诊断急性心肌梗死的标志物,但其易受心房颤动(atrial fibrillation,AF)、心力衰竭等心脏疾病影响[15-16]。因此,寻找早期诊断AMI特异度、灵敏度较高的新型标志物是目前亟待解决的问题。
Ishii等[2]发现有6个MIAT的SNPs与MI易感性密切相关。Vausort等[17]研究发现274例ST段抬高性MI患者比140例非ST段抬高性MI患者的MIAT水平更低。Azat等[18]检测结果显示58例严重ST段抬高性MI患者比不稳定心绞痛患者MIAT增加3倍,且MIAT 3 h开始升高,6 h达峰值,MIAT与心肌肌钙蛋白T(cTnT)、CK成正比。也有研究发现MIAT的 rs9608515和rs5752375两个位点与中国汉族人群MI密切相关[19]。Zang等[20]结扎小鼠冠脉后检测到血清MIAT含量逐渐上升,在1 d左右达到最大值,并于2 d后回到基础水平,证明MIAT含量与MI的面积相关。在MI小鼠模型里,发现MIAT的表达明显上调,且伴随TGF-β1表达上调、miR-24表达下调[21],MIAT过度表达可使心脏重塑加重,MIAT基因缺失还可预防MI[22]。薄洪臣等[23]研究还发现MIAT可通过调控miR-182/Nogo-A使过氧化氢(H2O2)处理过的心肌细胞凋亡,说明MIAT在心肌细胞氧化应激中有十分重要的调控作用。以上研究都提示MIAT与MI存在相关性,且MIAT有希望成为MI更有效的治疗靶点和标志物。
1.4 心房颤动与MIAT AF是以无序、快速的心房电活动为主要特征的室上性心律失常。AF时心房丧失有效收缩和舒张能力导致心脏泵血功能受损或丧失,进而引发严重并发症,威胁患者生命健康。近年来,AF发病率逐年上升,治疗AF的主要方法为导管消融术,其治疗效果良好,但易复发[24],故分析AF患者术后复发的影响因素有利于提高成功率。
MIAT主要通过影响下游基因表达参与介导AF发展[25]。Yao等[26]研究发现,AF患者外周血白细胞中MIAT显著升高。在大鼠AF模型中也出现MIAT表达增加情况,下调MIAT表达可缩短AF模型大鼠QRS、QT、PR间期,进而有效抑制AF大鼠的电重构过程。miR-128-3p是炎症调控因子中重要的一员,其在AF的发展中起到重要作用。研究表明,MIAT的一个下游调控因子为miR-128-3p,下调MIAT的表达可上调miR-128-3p的表达,miR-128-3p的表达增加可影响致纤维化因子和炎性细胞因子的合成、抑制心肌的纤维化和炎症、延缓心室重构,进而改善AF的症状[27]。综上所述,MIAT可能参与介导AF的发展。
1.5 心肌肥厚与MIAT 心肌肥厚(hypertrophic cardiomyopathy,HCM)发病机制为心肌细胞肥大和收缩蛋白增加,发生代偿性心肌肥厚,最终导致失代偿,增加心源性猝死和心力衰竭风险[28]。针对HCM过程中的重要靶分子进行干预是抑制HCM的重要方法,因而应深入了解HCM的机制。Li等[29]研究发现,敲除MIAT基因可增加新生大鼠心室肌细胞中miR-150-5p的表达而降低P300的表达,MIAT通过miR-150-5p /P300信号通路参与HCM的发展,通过作用miR-93调控TLR4从而活化PI3K/Akt /mTOR轴致使HCM发生。MIAT还通过负性调节miR-29a表达,参与HCM心肌细胞纤维化的进程[30],故MIAT有望成为治疗HCM新的靶点。
1.6 心肌病与MIAT 糖尿病心肌病(diabetic cardiomyopathy,DCM)是以代谢和心脏功能障碍为主要特征的糖尿病心血管并发症,可增加AF、HT、MI患者发生心衰的风险[31]。因此,构建有效预防、治疗并改善糖尿病心肌病预后的科学策略十分必要[32]。Zhou等[33]研究表明在DCM大鼠模型中MIAT表达水平上调,MIAT通过结合miR-22-3p,使miR- 22-3p靶基因DAPK2的表达增加,进而促使心肌细胞凋亡。糖尿病心肌缺血再灌注大鼠的心肌组织中MIAT的表达上调,校因子κB(NF-κB)信号轴活化,心功能损伤程度加剧。当降低MIAT表达后,心肌细胞凋亡、炎症损伤、氧化应激等情况得到明显改善[34]。MIAT介导的沉默miR-214-3p也参与DCM的发生[35]。故MIAT参与DCM的发生发展,有可能成为DCM新的治疗靶点。
扩张型心肌病(dilated cardiomyopathy,DCM)的主要特征为一侧或双侧心室扩大,伴随心室收缩能力降低,不伴或伴充血性心力衰竭。美洲锥虫病是由一种可寄宿在多种畜类和野生动物的枯氏锥虫引起,可通过血液、嗜血锥椿叮咬等途径传播。感染美洲锥虫病可引起严重的炎性扩张型慢性心肌病。Frade等[36]发现,比起先天性扩张性心肌病,美洲锥虫病引起的慢性扩张型心肌病大鼠MIAT表达明显上调,揭示MIAT与慢性扩张型心肌病之间存在相关性,MIAT可能成为慢性扩张型心肌病的新型生物标志物。
脓毒症心肌病(septic cardiomyopathy,SCM)是由脓毒症引起的可逆的心脏功能障碍。脓毒症心肌病的发病机制目前还未明确,早诊断、早治疗对其非常重要,但目前脓毒症心肌病的诊断还没有统一标准。机体感染时会发生机体免疫和炎症反应紊乱,可能发展为脓毒症心肌病。MIAT通过miR-330-5p/TRAF6/NF-κB通路促进脓毒症心肌病的炎症和氧化应激,这暗示MIAT可能是脓毒症心肌病重要调控者[37]。综上所述,MIAT参与某些心肌病的进程,可能为心肌病的诊断或预后提供新的依据。
1.7 高血压与MIAT HT是一种患病率高、控制率低的慢性疾病,以体循环动脉压持續升高为特征,常伴有靶器官损害。目前中国HT患病人数高达2.5亿[38]。HT病因复杂,涉及内皮细胞功能紊乱、环境与遗传、炎症、氧化应激等。 研究结果显示MIAT基因的 rs150465374与HT密切相关,并作为高血压发生的独立因素[39]。Azat等[18]研究结果表明AMI患者的MIAT与HT相关。MIAT能影响血管紧张素转换酶基因的表达,或影响肾素-血管紧张素-醛固酮轴(RAA轴)进而调节血压 [40]。因此,MIAT可能参与HT的发病过程,但详细机制还需探索。
1.8 其他心血管疾病与MIAT Zhu等[41]研究发现,与正常对照组相比,189例缺血性脑卒中(ischemic stroke,IS)患者外周血白细胞中MIAT表达明显上调,且高表达MIAT的IS患者比低表达MIAT的IS患者预后更差,这预示MIAT可能成为诊断IS和判断预后的标志物。Yan等[42]研究发现MIAT参与糖尿病患者视网膜微血管功能紊乱,实时定量聚合酶钳式反应(PCR)分析显示糖尿病小鼠视网膜和内皮细胞MIAT水平明显升高,敲除MIAT能缓解视网膜血管渗漏,MIAT还影响视网膜微血管的稳定性。此外,糖尿病患者视网膜中血管内皮生长因子被上调,通过沉默MIAT可减少上调作用, MIAT与miR-150-5p结合能促进血管内皮生长因子的表达,进而形成异常血管。敲除MIAT基因可提高心功能、抑制心肌间质纤维化,影响心肌毛细管密度[43]。因此,推测其在心血管疾病发生发展中起到重要作用。
2 结语
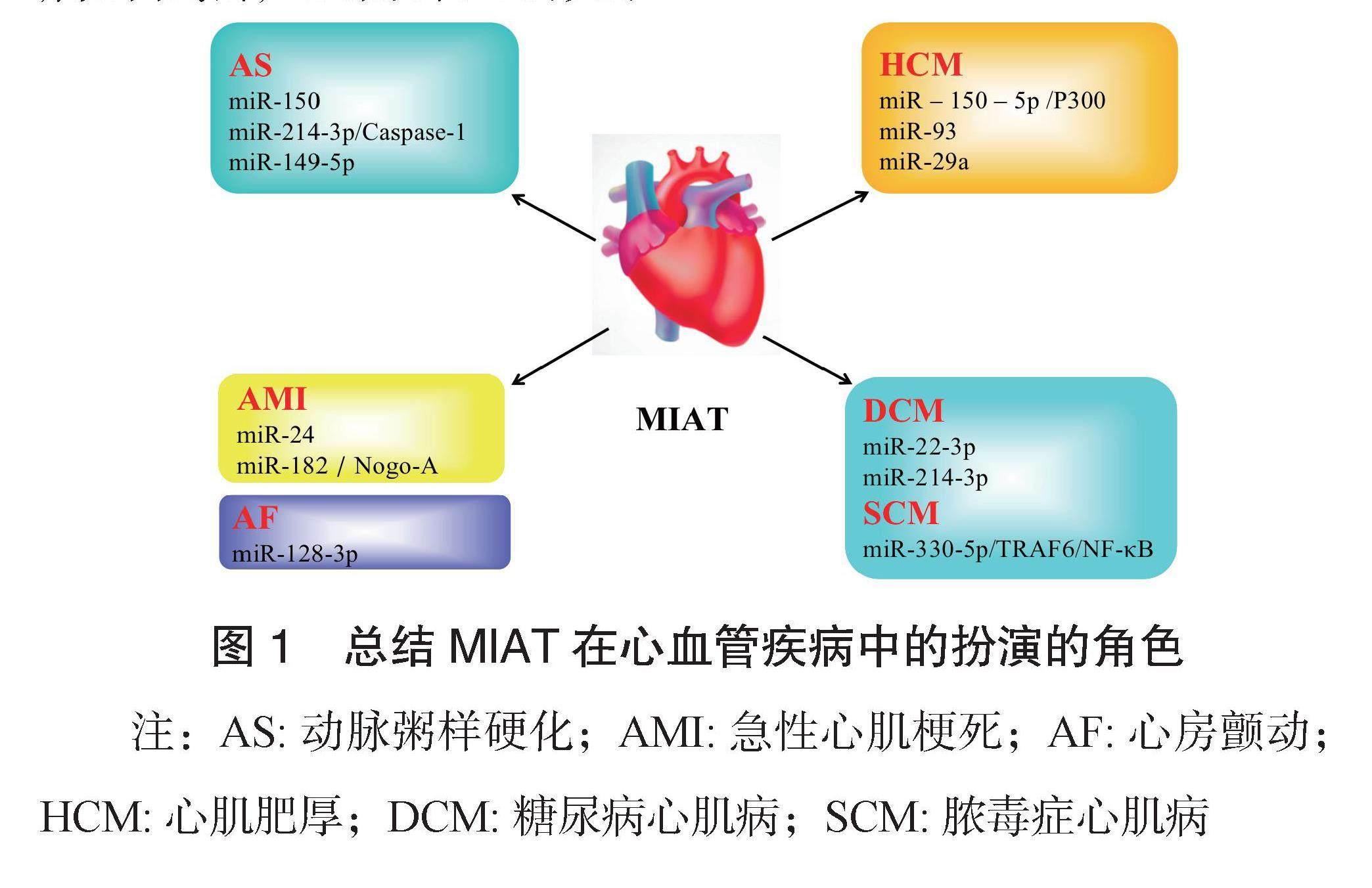
目前,MIAT已显示出作为心血管疾病调节因子的特有魅力,见图1。用相关药物或靶基因调控患者异常表达的MIAT,或许有助于减慢心血管疾病的进程。综上所述,MIAT有可能作为诊断心血管疾病标志物或治疗心血管疾病的靶点,还需深入研究。
图1 总结MIAT在心血管疾病中的扮演的角色
注:AS:动脉粥样硬化;AMI:急性心肌梗死;AF:心房颤动;HCM:心肌肥厚;DCM:糖尿病心肌病;SCM:脓毒症心肌病
参考文献
OHNISHI Y, TANAKA T, YAMADA R, et al. Identification of 187 single nucleotide polymorphisms ( SNPs) among 41 candidate genes for ischemic heart disease in the Japanese population[J]. Hum Genet, 2000, 106( 3) : 288-292.
ISHII N, OZAKI K,SATO H, et al. Identification of a novel non coding RNA, MIAT, that confers risk of myocardial infarction[J]. J Hum Genet, 2006, 51(12): 1087-1099.
顾艳霞, 刘信信, 蔡璐, 等. 长链非编码RNA MIAT在心血管疾病发生发展中的研究进展[J]. 中国现代医生, 2021, 59(07): 183-187, 192.
ZHOU X, ZHANG W, JIN M, et al. lncRNA MIAT functions as a competing endogenous RNA to upregulate DAPK2 by sponging miR-22-3p in diabetic cardiomyopathy[J]. Cell Death Dis, 2017, 8(7): e2929.
ZHANG T, LIU J, CHEN X, et al. Endothelial foxp1 suppresses atherosclerosis via modulation of Nlrp3 inflammasome activation[J]. Circ Res, 2019, 125(6): 590-605.
XIAO H,LU M,LIN T Y, et al. Sterol regulatory element binding protein 2 activation of NLRP3 inflammasome in endothelium mediates hemodynamic-induced atherosclerosis susceptibility[J]. Circulation, 2013, 128(6): 632-642.
YAN B, YAO J, LIU J Y, et al. LncRNA-MIAT regulates microvascular dysfunction by functioning as a competing endogenous RNA[J]. Circ Res, 2015, 116(7): 1143-1156.
LI T, TU P, BI J, et al.LncRNA Miat knockdown alleviates endothelial cell injury through regulation of miR-214-3p/Caspase-1 signalling during atherogenesis[J]. Clin Exp Pharmacol Physiol, 2021, 48(9): 1231-1238.
YE ZI, YANG S ,XIA Y, et al.LncRNA MIAT sponges miR-149-5p to inhibit efferocytosis in advanced atherosclerosis through CD47 upregulation[J]. Cell Death Dis, 2019, 10(2): 138.
任成龍, 张璐, 宁险峰, 等. LncRNA-MIAT 在肿瘤坏死因子-α介导的血管内皮细胞炎症中的表达及作用[J]. 中国循环杂志, 2017, 32( 6) : 607-611.
FASOLO F,JIN H,WINSKI G, et al. Long noncoding RNA MIAT controls advanced atherosclerotic lesion formation and plaque destabilization[J]. Circulation, 2021, 144(19): 1567-1583.
TAN J, LIU S, JIANG Q, et al. LncRNA-MIAT increased in patients with coronary atherosclerotic heart disease [J]. Cardiol Res Pract, 2019(25): 6280194.
TORAIH E A, E L-WAZIR A,ALGHAMDI S A, et al.Association of long non-coding RNA MIAT and MALAT1 expression profiles in peripheral blood of coronary artery disease patients with previous cardiac events[J]. Genet Mol Biol, 2019, 42(3): 509-518.
丁学智, 韩战营, 杨巧丽. miR-181a在老年急性心肌梗死血清中的表达及其临床意义[J]. 中国循证心血管医学杂志, 2018, 10(1): 104-106, 111.
ATTANASIO F, CARRER P,ZURLO A, et al. Prognostic value of cardiac troponin I assay in hospitalized elderly patients[J]. Aging Clin Exp Res, 2018, 31(2): 233-239.
吴忠璟, 夏可辉, 鐘书刚. 血清Copeptin、BNP及cTnI在老年急性ST段抬高型心肌梗死诊断中的价值[J]. 中华全科医学, 2019, 17(8) : 1368-1371.
VAUSORT M,WAGNER D R,DEVAUX Y. Long noncoding RNAs in patients with acute myocardial infarction[J]. Circ Res,2014,115(7): 668-677.
AZAT M, HUOJIAHEMAITI X, GAO R, et al. Long noncoding RNA MIAT: A potential role in the diagnosis and mediation of acute myocardial infarction[J]. Mol Med Rep, 2019, 20(6): 5216-5222.
MA R, HE X, ZHU X, et al. Promoter polymorphisms in the LncRNA-MIAT gene associated with acute myocardial infarction in Chinese Han population: A case-control study[J]. Bioscience Reports, 2020, 40(2): BSR20191203.
ZANG J, ZHANG L,VAUSORT M, et al.Identification of candidate long non -coding RNAs in response to myocardial infarction[J]. BMC Genomics, 2014, 15(1): 460.
QU X, DU Y, SHU Y, et al.MIAT is a Pro-fibrotic long noncoding RNA governing cardiac fibrosis in post -infarct myocardium[J]. Sci Rep, 2017(7): 42657.
AONUMA T, MOUKETTE B, KAWAGUCHI S, et al. MiR-150 attenuates maladaptive cardiac remodeling mediated by long noncoding RNA MIAT and directly represses profibrotic Hoxa4[J]. Circ Heart Fail, 2022, 15(4): e008686.
薄洪臣, 谢鲁寒, 刘赵放, 等. LncRNA-MIAT通过miR-182/Nogo-A调控氧化应激所致心肌细胞凋亡的机制[J/OL]. 临床与实验病理学杂志, 2023(9): 1084-1094.
贺嘉, 陈雄彪, 张澍, 等. 冷冻球囊消融治疗心房颤动一年随访结果分析[J]. 中华心律失常学杂志, 2016, 20(4): 332-335.
马如超, 闫波. 心肌梗死长链非编码 RNA-相关转录本基因与心血管疾病研究进展[J]. 心肺血管病杂志, 2018, 37(10): 942-943, 951.
YAO L, ZHOU B,YOU L, et al.LncRNA-MIAT/miR-133a- 3p axis regulates atrial fibrillation and atrial fibrillation induced myocardial fibrosis[J].Mol Biol Rep, 2020, 47(4): 2605-2617.
邢佳侬, 梁卓, 邢爱君, 等.LncRNA-MIAT靶向调节miR-128-3p对心房颤动大鼠心室重构和心肌纤维化的影响[J]. 天津医药, 2022, 50(9): 932-937.
SHIMIZU I, MINAMINO T. Physiological and pathological cardiac hypertrophy[J]. J Mol and Cell Cardiol, 2016, 97: 245-262.
LI Z, LIU Y, GUO X, et al. Long noncoding RNA myocardial infarction associated transcript is associated with the microRNA 150-5p /P300 pathway in cardiac hypertrophy[J]. Int J Mol Med, 2018, 42(3): 1265-1272.
ZHOU J, ZHOU Y, WANG C X.LncRNA-MIAT regulates fibrosis in hypertrophic cardiomyopathy (HCM) by mediating the expression of miR-29a-3p[J].J Cell Biochem, 2018, 120(5): 7265-7275.
郭源辉, 段佳佳, 刘传鑫, 等. 核因子E2相关因子2介导的铁死亡在糖尿病心肌病中的发病机制及其靶向治疗研究进展[J]. 新乡医学院学报, 2023, 40(12): 1178-1183.
GILCA G E, STEFANESCU G,BADULESCU O, et al. Diabetic cardiomyopathy: Current approach and potential diagnostic and therapeutic targets[J]. J Diabetes Res, 2017: 1310265-1310271.
ZHOU X,ZHANG W, JIN M, et al.LncRNA-MIAT functions as a competing endogenous RNA to upregulate DAPK2 by sponging miR -22-3p in diabetic cardiomyopathy[J]. Cell Death Dis, 2017, 8(7): e2929.
LIU Y, WANG T, ZHANG M, et al. Down-regulation of myocardial infarction associated transcript 1 improves myocardial ischemia-reperfusion injury in aged diabetic rats by inhibition of activation of NF-κB signaling pathway[J]. Chem Biol Interact, 2019, 300: 111-122.
QI Y, WU H, MAI C, et al. LncRNA-MIAT-mediated miR-214-3p silencing is responsible for IL-17 production and cardiac fibrosis in diabetic cardiomyopathy[J]. Front Cell Dev Biol, 2020, 8: 243.
FRADE A F, LAUGIER L, FERREIRA L R, et al. Myocardial infarction-associated transcript,a long noncoding RNA, is overexpressed during dilated cardiomyopathy due to chronic chagas disease[J]. J Infect Dis, 2016, 214(1): 161-165.
XING P C, AN P, HU G Y, et al. LncRNA-MIAT promotes infammation and oxidative stress in sepsis induced cardiac injury by targeting miR-330-5p/TRAF6/NF-kB Axis[J]. Biochem Genet, 2020, 58(5): 783–800.
WANG Z, CHEN Z, ZHANG L,et al. Status of hypertension in China: Results from the China hypertension survey, 2012-2015[J]. Circulation, 2018, 137(22): 2344-2356.
張业欣, 闫波, 马如超.LncRNA-MIAT基因单核苷酸多态性在高血压中的相关性分析[J]. 临床检验杂志, 2019, 37(12): 919-922.
BAI Y, WANG W, ZHANG Y, et al.LncRNA-MIAT suppression alleviates corneal angiogenesis through regulating miR-1246/ACE[J].Cell Cycle, 2019(18): 661-669.
ZHU M, LI N, LUO P, et al. Peripheral blood leukocyte expression of LncRNA-MIAT and its diagnostic and prognostic value in ischemic stroke[J]. J Stroke Cerebrovasc Dis, 2018, 27(2): 326-337.
YAN B, YAO J, LIU J Y, et al.LncRNA-MIAT regulates microvascular dysfunction by functioning as a competing endogenous RNA[J]. Circ Res, 2015, 116(7): 1143-1156.
YANG L, DENG J,MA W, et al. Ablation of LncRNA-MIAT attenuates pathological hypertrophy and heart failure[J]. Theranostics, 2021, 11(16): 7995-8007.

