解剖性肝切除术后腹腔感染的影响因素及早期血清指标预测价值*
何承峻, 陈廷昊, 彭强, 王健宇
(资阳市第一人民医院 普外科, 四川 资阳 641300)
原发性肝癌(primary liver cancer,PLC)为源于肝细胞或肝内胆管上皮细胞,且发病隐匿、恶性程度高的消化系统常见恶性肿瘤,也是癌症致死的常见病因,在我国PLC发病率呈逐年上升趋势且预后多较差[1]。PLC发病早期临床症状不明显,若未重视可能使患者错失最佳治疗时机,且其对放化疗敏感性较低,临床常予以手术切除,其中腹腔镜下肝切除术是主要术式,且和传统开腹手术相比,有微创、并发症低等优势,尤其是为确保手术安全,在精准的解剖下进行肝切除,精细化操作,在离断肝实质时避免了胆管及大血管破坏,可降低术中出血几率,且保全剩余肝脏供血功能,为改善残余肝功能提供保证[2]。腹腔感染为任何腹腔内器官(包括腹膜)的感染,是肝癌切除术后主要并发症之一,尤其是解剖性肝切除术后有一定的腹腔感染发生风险,这会引起术后创口愈合率低,甚至发生呼吸衰竭,导致PLC病例的死亡与预后不良风险上升,因而明确腹腔感染特点并采取针对性干预措施有重要意义[3-4]。本研究主要评估解剖性肝切除术后腹腔感染的发生情况及其影响因素、早期感染性血清指标[C反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、白介素-6(interleukin 6,IL-6)及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)]对其预测价值,报告如下。
1 对象与方法
1.1 对象
选取2019年3月—2021年3月某医院行解剖性肝切除术患者100例。依据外科感染学会修订的《腹内感染处理指南》[5]对术后腹腔感染予以判断,确诊感染者均接受统一的规范性抗菌药物治疗。依据术后是否发生腹腔感染分为感染组(n=25)和非感染组(n=75)。严重感染诊断依据2012年国际脓毒症、严重脓毒性休克诊断与治疗指南[6]进行判断,最终将腹腔感染者分为严重感染、局部感染。纳入范围:(1)均初诊为PLC,予以开放性肝脏手术,术前麻醉分级Ⅱ~Ⅲ级,且肝脏储备功能量化评估分级标准Child-Pugh为A级;(2)炎性指标、心肺功能在术前未见明显的异常变化,未开展再次手术;(3)患者及家属依从性良好,签署手术知情同意书。排除标准:(1)术前合并严重心、脑、肾等重要脏器功能障碍或肝外远处转移者;(2)不符合解剖性肝切除术手术指征或接受其他手术者;(3)有腹部手术史或相关药物过敏史。
1.2 方法
1.2.1手术方法 所有患者均予以解剖性肝切除术。在入室后均静注的咪达唑仑0.02 mg/kg和舒芬太尼0.2 μg/kg,同时予以维库溴铵0.1 mg/kg及丙泊酚1~2 mg/kg静注,患者接受全麻后开展插管、机械通气,潮气量设为6~8 mg/kg,呼吸比=1∶2。均开展左桡动脉穿刺置管,对动脉压予以监测,右颈内静脉穿刺置管以对中心静脉压予以监测,术中给予4~8 mg/(kg·h)的丙泊酚+0.2 μg/(kg·h)的右旋美托咪定+1 μg/(kg·min)的顺式阿曲库铵进行麻醉维持,保持平均动脉压>70 mmHg,中心静脉压<5 cmH2O,心率<100 次/min,尿量0.5 mL/(kg·h),呼吸末CO2处于35~45 mmHg,脑电双频指数维持于40~60,术中均予以保温措施。术中依据手术规划开展解剖性肝切除术,先对肝门部结构予以解剖,后对相应的肝蒂进行处理,按照肝脏缺血线对肝切除范围予以明确。
1.2.2病原菌检测 收集术后腹腔感染患者的腹腔引流液(在术前穿刺时收集到的作为分析样本)开展细菌培养,参照文献[7]进行分离纯化,以Vitek-2全自动微生物鉴定药敏系统与API试条(法国梅里埃公司)鉴定所收集到的菌株。
1.2.3资料收集 收集入组病例的性别、年龄及合并基础疾病(如高血压、糖尿病及高脂血症等)、黄疸、肝硬化、术前白蛋白(albumin,Alb)、白细胞计数、采集标本前使用抗菌药物时间、手术相关指标(手术时间、术中出血量、胶体使用量、晶体使用量、输液总量、肝门阻断时间、中心静脉压、低血压次数)、胆肠吻合方式、引流管放置时间、肝切除范围、尿量、术后腹水及术后胆瘘等。对比感染组与非感染组临床资料,分析影响腹腔感染的因素。
1.2.4预后转归情况及肝功能指标 分析感染组与非感染组的预后转归情况及肝功能[总胆红素(total bilirubin,TBIL)、直接胆红素(direct bilirubin,DBIL)、丙氨酸氨基转移酶(alamine aminotransferase,ALT)和门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、凝血酶原时间(prothrombin time,PT)]变化。
1.2.5早期感染性血清指标检测 均抽取术前、术后第1天和第3天时空腹静脉血4 mL,3 000 r/min速率离心10 min分离血清。采用免疫比浊法测定CRP,免疫化学发光法测定PCT,试剂盒均由武汉默沙克生物科技有限公司提供;夹心酶联免疫法测定IL-6及TNF-α水平,以MK3型多功能酶标仪及相关试剂(Thermo公司提供)进行测定。对比感染组与非感染组的早期感染性血清指标,分析早期感染性血清指标对腹腔感染的预测价值。
1.3 统计学处理
2 结果
2.1 病原菌分布特点
25例发生腹腔感染(25.00%),其中严重感染6例,局部感染19例。共检出病原菌42株,主要病原菌为大肠埃希菌、肺炎克雷伯菌、屎肠球菌。见表1。
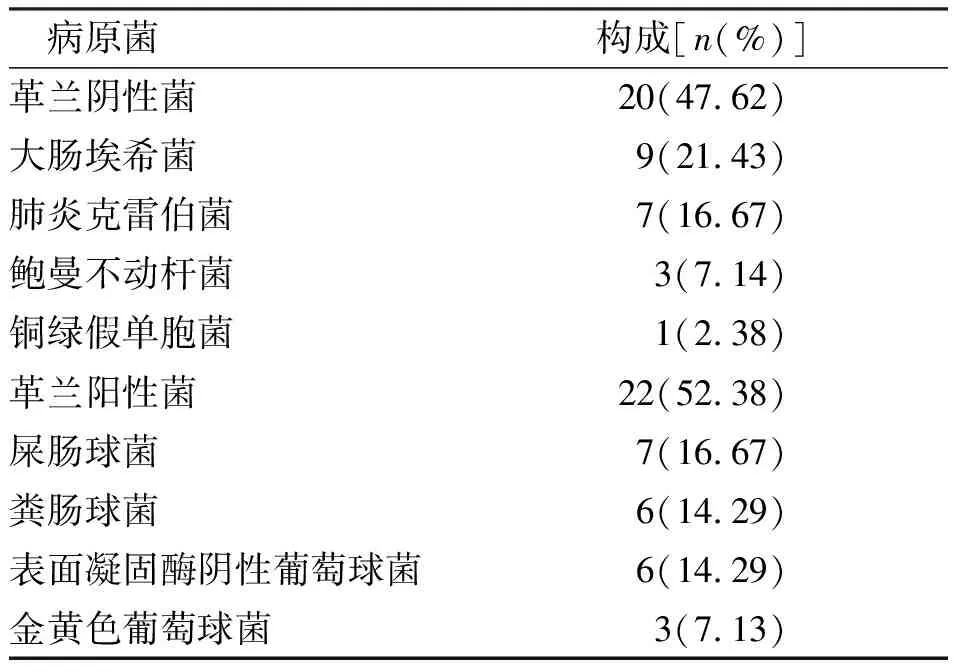
表1 解剖性肝切除术后患者腹腔感染的病原学特点Tab.1 Etiological characteristics of abdominal infection
2.2 两组临床资料比较
感染组年龄、合并糖尿病、黄疸、肝硬化、术中胶体使用量、术中晶体使用量、术中输液总量、胆管切开引流或胆肠吻合、术后腹水、术后胆瘘比例高于非感染组,感染组手术时间、术中肝门阻断时间较非感染组延长,感染组术前Alb低于非感染组(P<0.05),两组其他资料比较,差异无统计学意义(P>0.05)。见表2。
表2 感染组、非感染组临床资料比较Tab.2 Comparison of clinical data between the infected group and the non-infected
2.3 影响解剖性肝切除术后腹腔感染的多因素分析
年龄、合并糖尿病、手术时间、术中胶体使用量、行胆管切开引流或胆肠吻合为解剖性肝切除术后发生腹腔感染的独立危险性因素(P<0.05),而血清Alb是保护性因素(P<0.05)。见表3。
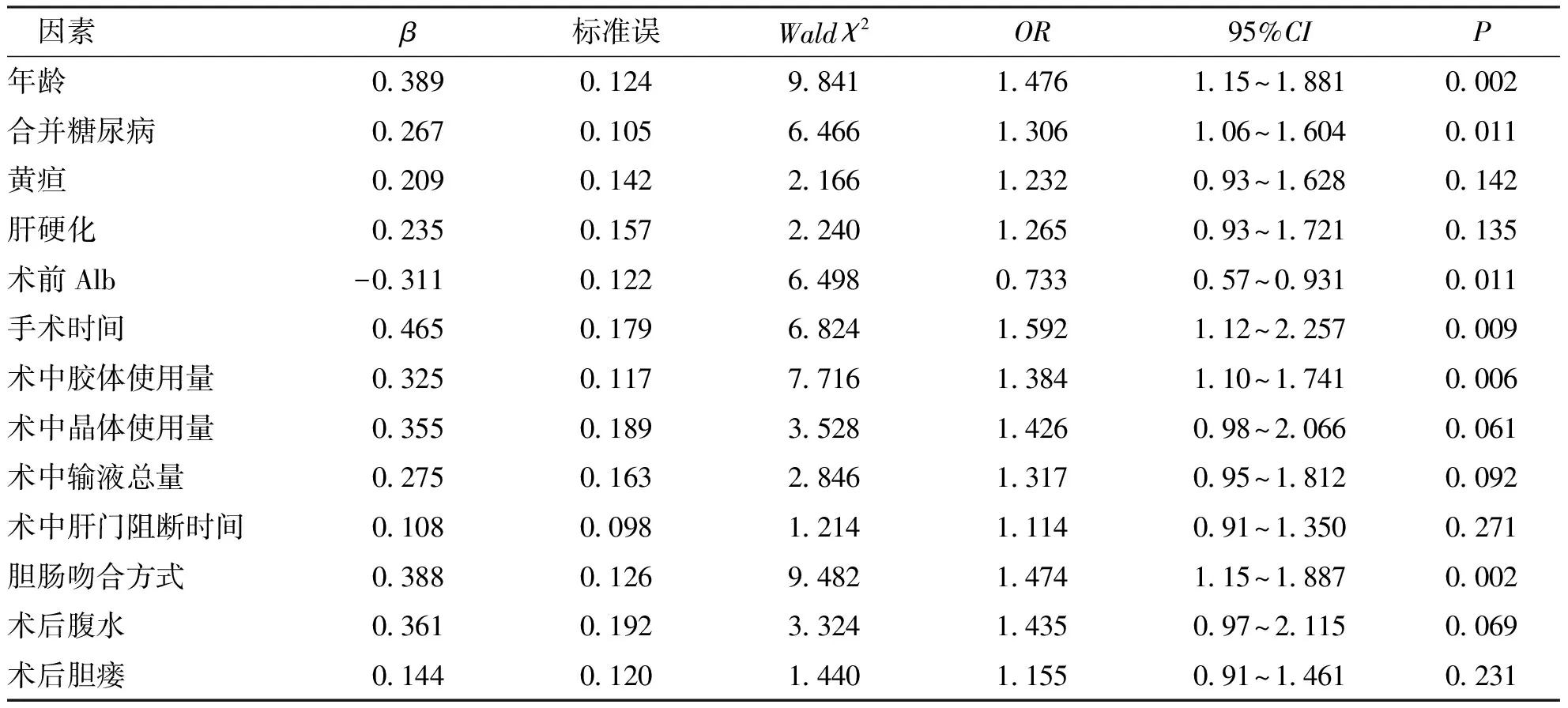
表3 影响解剖性肝切除术后腹腔感染的多因素分析Tab.3 Multivariate analysis of abdominal infection after anatomical hepatectomy
2.4 感染组、非感染组的预后转归情况、肝功能比较
感染组住院时间较非感染组延长,感染组住院费用较非感染组更高(P<0.05);感染组术前DBIL、ALT及术后第1天 DBIL高于非感染组(P<0.05);两组其他肝功能指标变化比较,差异无统计学意义(P>0.05);两组28 d死亡率比较,差异无统计学意义(P>0.05)。见表4。

表4 感染组、非感染组的预后转归情况、肝功能比较Tab.4 Comparison of prognostic outcomes between the infected group and the non-infected
2.5 两组早期感染性血清指标比较
感染组术后第1天、第3天时CRP、PCT、IL-6、TNF-α均低于同组术前(P<0.05);感染组术前、术后第1天、第3天时CRP、PCT、IL-6、TNF-α均高于非感染组(P<0.05)。见表5。

表5 感染组、非感染组的早期感染性血清指标变化比较Tab.5 Comparison of changes in early infectious serum indexes between the infected group and the non-infected group
2.6 早期感染性血清指标预测腹腔感染的价值
术后3 d内平均CRP、PCT、IL-6、TNF-α预测腹腔感染的AUC分别为0.821、0.817、0.813、0.772。见表6。
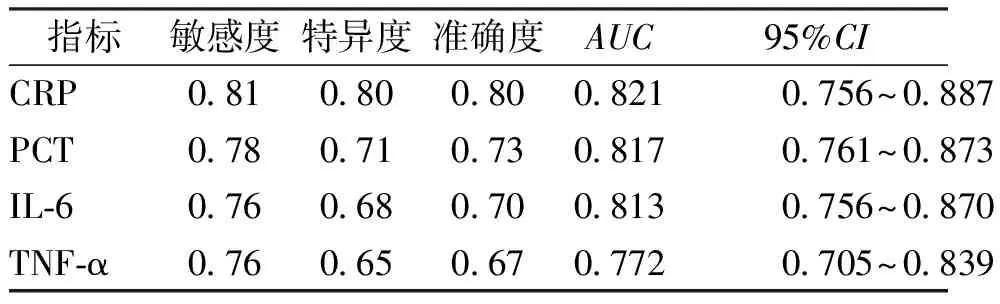
表6 早期感染性血清指标预测腹腔感染的价值Tab.6 Value of early infectious serum indexes in predicting abdominal infection
3 讨论
解剖性肝切除术通过将PLC的供血门静脉所属肝段完全切除,从而有效防止术后门脉系统癌细胞发生远处转移,减少术后复发与转移率,然而肝脏的血供较为丰富,经肝切除术对患者造成的创伤较大,且手术曲线复杂、风险也较高,术后若发生腹腔感染会降低手术疗效,不利于患者的预后[7-8]。早期有研究发现,789例PLC患者术后240例发生并发症,其中感染性并发症有19例,而肿瘤直径、术中出血量及门静脉癌栓对预后有独立性影响[9]。李泽等[10]发现,年龄大、结直肠手术、手术时间较长为急诊腹部手术患者发生手术部位感染的独立危险因素,然而目前关于解剖性肝切除术后腹腔感染的危险因素分析及早期预测指标研究较少。本次解剖性肝切除术后腹腔感染率达25.00%,大肠埃希菌、肺炎克雷伯菌及屎肠球菌为主要的致病菌,与王宇晖等[11]的研究有相似之处,且本次革兰氏阳性菌占比52.38%较革兰阴性菌47.62%高,表明革兰阳性菌构成比有大幅度升高趋势,这可能和腹腔感染的细菌分布加上术后常规预防性地使用抗菌药物有关。预防性应用抗菌药物时多选择头孢菌素类,其抗菌谱较广泛,长期使用后导致肠球菌属的耐药程度上升,最终引起革兰阳性菌的检出比例上升[12]。本次也发现,感染组的住院时间、住院费用均较非感染组多,且感染组手术前后肝功能(DBIL、ALT)变化较非感染组大,因此腹腔感染可增加患者住院时间,与肝功能改变有关联,需予以针对性干预措施,减少腹腔感染发生风险,且依据细菌培养结果选择合适药物予以针对性治疗[13]。本研究也发现年龄、合并糖尿病、手术时间、术中胶体使用量、行胆管切开引流或胆肠吻合为解剖性肝切除术后腹腔感染的独立危险因素,而血清Alb为保护因素。年龄偏高的患者身体机能、免疫力本身呈进行性下降,在接受解剖性肝切除术后更易受病原菌感染,因此其腹腔感染风险增加[14];合并糖尿病的患者体内为高血糖状态,这势必引起细菌繁殖,使肠道的细菌滋生和移位,导致腹腔感染风险上升[15-16]。手术时间较长可引起机体受损,创面长时间的暴露也会使腹腔感染风险升高[17],研究发现,随手术时间延长与术中出血量的增加,肝切除术后患者发生严重并发症的风险也随之上升[18];术后Alb水平较低可提示肝脏储备能力降低,也意味着患者存在营养不良,最终会导致术后感染率攀升[19],既往有研究发现,Alb对复杂性腹腔感染有明显影响[20],本次也发现Alb为腹腔感染的保护因素。明胶是临床上补充患者的血容量所最常用人工胶体液,但会损害机体内吞噬细胞的活性,发生免疫抑制,加重炎症反应,使腹腔感染风险增加,此外胆管空肠吻合可引起肠蠕动功能异常,肠道菌群分布也受影响[21-22],因此腹腔感染率也增加。
血清相关指标如CRP、PCT是判断早期感染的重要指标[23],而IL-6对炎性介质有趋化作用,同时TNF-α可促进IL-6释放,使免疫炎性反应加重[24-25],也有研究[26]报道CRP、PCT、IL-6、TNF-α对判断腹腔感染程度方面也有积极意义。本次发现感染组手术前后CRP、PCT、IL-6、TNF-α均较非感染组高,且术后第3天内平均CRP、PCT、IL-6、TNF-α预测腹腔感染的ROC曲线AUC分别为0.821、0.817、0.813、0.772,与冯星源等[27]的研究相似,表明早期感染性血清指标CRP、PCT、IL-6、TNF-α对腹腔感染有一定预测价值,对其进行监测有重要意义,可帮助判断患者病情及腹腔感染风险。
综上所述,解剖性肝切除术患者受年龄、合并糖尿病、术前Alb、手术时间、术中胶体使用量、行胆管切开引流或胆肠吻合等因素影响有一定的腹腔感染风险,早期感染性血清指标CRP、PCT、IL-6、TNF-α对腹腔感染有一定预测价值,可加以监测。

