乳腺癌新辅助治疗前后HER-2低表达及其变化和临床意义*
汪静,夏天,龙鑫,杨青坤,文雪,肖秀丽
646000 四川 泸州,西南医科大学附属医院 病理科(汪静、夏天、杨青坤、文雪、肖秀丽);646000 四川 泸州,西南医科大学 临床医学院(龙鑫)
2020年全球癌症数据显示,乳腺癌已成为全球女性最常见的恶性肿瘤[1]。临床上根据雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)、Ki-67表达水平将乳腺癌分为不同分子亚型并制定相应新辅助治疗(neoadjuvant therapy,NAT)方案,可达到缩小肿瘤体积、降低临床分期、评估耐药情况、提高可手术率及保乳率的目的[2],最终提高乳腺癌患者的生存率。病理完全缓解(pathological complete response, pCR)定义为乳腺原发灶无浸润性癌且区域淋巴结无癌细胞[3],是NAT患者预后的最佳预测指标[4]。不同分子亚型乳腺癌患者的NAT疗效存在差异。HER-2是乳腺癌重要的预后指标,HER-2阳性乳腺癌具有高侵袭性、预后差的特点,曲妥珠单抗等靶向药物能够改善此类患者的预后[5]。既往靶向治疗主要针对HER-2过表达乳腺癌,近年来,新型抗体药物偶联物(antibody-drug conjugate,ADC)的临床试验结果提示HER-2低表达患者也可从靶向治疗中获益[6]。本研究对458例接受NAT的乳腺癌患者进行回顾性分析,旨在探讨乳腺癌NAT前后HER-2低表达情况及其变化和临床意义。
1 资料与方法
1.1 研究对象
选取2020年1月至2022年12月于西南医科大学附属医院接受NAT的乳腺癌患者为研究对象。纳入标准:①病灶为单侧且经空芯针穿刺活检确诊为浸润性乳腺癌;②影像学提示无远处转移;③既往无针对肿瘤的放疗、化疗及内分泌治疗史;④临床及病理数据完整。排除标准:①双侧乳腺癌;②合并其他恶性肿瘤;③已有远处转移;④NAT疗程小于4个周期者;⑤临床病理资料缺失。
1.2 分组标准
对空芯针穿刺标本及NAT后残留浸润性癌灶的标本行免疫组织化学(immunohistochemistry,IHC)检测,根据2019版中国乳腺癌HER-2检测指南[7]及2018版美国临床肿瘤协会/美国病理学家协会检测指南(ASCO/CAP)[8]对HER-2进行判读:0:无着色或≤10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色;1+:>10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色;2+:>10%的浸润癌细胞呈现弱-中等强度的完整细胞膜染色或≤10%的浸润癌细胞呈现强而完整的细胞膜染色;3+:>10%的浸润癌细胞呈现强、完整且均匀的细胞膜染色。对于2+的病例,采用荧光原位杂交(fluorescence in situ hybridization,FISH)进一步检测,将HER-2 IHC 3+或IHC 2+/FISH+定义为HER-2阳性,IHC 1+或IHC 2+/FISH-定义为HER-2低表达,IHC 0定义为HER-2阴性。根据2010版ASCO/CAP检测指南[9],激素受体(hormone receptor,HR)阳性定义为ER和/或PR≥1%肿瘤细胞核染色,ER和PR<1%肿瘤细胞核染色为阴性。Ki-67低表达定义为≤30%肿瘤细胞核染色,>30%肿瘤细胞核染色为高表达[3]。根据IHC和FISH结果将病例分为:Luminal型(HR阳性且HER-2阴性/低表达)、三阴性(HR阴性且HER-2阴性/低表达)和HER-2过表达型(HER-2阳性,无论HR状态)。
1.3 统计学方法
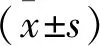
2 结 果
2.1 临床病理资料
共纳入458例乳腺癌NAT患者,年龄范围29~78岁,平均(50.10±8.62)岁。绝经前患者224例,绝经后患者234例;左乳肿块260例,右乳肿块198例;浸润性导管癌427例,浸润性小叶癌9例,其他类型浸润性癌22例;区域淋巴结有转移者308例。Miller-Payne分级1~5级分别为10例、52例、125例、82例、189例。Luminal型141例,三阴性98例,HER-2过表达型219例。
2.2 NAT前HER-2低表达与阴性乳腺癌的临床病理特征比较
纳入的458例患者NAT前HER-2状态分别为:阳性219例(47.82%)、低表达160例(34.93%)、阴性79例(17.25%)。HER-2低表达组与阴性组在年龄、组织学分级、淋巴结转移、HR状态、Ki-67表达水平、Miller-Payne分级等差异有统计学意义(均P<0.05;表1)。

表1 NAT前HER-2状态与临床病理特征的关系
2.3 HER-2状态与NAT疗效的关系
458例患者接受NAT后,有187例(40.83%)达到pCR,271例(59.17%)为非pCR。HER-2低表达组的pCR率(17.50%)低于阳性组(59.36%)和阴性组(36.71%),差异有统计学意义(均P<0.05;图1A)。Luminal型患者中,HER-2低表达组的pCR率低于HER-2阴性组,差异有统计学意义(11.40%vs33.33%,P=0.005);三阴性患者中,HER-2低表达组的pCR率与HER-2阴性组患者相当(32.61%vs38.46%,P=0.546;图1B)。
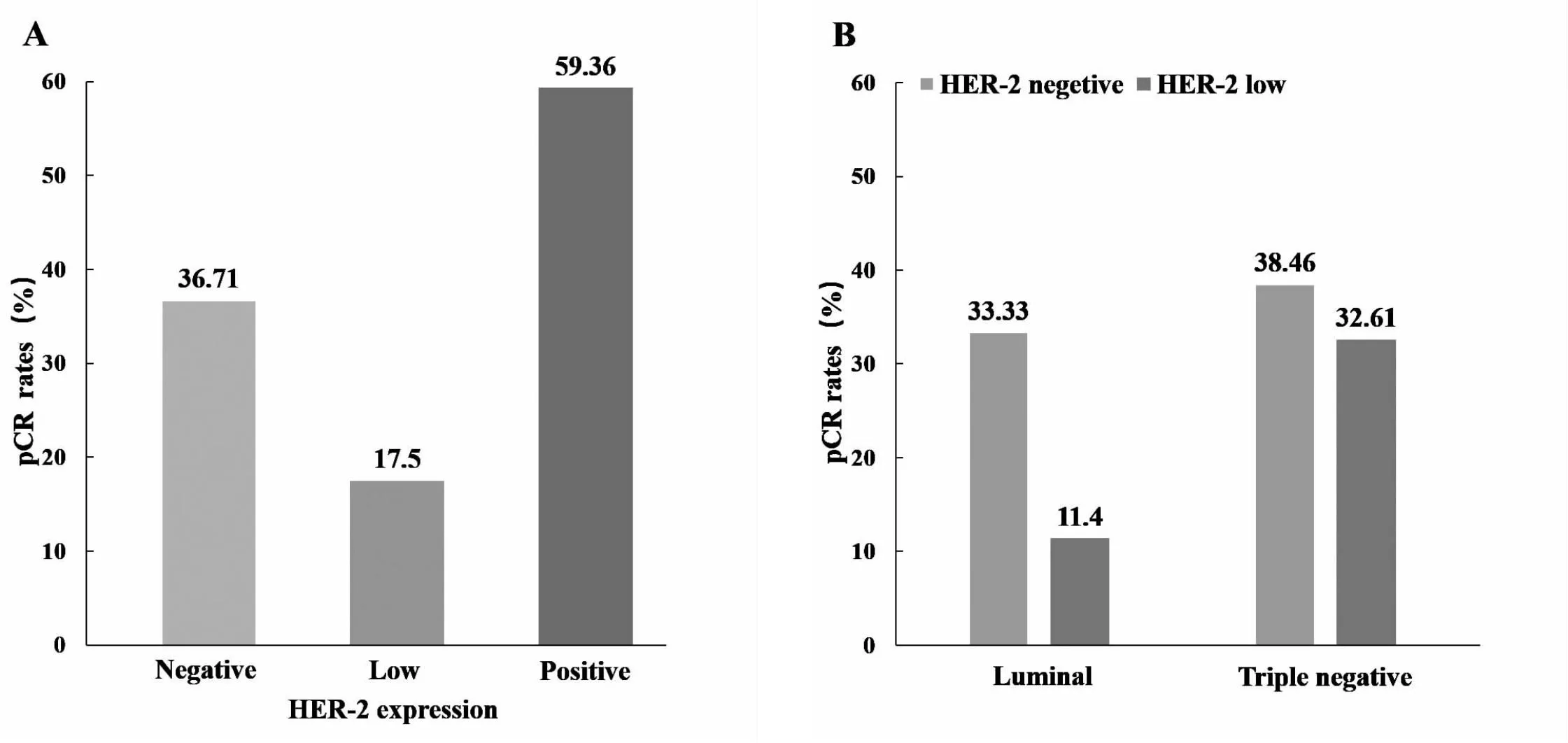
图1 根据HER-2状态或分裂的pCR比较
2.4 NAT前后HER-2状态的一致性分析
2.4.1 218例乳腺癌患者NAT前后HER-2转变情况 271例非pCR患者中有218例在NAT后行IHC检测且HER-2状态明确,患者原发肿瘤与残留病灶的HER-2状态见表2。NAT前后乳腺癌HER-2状态差异具有统计学意义(Kappa=0.675,P<0.001),HER-2状态不一致率为19.27%(42/218),其中HER-2阴性转变为低表达占10.09%(22/218)最常见;HER-2低表达转变为阴性占3.21%(7/218)、转变为阳性占2.75%(6/218);HER-2阳性转变为低表达占3.21%(7/218);HER-2阴性和阳性患者之间未见转变(表3、图2)。
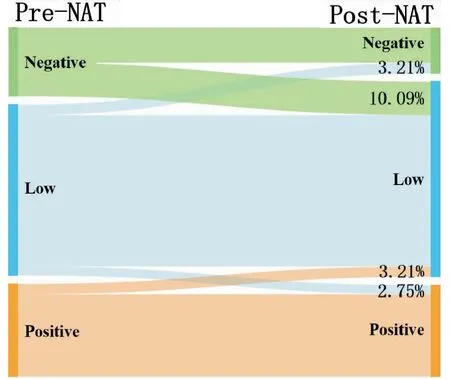
图2 NAT前后HER-2状态的转变

表2 218例乳腺癌患者NAT前后HER-2表达状况[N(%)]

表3 218例乳腺癌患者NAT前后HER-2状态的变化情况比较
2.4.2 157例Luminal型和三阴性乳腺癌患者NAT前后HER-2转变情况 NAT前HER-2阴性及低表达的患者有157例,其中Luminal型101例(64.33%),三阴性56例(35.67%)。HER-2前后状态不一致率为22.29%(35/157)。Luminal型患者HER-2状态的不一致率为19.80%(20/101)(图3A),三阴性患者HER-2状态的不一致率为26.79%(15/56)(图3B),Luminal型患者的HER-2不一致率低于三阴性患者(19.80%vs26.79%)。
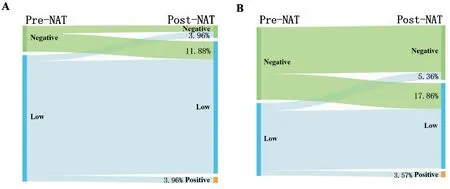
图3 NAT前后原发肿瘤HER-2阴性及低表达的转变
3 讨 论
既往通常根据IHC和FISH检测结果将HER-2分为两类,即HER-2阴性(0,1+,2+/FISH-)和HER-2阳性(2+/FISH+,3+),目前的指南将HER-2 IHC 1+或IHC 2+/FISH-定义为低表达[7]。在临床实践中,根据HR状态将HER-2低表达肿瘤归类于Luminal型或三阴性乳腺癌中,并接受相应的新辅助内分泌治疗或化疗,而未接受抗HER-2靶向治疗。大型随机Ⅲ期临床试验NSABP B-47也证实HER-2低表达患者不能从传统靶向药物(曲妥珠单抗)中获益[10]。但ADC类药物的出现给HER-2低表达乳腺癌患者提供了靶向治疗的机会[11],因此HER-2的精准病理检测具有重要意义。近年来发表的文献显示,HER-2低表达占所有乳腺癌患者的45%~55%[12-15],也有研究报道,HER-2低表达占31%~35%[16-17],本研究中HER-2低表达患者占乳腺癌人群的34.93%,这种差异可能是由于HER-2检测指南的不断更新,且以往并未严格区分HER-2 IHC 0和1+所导致。有研究显示,不同病理医师判读HER-2状态的一致性较差(IHC 0和1+的判读一致性最低为26%)[18],人工智能辅助评估HER-2状态可以提高HER-2评分的一致性和可重复性[19]。
目前关于HER-2低表达乳腺癌临床病理特征的研究结果存在差异。Won等[20]的研究显示,在HR阳性患者中,HER-2低表达乳腺癌与更少的T4期肿瘤、较高的组织学分级和淋巴结转移阴性相关;在三阴性患者中,HER-2低表达乳腺癌与更高的淋巴结转移和更低的Ki-67指数相关。Zhang等[15]研究结果表明,与HER-2阴性肿瘤相比,HER-2低表达肿瘤HR阳性占比更高,Ki-67表达水平更低,pCR率更低。本研究结果显示,HER-2低表达乳腺癌患者年龄更大、淋巴结转移率更高、HR阳性肿瘤占比更高、组织学分级及Ki-67水平更低。总体人群中HER-2低表达肿瘤的pCR率与HER-2阴性相比显著降低,HR阳性亚组HER-2低表达的pCR率也显著低于HER-2阴性,但HR阴性亚组不存在上述差异,与Denkert等[16]对4项乳腺癌前瞻性NAT临床试验数据汇总分析结果一致。临床病理特点之间虽然存在差异,但是这种差异可能是由于HR状态导致的,Schettini等[21]对比分析1 320例乳腺癌基因的表达,结果显示,在HR阳性乳腺癌中Luminal相关基因和ERBB2比三阴性乳腺癌表达更多,从基因层面证实HR状态可能是HER-2低表达乳腺癌潜在生物学的关键因素。一项包含1 136 016例传统HER-2阴性乳腺癌患者的大型队列研究表明,HER-2低表达与阴性乳腺癌的治疗和预后方面仅有微小差异,该研究并不支持将HER-2低表达乳腺癌作为一种独特的分子分型[22]。欧洲肿瘤内科学会专家共识也声明,在校正HR的表达后,HER-2低表达和HER-2阴性肿瘤之间没有明显的分子差异,不认为HER-2低表达是一个独特的分子实体,而是一组异质性肿瘤,生物学行为主要由HR表达的存在或缺失驱动[23]。
本研究还探索了HER-2状态在NAT前后的转变,结果显示,NAT前后HER-2状态的不一致率为19.27%,且主要是HER-2阴性转变为低表达,证实了HER-2低表达的不稳定性。Shang等[24]分析了新辅助化疗后从原发性乳腺癌到残余乳腺癌的演变,HER-2状态的不稳定性主要表现在HER-2低表达与阴性之间的转换,且三阴性组的不一致率高于HR阳性组(36.92%vs23.34%)。本研究得出了相似的结果,在原发肿瘤为HER-2阴性及低表达时,HR阳性患者的HER-2不一致率低于HR阴性患者(19.80%vs26.79%)。Niikura等[25]探讨了21 755例乳腺癌患者新辅助化疗后HER-2表达的变化,结果显示,21.4%的HER-2阳性患者在NAT后出现HER-2状态丢失,并且这种丢失与曲妥珠单抗的应用相关。研究表明,HER-2状态的转变对于预后的影响存在争议[26-27]。目前尚不清楚乳腺癌HER-2低表达与阴性之间的转换对于预后的影响,但是对于HER-2状态由阴性或低表达转换为阳性的患者,NAT后的治疗策略可能会发生改变[3],由阴性转变为低表达的患者也可选用新型ADC类药物进行治疗[23],因此非 pCR乳腺癌患者NAT后残留病灶的HER-2的重新检测尤为关键。
综上所述,HER-2低表达乳腺癌具有一定生物学特性,患者淋巴结转移率及HR阳性肿瘤占比更高,组织学分级、Ki-67水平以及pCR率更低,NAT患者的HER-2状态在从原发肿瘤到残留病灶表现出较高的不稳定性,主要表现为HER-2阴性转变为低表达,NAT后非pCR乳腺癌患者残留病灶HER-2的重新检测对部分患者的后续治疗具有重要意义。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

