尼拉帕利所致获得性纯巨核细胞性血小板减少性紫癜1例*
郭灵,王钇力,宋艳芳,衷敬华,翟聪聪
341000 江西 赣州,赣南医科大学第一附属医院 肿瘤内科(郭灵、王钇力、宋艳芳); 341000 江西 赣州,赣南医科大学 第一临床医学院(郭灵、翟聪聪); 341000 江西 赣州,赣州市病毒感染相关恶性肿瘤技术创新中心(衷敬华)
尼拉帕利(niraparib)是一种口服、强效、高选择性PARP抑制剂(PARP inhibitions,PARPi),目前已获批用于维持治疗的铂敏感复发卵巢癌、输卵管癌或原发性腹膜癌患者。无论乳腺癌易感基因(breast cancer susceptibility gene,BRCA)基因突变及同源重组修复缺陷(homologous recombination deficiency, HRD)状态如何,尼拉帕利作为卵巢癌维持治疗药物都可获益[1-3]。目前各大指南中尼拉帕利单药维持被推荐为卵巢癌维持治疗可选择的方案之一,广泛应用于临床,其罕见不良反应亟需重视。尼拉帕利常见的不良反应包括消化道毒性、神经毒性等,个别研究发现其亦可出现严重的血液学不良事件,如骨髓增生异常综合征(myelodysplastic syndrome,MDS)和急性髓系白血病(acute myelogenous leukemia,AML)[4],目前学术界尚无卵巢癌患者在尼拉帕利治疗过程中发生获得性纯巨核细胞性血小板减少性紫癜(acquired amegakaryocytic thrombocytopenic purpura, AATP)的病例报道。本文通过报道1例因接受尼拉帕利治疗出现AATP的卵巢癌病例,旨在为肿瘤学界了解尼拉帕利的罕见不良反应,并提供有效临床管理策略。
1 病例资料
患者,女性,63岁, 因“发现盆腔包块2周”于2021年1月13日在我院就诊。患者于2020年12月29日体检彩超提示盆腔包块,此前无腹痛、腹胀、阴道流血等不适。2021年1月13日我院门诊复查阴道彩超提示盆腔囊实性占位,收治入院。妇科查体于右侧附件区触及一直径约10 cm包块,囊性,无压痛,左侧附件区未及明显异常。既往史:2003年行宫腔镜下子宫肌瘤电切术。入院后全腹部MR检查示:盆腔囊实性占位,大小约10.1 cm×8.8 cm×12.9 cm,增强扫描明显,与周围组织分界不清,考虑来源于右侧卵巢囊腺癌可能性大。诊断为:盆腔肿物待查:卵巢肿瘤? 排除手术禁忌后于2021年1月15日在全麻下行腹腔探查术,术中见部分大网膜与盆壁粘连,分离粘连后见右侧卵巢囊实性肿大,约13 cm×10 cm,质硬,直肠前壁结节样病灶,大网膜、盆腔腹膜、膀胱前方腹膜散在结节样病灶,术中快速冰冻切片结果为右侧卵巢高级别浆液性癌,行全麻下全子宫及双侧附件切除术+盆腔淋巴结切除术+腹主动脉旁淋巴结切除术+大网膜切除术+直肠切除乙状结肠直肠断端吻合术+盆腔粘连松解术+肠粘连松解术。术后病理及免疫组化结果示(图1):“右侧卵巢高级别浆液性癌”,子宫肌壁可见肿瘤组织,符合高级别浆液性癌转移,(左侧)输卵管恶性肿瘤(符合高级别浆液性癌转移),直肠恶性肿瘤(符合高级别浆液性癌转移),可见脉管癌栓及神经束侵犯,(左腹主动脉旁、右腹主动脉旁淋巴结)可见癌转移(3/12、2/13),(腹膜转移灶)可见肿瘤组织。术后诊断为右侧卵巢高级别浆液性癌ⅣB期。
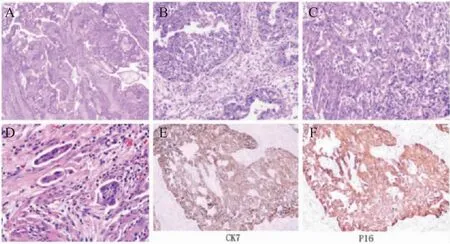
图1 患者卵巢癌术后病理结果
术后分子生物学检测示BRCA1/2阴性及HRD阴性。于2021年2月18日起予TC方案(紫杉醇240 mg+奥沙利铂200 mg)化疗7程,21天为1疗程,2程化疗后出现IV度骨髓抑制并发热,血常规示:WBC 2.73×109/L ,PLT 69×109/L,NET 0.35×109/L,HGB 118 g/L,给予重组人粒细胞集落刺激因子(recombinant human granulocytecolony stimulating factor,rhG-CSF)升白治疗后好转,复查血常规示:WBC 5.15×109/L,PLT 125×109/L,NET 2.5×109/L,HGB 124 g/L,后每程化疗后进行预防性升白治疗后未再出现骨髓抑制。含铂化疗后评估疗效为完全缓解,选择尼拉帕利作为一线维持用药。患者体重58 kg,血小板计数126×109/L,给药剂量为200 mg/qd。于2021年8月11日开始服用尼拉帕利靶向治疗,治疗近3周时出现Ⅲ度血小板减低,8月30日查血常规示:PLT 36×109/L,HGB 106 g/L,WBC和NET未见下降。停药予重组人血小板生成素(recombinant human thrombopoietin,rhTPO)升血小板治疗,密切监测PLT减少情况,PLT回升至303×109/L恢复用药。恢复用药后PLT再次降低至38×109/L,遂于2021年12月13日减量至100 mg/d,减量后复查PLT仍低,为62×109/L,12月20日停药。2022年1月1日复查PLT 17×109/L,输注血小板并予rhTPO升血小板治疗后恢复至86×109/L。动态监测PLT,呈进行性下降,最低为4×109/L,停药后给予升血小板治疗效果欠佳,考虑是否为尼拉帕利引起的血液系统疾病。血常规示三系变化情况如图2所示,期间出现WBC I度减少,最低时为3.16×109/L,HGB II度减少,最低时为81 g/L,予rhG-CSF升白及EPO升红对症处理后均好转。

图2 使用尼拉帕利后血常规三系变化图
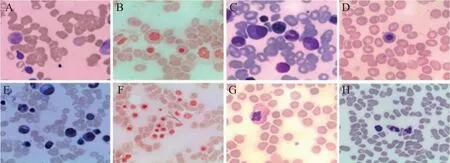
图3 骨髓细胞学检查结果
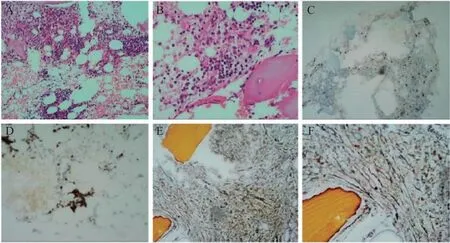
图4 骨髓活检结果
患者于2022年2月8日因“鼻出血2天”返院至血液科就诊,查体见双下肢皮下出血点,血常规示:PLT 9×109/L,WBC 3.70×109/L,NET 1.78×109/L,HGB 98 g/L,完善骨髓常规+病理活组织检查,骨髓细胞学检查示(图3):有核细胞增生活跃。巨核细胞未找到/全片,血小板少见。骨髓病理活检及免疫组化示(图4):(1)骨髓有核细胞增生不均一(造血容量约5%~40%),粒红比略减低,未见典型不成熟前体细胞异常定位(abnormal localization of immature precursors,ALIP)及热点现象; (2)粒系以偏成熟阶段细胞为主; (3)红系稍增生,以中晚幼红细胞为主; (4)全片未见巨核细胞; (5)淋巴细胞散在分布; (6)骨髓间质未见明显胶原纤维化,未见骨硬化,可见较多骨质及脂肪空泡。免疫组化未提示原始细胞或淋巴细胞增多,未见肿瘤细胞浸润,全片未见巨核细胞。后多次复查骨髓细胞学及血细胞涂片均显示巨核细胞少见,血小板少见,且2022年7月髓片可见红系增生活跃,中、晚幼红细胞可见,比例偏高,部分幼红细胞伴核小浆少;成熟红细胞大小不一,大及嗜碱性红细胞较易见,部分中央淡染区扩大(图3)。结合患者服用尼拉帕利治疗卵巢癌病史及血小板减少动态变化,确诊为获得性纯巨核细胞性血小板减少性紫癜,定期住院输注血小板及rhTPO治疗,可暂时升高PLT但无法长期维持。2022年2月17日开始使用激素治疗,并予止血及预防出血治疗,疗效不佳。2022年3月18日开始使用促血小板生成素受体激动剂(thrombopoietin receptor agonist,TPO-RA)海曲泊帕5 mg/qd升血小板,效果不佳,血小板未见明显上升趋势,后换用阿伐曲泊帕20 mg/qd。每2周复查血象,血小板维持在20×109/L~104×109/L,WBC、NET均在正常值范围内,HGB略有减低,维持在90 g/L~111 g/L。2022年4月29日行淋巴细胞亚群检测,见B细胞表面抗原CD19稍升高,无CD4+、CD8+升高;2023年6月12日完善了CD55/CD59流式细胞学检测,CD55、CD59表达正常。
患者于2021年11月开始每3~4个月复查腹部MR及肿瘤指标情况,均未见明显异常。2023年6月13日复查肿瘤指标:癌胚抗原为0.70 ng/mL;糖类抗原125为8.48 U/mL;腹部MR及胸部CT均未见肿瘤复发。随访至截稿前,该患者一般情况尚可,原发病灶未见复发或转移。该患者病程概要如图5所示。
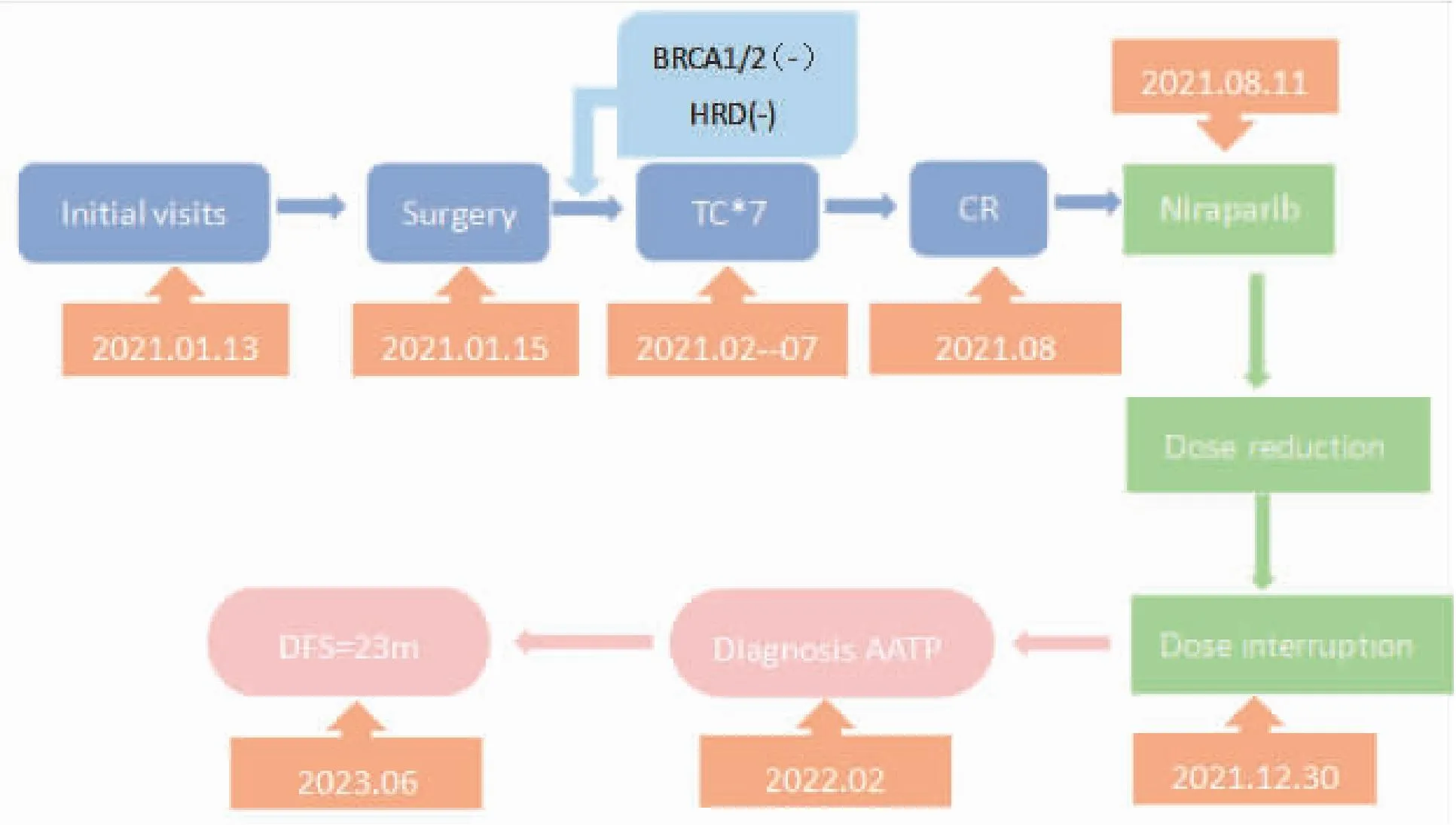
图5 本例患者病程概要图略
2 讨 论
AATP的特征为骨髓中巨核细胞数明显减少或完全缺如致血小板计数显著减少,而其他细胞系均正常。本例患者在整个治疗过程中有轻到中度的贫血,检查贫血三项示铁蛋白升高,骨髓细胞涂片见部分红细胞中央淡染区扩大,考虑为长期出血导致的小细胞低色素贫血。有文献表明ATTP后期会出现贫血表现,且多为小细胞低色素性贫血,这与本例患者的表现一致[5-6]。诊断AATP需和特发性血小板减少性紫癜(idiopathic thrombocytopenic purpura,ITP)、再生障碍性贫血 (aplastic anemia,AA)及MDS、阵发性睡眠性血红蛋白尿综合征(aplastic anemia-paroxysmal nocturnal hemoglobinuria syndrome,PNH)相鉴别,ITP主要是由于自身抗血小板抗体使得外周血小板减少,骨髓巨核细胞数增多或正常,伴有成熟障碍,本例患者骨髓巨核细胞明显减少。AA患者一般有三系减少,本例患者只有PLT减少,伴慢性失血导致的小细胞低色素贫血。MDS是一种造血干细胞克隆性疾病,以外周血全血细胞减少,骨髓病态造血为特点,且有特征性的ALIP,本例患者骨髓病理活检未见ALIP。通过检测细胞表面 CD55、CD59的缺乏可以作为诊断 PNH 最直接的证据[7],本例患者细胞表面CD55、CD59表达正常,因此可排除PNH。本例患者多次完善骨髓细胞学检查,均未见/少见巨核细胞,骨髓红系及粒系代偿性轻度增生活跃,白细胞或中性粒细胞计数也无明显改变,符合AATP的诊断。
上皮性卵巢癌长期位居女性生殖系统恶性肿瘤死亡率第1位[8]。由于早期筛查手段的缺乏且其早期临床症状具有非特异性,发现时多已晚期,且预后差。卵巢癌的标准治疗方案为最大程度的肿瘤细胞减灭术及术后含铂药物化疗[9]。尽管首次一线化疗后有效率可达约70%,但仍有70%患者在3年内复发,5年生存率不足50%[10]。PARPi的出现将卵巢癌的治疗模式由被动等待复发转变为积极维持治疗以延缓复发。
PARPi的作用机制包括抑制PARP酶活性以及通过“捕获”受损DNA上的PARP酶来增加PRAP-DNA复合物的形成,阻止损伤的DNA修复[11]。除DNA损伤修复外,PARP酶还参与转录调控、有丝分裂、细胞死亡、端粒长度和细胞内代谢[12]。人类共有17种PARP酶[13],其中PARP-1占整个PARP家族活性的85%~90%,PARP-2占10%~15%,而其他PARP家族成员的活性甚微。PARP酶在人体骨骼、骨髓以及血液中均有分布,PARPi的选择性不高,在用药过程中,“脱靶作用”即PARPi作用于除外PARP1的其他PARP家族成员,引发药物不良反应[14]。因此,致力于针对PARP1的高选择性设计以减少毒副作用的发生是学术界研究的热点与难点。目前AATP的病因尚不明确,已有研究表明部分药物或病毒感染、自身免疫性疾病、酗酒、放射线等多种因素可能与该病有关联,PARPi导致AATP的原因是否与骨髓及血液中分布的PARP酶有关,还需要更多的研究证实。
PARPi的毒性常见的主要包括疲惫、血液系统毒性(贫血、粒细胞减少、血小板减少)、胃肠道毒性(恶心、呕吐)、 肾毒性和较为少见的神经系统毒性、呼吸系统毒性、循环系统毒性、肌肉骨骼系统毒性等[15-17]。其中,血液系统毒性是目前已上市的PARPi最易导致用药中断的原因,需引起重视[18]。研究表明,PARPi血液学毒性发生率分别为贫血47.8%,中性粒细胞减少39.6%,血小板减少23.0%[19]。不同的PARPi的毒性谱和毒性反应严重程度存在差异,尼拉帕利与血液学毒性显著相关[20],本研究患者以血小板减少为首发不良反应,并且出现重度血小板减少。Berek等[21]研究发现,尼拉帕利用药剂量减少至 200 mg或100 mg的患者的无进展生存期与保持在300 mg起始剂量的患者一致。因此,剂量减少及暂时停药并不会对患者的预后有明显影响,对于严重不良事件(serious adverse events,SAEs)的发生,干预SAEs应优先于卵巢癌的维持治疗。
此外,使用PARPi的人群中0.5%~2%可能出现MDS、AML等SAEs[4]。最新研究显示,接受PARPi治疗患者MDS/AML发生率为0.73%[22]。而在Zhao等[23]的研究中表明,4种PARPi引起的MDS和AML平均病死率分别为37.96%和60.41%。实体瘤化疗相关MDS/AML诊断后的总生存期(overall survival,OS)很差,死亡率为78.4%,中位总生存期为7个月[24]。面对高死亡率的罕见不良事件,PARPi的不良反应管理显得尤为重要。虽然尼拉帕利所致AATP的死亡率目前没有统计数据,但在发现血小板减少时及时减量停药并予对症处理,使得本病例患者疗效及生存质量得到提升。研究证实,PARPi治疗后血小板减少常常发生在用药后第1个月[16]。因此,对血小板减少的管理需要在用药早期就进行。本研究该患者诊疗过程中,及时发现并严格按照ASCO发布的PARPi管理指南[25]和PARP抑制剂不良反应管理专家共识[26]处理了血小板减少的不良反应。在临床用药管理过程中,我们应密切警惕此类罕见不良事件的发生。
AATP是以骨髓选择性巨核细胞再生不良伴血小板减少,而其他造血成份基本正常为特征的一组骨髓造血衰竭综合征,临床上少见[27],本研究患者为药物源性AATP,虽发现血小板减低开始就经验性使用激素治疗,但疗效不佳。完善淋巴细胞亚群检测,见B细胞表面抗原CD19稍升高,无CD4+、CD8+升高,遂未继续选用免疫调节剂环孢素A及激素治疗,而是选用TPO-RA联合输注血小板等支持疗法。海曲泊帕与阿伐曲泊帕都是小分子非肽类TPO-RA,模拟内源性血小板生成素(thrombopoietin,TPO),结合于受体跨膜区,刺激来自骨髓祖细胞的巨核细胞增殖和分化,从而增加血小板生成[28]。海曲泊帕存在酰肼结构,易与金属阳离子发生螯合,一旦形成螯合物,血液中的药物暴露量便显著降低,药效也会降低。本例患者服用海曲泊帕疗效不佳可能与之相关。而阿伐曲泊帕不存在酰肼结构,不会和金属阳离子发生螯合,与其他TPO-RA相比,不会导致血药浓度降低而影响药效,且阿伐曲泊帕不会与TPO竞争结合TPO-R,可以与TPO协同作用,增加血小板的生成[29]。
针对亚洲人群卵巢癌尼拉帕利一线维持治疗的PRIME研究得出,非BRCA基因突变及HRD阴性患者中位无进展生存期(progression-free survival,PFS)分别为19.3个月和14个月[30]。本研究该患者目前的PFS已达23个月,取得了较好的临床疗效。在应用PARPi延长卵巢癌患者PFS和OS的同时,也要积极地做好不良反应的管理。在尼拉帕利临床应用时,需严格按照PARPi不良反应管理的指南和专家共识,在用药初期即定期监测血象,根据血小板下降程度选择不同的处理策略,并警惕MDS/AML及继发性AA的发生,尽量在延长患者OS的同时提升患者的生存质量。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

