黄芩清热除痹胶囊对强直性脊柱炎湿热证患者感受、炎症因子及circRNA_0003307的影响
黄旦 刘健 汪元 曹云祥 张皖东 方妍妍


【摘 要】目的:觀察黄芩清热除痹胶囊(HQC)对强直性脊柱炎湿热证患者感受、炎症因子及circRNA_0003307的影响。方法:将60例强直性脊柱炎湿热证患者随机分为治疗组和对照组,每组30例。对照组采用基础治疗,治疗组在对照组基础上联合HQC治疗。观察2组临床疗效(ASAS20、BASDAI50),以及治疗前后疾病活动[视觉模拟评分法(VAS)评分、Bath强直性脊柱炎疾病活动指数(BASDAI)、Bath强直性脊柱炎功能指数(BASFI)、C反应蛋白(CRP)、红细胞沉降率(ESR)]、患者感受评分[生活质量简表(SF-36)、中医证候积分]、炎症因子[肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β、IL-17、IL-23]、circRNA_0003307的变化。结果:治疗后,治疗组ASAS20、BASDAI50
达标率明显高于对照组(P < 0.05)。与治疗前比较,2组VAS评分、BASDAI、BASFAI、CRP、ESR、SF-36各维度评分、中医证候积分、TNF-α、IL-1β、IL-17、IL-23、circRNA_0003307明显改善(P < 0.05)。
与对照组治疗后比较,治疗组BASDAI、情感职能、社会功能、身体疼痛、精力、CRP、IL-23、
circRNA_0003307明显改善(P < 0.05)。结论:HQC可能通过调控circRNA_0003307,下调炎症因子TNF-α、IL-1β、IL-17、IL-23表达,抑制免疫炎症反应,改善强直性脊柱炎患者关节功能和患者感受。
【关键词】 强直性脊柱炎;黄芩清热除痹胶囊;患者感受;circRNA_0003307;临床疗效
The Effects of Huangqin Qingre Chubi Capsules(黄芩清热除痹胶囊)on the Sensation,Inflammatory Factors,and circRNA_0003307 in Patients with Ankylosing Spondylitis with Damp Heat Syndrome
HUANG Dan,LIU Jian,WANG Yuan,CAO Yun-xiang,ZHANG Wan-dong,FANG Yan-yan
【ABSTRACT】Objective:To observe the effects of Huangqin Qingre Chubi Capsules(黄芩清热除痹胶囊,
HQC)on the sensation,inflammatory cytokines,and circRNA_0003307 in patients with ankylosing spondylitis with damp heat syndrome.Methods:Sixty patients of ankylosing spondylitis with damp heat syndrome were randomly divided into a treatment group and a control group,30 cases in each.The control group received basic treatment,while the treatment group was treated with HQC in combination with the treatment like that for the control group.An observation was made about the clinical effect(ASAS20,BASDAI50),as well as disease activity before and after treatment(VAS,BASDAI,BASFI,CRP,ESR),patient perception score(SF-36,TCM Syndrome Score),cytokines(TNF-α,IL-1β,IL-17,
IL-23),and circRNA_0003307.Results:After
treatment,the compliance rates of ASAS20 and BASDAI50 in the treatment group were significantly higher than those in the control group(P < 0.05).Compared with before treatment,VAS,BASDAI,BASFAI,CRP,ESR,SF-36 in all dimensions,TCM syndrome score,TNF-α,IL-1β,IL-17,IL-23,and circRNA_0003307 showed significant improvement(P < 0.05).Compared with the control group after treatment,the treatment group showed significant improvement in BASDAI,RE,SF,BP,VT,IL-23,CRP,circRNA_0003307(P < 0.05).Conclusion:HQC may downregulate the expression of inflammatory cytokine TNF-α,IL-1β,IL-17,IL-23 by regulating circRNA_0003307,to inhibit immune inflammatory response and improve joint function and patient sensation in patients with ankylosing spondylitis.
【Keywords】 ankylosing spondylitis;Huangqin Qingre Chubi Capsules(黄芩清热除痹胶囊);patient
sensation;circRNA_0003307;clinical efficacy
强直性脊柱炎(ankylosing spondylitis,AS)是一种慢性炎症性进行性疾病,通常起源于骶髂关节损伤,逐渐损害脊柱,导致残疾和生活质量下降[1]。
男性对疾病的易感性更强[2-3]。虽然AS被认为是一种免疫介导的疾病,但其发病机制尚不清楚。AS可损害脊柱功能,降低生活质量,对患者健康造成严重危害。AS病因和发病机制仍很大程度上未知,但是免疫介导的炎症反应在AS病理进程中扮演着核心角色[4],因此,控制AS免疫炎症,是防止病情进一步进展,避免残疾的关键。
患者感受是患者在内外各种因素刺激下产生的自身反应,是患者疾病状态与生活质量的一种体现,同时又影响着疾病的进展[5]。长期受慢性炎症刺激所致的躯体疼痛和僵硬,以及长期治疗导致的经济负担影响,AS患者感受严重下降。目前西医治疗AS的药物如非甾体抗炎药、改善病情抗风湿药、生物制剂等,虽然对躯体症状和疾病进展有一定的治疗作用,但是长期应用出现的不良反应也不容忽视,且在改善患者主观感受上效果较差[6-7]。
中医药治疗AS能有效降低患者疾病活动,提高生活质量[8]。本课题组前期通过高通量测序发现,AS患者外周血中circRNA_0003307明显高表达,敲降AS滑膜细胞circRNA_0003307表达能显著减轻免疫炎症反应[9]。为进一步研究黄芩清热除痹胶囊(HQC)对AS湿热证患者感受的影响,笔者通过观察HQC治療前后AS湿热证患者患者感受、炎症因子及circRNA_0003307的变化,探讨HQC对AS湿热证患者感受及circRNA_0003307的影响。
1 临床资料
1.1 一般资料 选取2019年10月至2020年3月在安徽中医药大学第一附属医院风湿科就诊的湿热证AS患者60例,按照随机数字表法分为治疗组和对照组,每组30例。治疗组男26例,女4例;年龄20~40岁,平均(31.80±7.70)岁;病程1~7.4年,平均(4.80±2.51)年。对照组男26例,女4例;年龄20~42岁,平均(34.27±7.56)岁;病程1~8.4年,平均(5.60±2.75)年。2组患者在性别、年龄、病程等方面比较,差异无统计学意义(P > 0.05),具有可比性。本研究通过安徽中医药大学第一附属医院伦理委员会批准(伦理号2015AH-20)。
1.2 诊断标准 西医诊断按照1984年美国风湿病学会(ACR)修订的AS纽约标准[10];中医证候标准按照2002年国家食品药品监督管理局《中药新药临床研究指导原则》[11]中AS湿热证标准。
1.3 纳入标准 ①符合上述诊断标准;②年龄18~60岁;③近3个月未使用非甾体抗炎药及改善病情抗风湿药。
1.4 排除标准 ①其他血清阴性脊柱关节炎或关节严重畸形患者;②合并有其他自身免疫系统疾病或其他系统严重原发性疾病患者;③研究者认为不宜进行此项临床试验者。
1.5 脱落标准 ①依从性较差,药物服用达不到规定量的80%或超过规定量的120%而影响试验结果的患者;②在12周的随访过程中出现失访的患者;③病情加重或出现其他疾病需要接受治疗的患者;④出现严重不良事件而不宜继续进行者。
2 方 法
2.1 治疗方法 对照组采用基础治疗方法,治疗组采用基础治疗加HQC治疗。基础治疗采用改善病情抗风湿药(沙利度胺,批号17081431,规格50 mg,睡前1次,每次50 mg)、非甾体抗炎药(塞来昔布,批号J20140072,规格0.2 g,每日2次,每次0.2 g)等,治疗组在此基础上加用HQC(安徽中医药大学第一附属医院生产,皖药制字Z20200001,批号20191216,成分为薏苡仁、黄芩、栀子、威灵仙、桃仁等,每粒胶囊含生药浸出物0.4 g),每日3次,每次3粒(1.2 g)。2组采用的基础治疗方案均为平行治疗,基础治疗药物及剂量比较无差异。2组疗程均为12周。
2.2 主要仪器与设备 高速台式冷冻离心机(安徽嘉文仪器装备有限公司,型号JW-3021HR);低速迷你离心机(海门市其林贝尔仪器制造有限公司,型号LX 300);酶标仪(深圳雷杜生命科学股份有限公司,型号RT-6000);电热恒温箱(上海三发科学仪器有限公司,型号DNP-9052BS-Ⅲ);荧光定量PCR仪(Thermo Scientific,型号PIKOREAL 96)。
2.3 主要试剂 淋巴细胞分离液(Stemcell,批号USA);Trizol(Life technogies,批号15596026);Novostart SYBR qPCR SuperMix Plus(novoprotein,批号0516511);PrimeScriptRT reagent Kit with gDNA Eraser(TaKaRa,批号AJ51485A);ELISA试剂盒[肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β、IL-17、IL-23](武汉基因美生物科技有限公司,批号JYM0110Hu、JYM0083Hu、JYM0082Hu、JYM0077Hu)。
2.4 ELISA试剂盒检测细胞因子表达 清晨收集AS患者外周血,室温血液自然凝固10 min,离心机以3000 r·min-1离心20 min,离心半径9 cm。仔细收集上清液,按照ELISA试剂盒说明操作,450 nm波长依序测量各孔的吸光度(OD值)。
2.5 实时荧光定量PCR检测相关基因的表达 收集15例AS患者PBMC样品进行实时定量PCR验证。按照说明书使用Trizol法提取RNA。RT反应:去除基因组DNA反应,在0.2 mL EP管中,加入总RNA(质量为1 μg)、5×gDNA Eraser Buffer 2.0 μL,gDNA Eraser 1.0 μL,DEPC水补足至10 μL,轻轻混匀、点动离心。PCR仪上42 ℃加热2 min,立即冰浴1 min。在上述EP管中加入PrimeScript RT Enzyme Mix I 1.0 μL、RT Primer Mix 1.0 μL、RNase Free dH2O 4.0 μL、RevertAidTM M-MuLV Reverse Transcniptase 4.0 μL。37 ℃,15 min;85 ℃,5 s。取出上述反应液,即为cDNA,-80 ℃保存备用。荧光定量PCR反应。
主要有反转录产物、正向及反向引物、SYBR Green染料依次为1 μL、1 μL、1.5 μL,且DEPC水需增加到 10 μL。具体的反应条件为:95 ℃ 1 min;95 ℃ 20 s;60 ℃ 1 min;40个循环。参照试剂盒进行RNA提取及反转录,引物序列见表1。
2.6 患者感受及疗效评价 采用脊柱疼痛视觉模拟评分法(VAS)、Bath强直性脊柱炎疾病活动指数(BASDAI)[12]、Bath强直脊柱炎功能指数(BASFI)[13]、生活质量简表(SF-36)[14]与中医证候积分[11]评估患者感受。其中SF-36由总体健康(GH)、生理功能(PF)、社会功能(SF)、生理职能(RP)、身体疼痛(BP)、情感职能(RE)、精力(VT)和心理健康(MH)组成。疗效评定标准采用国际AS工作小组提出的ASAS20、BASDAI50判断是否有效[15]。
2.7 统计学方法 采用SPSS 23.0软件进行统计分析。计量资料符合正态分布以表示,采用
t檢验;不符合正态分布以中位数和四分位数间距[M(P25,P75)]表示,采用非参数检验;计数资料采用χ2检验。以P < 0.05为差异有统计学意义。
3 结 果
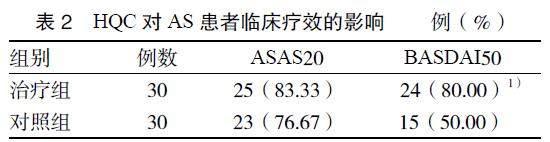
3.1 HQC对AS患者临床疗效的影响 临床疗效采用ASAS20和BASDAI50进行比较。治疗组ASAS20、BASDAI50达标率分别为83.33%、80.00%,对照组ASAS20、BASDAI50达标率分别为76.67%、50.00%,治疗组BASDAI50显著高于对照组(P < 0.05)。见表2。
3.2 HQC对AS患者疾病活动、患者感受的影响 治疗后,2组疾病活动、患者感受各指标均明显改善(P < 0.05);与对照组比较,治疗组治疗后BASDAI评分、RE、SF、BP、VT改善更明显(P < 0.05)。见表3。
3.3 HQC对AS患者炎症因子表达的影响 治疗后,2组患者TNF-α、IL-1β、IL-17、IL-23、ESR、CRP明显降低(P < 0.05);与对照组比较,治疗组治疗后IL-23、CRP降低更显著(P < 0.05)。见表4。
3.4 HQC对AS患者circRNA_0003307 mRNA的影响 治疗后,2组患者circRNA_0003307明显降低(P < 0.05),治疗组circRNA_0003307较对照组降低更明显(P < 0.05)。见表5。
3.5 2组病例脱落和不良发生情况 2组治疗期间无病例脱落,且未发现明显肝肾功能损害及其他不良反应。
4 讨 论
AS可损害脊柱功能,降低生活质量,对患者健康造成严重危害。AS与遗传风险和环境诱因的相互作用有关,其病因和发病机制仍很大程度上未知。中医药治疗AS历史悠久,急性活动期临床表现以湿热证为主要证型[16],主要因风湿热邪乘虚侵袭人体,或由外邪侵袭日久,郁而化热,或由素体阴虚阳盛,邪从热化所致。临床常见腰背关节及外周大关节的红肿热痛,得冷则舒,日轻夜重,舌红,苔黄,脉滑数[17]。AS是一种慢性、复发性疾病,关节疼痛、晨僵、残疾、各种严重并发症、工作能力下降、长期治疗带来的经济负担等,均会严重影响患者感受,导致生活质量下降。患者极易出现情感障碍,伴发焦虑抑郁障碍,AS患者焦虑抑郁情绪的发生与疾病活动度、疼痛强度、疲劳、睡眠障碍、严重功能不全和低生活质量等密切相关。HQC能改善患者关节症状,提高生活质量,改善患者感受。
免疫炎症已被公认为AS发病的关键因素,而免疫稳态的破坏与免疫病理的发生密切相关[18]。
AS发病中促炎/抑炎因子分泌平衡失调,诱发“炎症因子风暴”,炎症向韧带附着点部位迁移,引起疼痛及晨僵等。细胞因子网络作为免疫细胞之间可溶性介质,在促炎和抗炎途径中发挥重要作用,
细胞因子网络的失衡诱导特定的免疫应答及炎症反应,在AS发生、发展中扮演着重要的角色。
多种致炎因子如TNF-α、IL-1β、IL-23、IL-17等均可诱导核转录因子-κB受体激活因子配体(RANKL)的表达,RANKL可以与破骨前体细胞(单核巨噬细胞)表面的核转录因子-κB受体活化因子(RANK)结合,诱导破骨细胞生成,促进骨破坏及骨吸收过程[19]。HQC能够降低TNF-α、IL-1β、IL-23、IL-17水平,抑制AS湿热证患者免疫炎症反应。
越来越多的数据表明,非编码RNA主要包括微小RNA(miRNA)、环状RNA(circRNA)和长链非编码RNA(lncRNA),在自身免疫性疾病介导炎症和免疫调节中发挥重要作用[20-21]。一些包裹在细胞外囊泡中的ncRNAs可在外周循环中发现,并通过细胞间通讯对风湿病中的关节损伤和组织再生起到修饰作用[22]。circRNA是具有高度进化保守性的稳定非编码RNA。越来越多的证据表明,circRNA富含miRNA的结合位点,在复杂的生物过程中,如自身免疫失衡、炎症反应和癌变,可以通过竞争性内源性RNA机制吸收miRNA参与疾病发生、发展,也可以通过与编码蛋白发生作用参与疾病过程[23]。课题组前期通过高通量测序研究发现,在AS患者外周血单核细胞中circRNA_0003307差异表达,且与患者免疫炎症反应相关,并通过细胞实验证实了circRNA_0003307参与AS患者免疫炎症反应。本研究发现,HQC能够调控circRNA_0003307的表达,抑制AS患者免疫炎症反应,从而改善患者症状,提高患者感受。
HQC由我院刘健教授根据多年临床经验研制,主要由黄芩、栀子、薏苡仁、威灵仙、桃仁组成,具有清热祛湿、健脾通络之功。现代研究表明,HQC能降低佐剂性关节炎大鼠血清IL-1β、IL-6含量,抑制大鼠足肿胀[24],可通过改善大鼠的体质量增长率,改变其外周血中一氧化氮、超氧化物歧化酶的含量,增加CD4+ T细胞及CD4+/CD8+ T细胞比例,减轻炎性反应[25]。并有临床研究表明,HQC能够有效控制AS活动期关节炎急性发作症状,减轻患者疼痛,降低ESR、CRP水平,且无不良反应[26-27]。本研究结果表明,HQC能显著降低AS湿热证患者VAS评分、BASDAI评分、BASFI评分、中医证候积分、ESR、CRP水平,升高SF-36各维度水平,改善患者临床症状,提高患者感受,同时,HQC还能够降低circRNA_0003307、TNF-α、IL-1β、IL-17、IL-23表達。
综上所述,HQC可有效改善AS患者实验室指标及患者感受,对AS有一定治疗作用,其可能与调控circRNA_0003307,纠正细胞因子失衡,改善免疫炎症反应有关。然而,本研究只是临床现象的观察,并未进行机制探讨,由于中药复方具有多靶点、多途径的作用特点,HQC抑制AS免疫炎症反应及改善患者感受的具体机制有待进一步研究。
参考文献
[1] DOUGADOS M,BAETEN D.Spondyloarthritis[J].Lancet,2011,377(9783):2127-2137.
[2] WANG R,WARD MM.Epidemiology of axial spondyloarthritis:an update[J].Curr Opin Rheumatol,2018,30(2):137-143.
[3] APPEL H,LODDENKEMPER C,MIOSSEC P.Rheumatoid arthritis and ankylosing spondylitis-pathology of acute inflflammation[J].Clin Exp Rheumatol,2009,27(4):S15-S19.
[4] RONNEBERGER M,SCHETT G.Pathophysiology of spondyloarthritis[J].Curr Rheumatol Rep,2011,13(5):416-420.
[5] TAUROG JD,CHHABRA A,COLBERT RA.Ankylosing spondylitis and axial spondyloarthritis[J].N Engl J Med,2016,374(26):2563-2574.
[6] VAN HOUTUM L,RIJKEN M,HEIJMANS M,et al.Patient-perceived self-management tasks and support needs of people with chronic illness:generic or disease specific?[J].Ann Behav Med,2015,49(2):221-229.
[7] 姜平,魏凯,金晔华,等.浅谈强直性脊柱炎相关生物制剂治疗进展[J].风湿病与关节炎,2021,10(7):60-66,69.
[8] 黄旦,刘健,万磊,等.强直性脊柱炎免疫炎症反应及健脾化湿通络法干预的研究进展[J].风湿病与关节炎,2020,9(2):64-68.
[9] FANG Y,LIU J,LONG Y,et al.Knockdown of circular RNA hsa_circ_0003307 inhibits synovial inflammation in ankylosing spondylitis by regulating the PI3K/AKT pathway[J].Adv Clin Exp Med,2022,31(7):781-788.
[10] VAN DER LINDEN S,VALKENBURG HA,CATS A.Evaluation of diagnostic criteria for ankylosing spondylitis.A proposal for modification of the New York criteria[J].Arthritis Rheum,1984,27(4):361-368.
[11] 国家食品药品监督管理局.中药新药临床研究指导原则[M].北京:中国医药科技出版社,2002:119-120.
[12] GARRETT S,JENKINSON T,KENNEDY LG,et al.
A new approach to defining disease status in ankylosing spondylitis:the bath ankylosing spondylitis disease activity index[J].J Rheumatol,1994,21(12):2286-2291.
[13] CALIN A,GARRETT S,WHITELOCK HC,et al.A new approach to defining functional ability in ankylosing spondylitis:the development of the Bath Ankylosing Spondylitis Functional Index[J].J Rheumatol,
1994,21(12):2281-2285.
[14] 李宁秀,刘朝杰,李俊,等.四川省城乡居民SF-36评价参考值[J].华西医科大学学报,2001,43(1):43-47.
[15] ZOCHLING J,BRAUN J.Assessment of ankylosing spondylitis[J].Clin Exp Rheumatol,2005,23(5 Suppl 39):S133-S141.
[16] 汪四海,刘健,杨佳,等.102例强直性脊柱炎患者中医证候回顾性研究[J].中医药临床杂志,2011,23(6):522-524.
[17] 黄旦,刘健,忻凌,等.215例湿热型强直性脊柱炎中药治疗数据挖掘及关联规则研究[J].中国中西医结合杂志,2017,37(11):1325-1329.
[18] TAUROG JD,CHHABRA A,COLBERT RA.Ankylosing spondylitis and axial spondyloarthritis[J].N Engl J Med,2016,374(26):2563-2574.
[19] WANG K,LI S,GAO Y,et al.BCL3 regulates RANKL-induced osteoclastogenesis by interacting with TRAF6 in bone marrow-derived macrophages[J].Bone,2018,114(1):257-267.
[20] ZHANG L,QU L,ZHANG Y,et al.Differential expression of circular RNAs in plasma exosomes from patients with ankylosing spondylitis[J].Cell Biol Int,2022,46(4):649-659.
[21] SONG MI,GAO J,YAN T,et al.Hsa_circ_0000652 aggravates inflammation by activation of macrophages and enhancement of OX40/OX40L interaction in ankylosing spondylitis[J].Front Cell Dev Biol,2021,16(9):737599-737612.
[22] TOFI?O-VIAN M,GUILL?N MI,ALCARAZ MJ.Extracellular vesicles:a new therapeutic strategy for joint conditions[J].Biochem Pharmacol,2018,153(7):134-146.
[23] YANG J,CHENG M,GU B,et al.CircRNA_09505 aggravates inflammation and joint damage in collagen-induced arthritis mice via miR-6089/AKT1/NF-κB
axis[J].Cell Death Dis,2020,11(10):833-840.
[24] 葛平,張贺,孙肖琛,等.黄芩清热除痹胶囊对佐剂性关节炎大鼠血清IL-1β和IL-6的影响[J].中药新药与临床药理,2014,25(1):8-10.
[25] 江莹,张静,孟楣,等.黄芩清热除痹胶囊对佐剂性关节炎大鼠的抗炎作用[J].华西药学杂志,2015,30(2):178-180.
[26] 黄旦,刘健,万磊,等.黄芩清热除痹胶囊对强直性脊柱炎患者疗效及氧化应激的影响[J].中国免疫学杂志,2019,35(12):1448-1452.
[27] 黄旦,刘健,纵瑞凯,等.黄芩清热除痹胶囊激活PPARγ介导AMPK/FoxO3a信号通路改善强直性脊柱炎患者氧化应激[J].中国中药杂志,2020,45(2):451-456.
收稿日期:2023-11-06;修回日期:2023-12-27