碳纳米颗粒增敏的分子印迹电化学传感器检测阿奇霉素的研究
冯旭 郭航雨 覃丹凤 李利军

摘 要:以磺化沥青(sulfonsted bitumen, SP)作为碳源,通过纯化和高温碳化法制备碳纳米颗粒(carbon nanoparticles, CNPs),将CNPs分散在壳聚糖(chitosan, CS)溶液中,并用滴涂法修饰在金电极(Au)上来得到CNPs-CS/Au。以阿奇霉素(azithromycin, AZM)为模板分子、多巴胺(dopamine, DA)为功能单体,利用电聚合法在CNPs-CS/Au电极上制备了AZM分子印迹薄膜,构建了高灵敏度且专一性识别AZM分子的电化学传感器(MIP/CNPs-CS/Au)。分别采用扫描电镜(scanning electron microscope, SEM)、X-射线衍射(X-ray diffraction, XRD)、X-射线光电子能谱(X-ray photoelectron energy spectroscopy, XPS)、循环伏安法(cyclic voltammetry, CV)、电化学阻抗法(electrochemical impedance method, EIS)和差示脉冲阳极溶出伏安法(differential pulse anode dissolution voltammotry, DPASV)对MIP/CNPs-CS/Au进行表征。结果表明,该传感器的电流值(Ipa)与AZM浓度(C)分别在0.005~<5.000 μmol/L和5.000~30.000 μmol/L范围内呈现良好的线性关系,检测限(limit of detection, LOD)较低(3.89 nmol/L,S/N=3)。该传感器可用于实际样品中AZM的检测,加标回收率为97.10%~103.96%,相对标准偏差(relative standard deviation, RSD)为1.10%~2.07%。
关键词:碳纳米颗粒;分子印迹聚合物;电化学传感器;阿奇霉素
中图分类号:TP212 DOI:10.16375/j.cnki.cn45-1395/t.2024.02.011
0 引言
阿奇霉素(azithromycin, AZM)属于大环内酯类抗生素[1],它能结合某些病原菌的核糖体,终结细菌的生命活动。因此,临床上AZM常用于治疗由某些病原菌所导致的皮肤、呼吸道、消化道和软组织感染等疾病[2]。但AZM会通过某些行业废水排放到环境中,进而进入人体,引发人体的不良反应[3],因此,对AZM进行监测十分重要。目前已报道了多种AZM的检测方法,如高效液相色谱法[4]、分光光度法[5]和拉曼光谱法[6]等,这些方法虽然准确性好,但存在仪器贵重、操作复杂、灵敏度低等不足[7]。而电化学分析法具有设备便宜、操作简单、灵敏、快速和适合现场检测等优点[8]。目前,有关AZM的电化学检测方法已有不少报道[9],但灵敏度和选择性较少。
分子印迹聚合物(molecularly imprinted polymer, MIP)不仅可识别目标分子的官能团种类,还能识别目标分子的形状和大小,从而实现与目标分子的特异性结合[10]。因此,MIP对目标分子具有高度的选择性,引入MIP是提高电化学传感器选择性的重要策略之一。MIP的制备方法包括沉淀聚合法[11]、原位聚合法[12]和电化学聚合法[13]等。其中电化学聚合法相对简单,其通过调节某些电化学参数以及功能单体的浓度来控制MIP的厚度和均匀度[14]。目前,有关AZM的分子印迹电化学传感器鲜有报道。Rebelo等[15]研制了一种以AZM为模板分子、4-氨基苯甲酸为单体,在丝网印刷碳电极上通过循环伏安法制备AZM的分子印迹电化学传感器,其线性范围为0.5~10.0 μmol/L,检测限(limit of detection, LOD)为0.08 μmol/L(S/N = 3),并用于水样中AZM的检测。冯雅倩[16]研制了一种以AZM为模板分子、甲基丙烯酸为单体的分子印迹电化学传感器,其线性范围为0.1~20.0 μmol/L,检测限为0.011 μmol/L(S/N = 3),并用于药物、血样、尿样中AZM的检测。
多巴胺(dopamine, DA)是一种茶酚类物质,其聚合反应简单、条件温和,具有普适性[17]。聚多巴胺表面存在大量的邻苯二酚、氨基等官能团[18],方便进一步修饰。DA容易进行电化学聚合且与电极表面的黏附力强,已应用于电化学传感器的制备[19]。为提高电化学传感器的导电性和灵敏度,通常在电极上修饰碳基纳米材料。磺化沥青(sulfonsted bitumen, SP)是沥青的磺化产物[20],易溶于水、来源广泛、廉价易得。由SP制得的碳纳米颗粒(carbon nanoparticles, CNPs)可实现紧密堆积,具有各向同性,利于分子或离子从各个方向嵌入和脱出[21],且利用磺化沥青制备的碳纳米颗粒,与其他碳基纳米材料一样具有比表面积大、导电性强的优点,用于修饰电极,且对电信号具有较强的增敏作用[22]。目前,SP作为碳源制得的CNPs已有报道,并应用于电容器和储能电池的电极材料中[23],但在电化学传感器的制备方面尚未见报道。壳聚糖(chitosan, CS)属于碱性多糖,绿色无毒、价格低廉、具有良好的导电性、黏附性、成膜性和生物相容性[24]。CS分子链上分布着大量的氨基和羟基,可与许多金属离子形成稳定的螯合物[25],利于在Au电极表面形成紧密结合的薄膜。
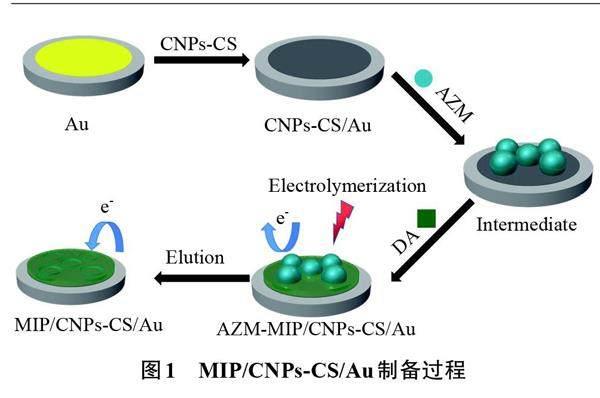
本文以SP为碳源制备了CNPs,将CNPs分散在壳聚糖(CS)溶液中,并用滴涂法修饰在Au电极上,得到CNPs-CS/Au;然后以AZM为模板分子、DA为单体,通过CV法在CNPs-CS/Au上電聚合生成AZM印迹聚合物,洗脱AZM后得到对AZM具有特异性识别的电化学传感器(MIP/CNPs-CS/Au)。该传感器具有制备简单、检测快速、灵敏度和选择性高等优点,已成功地应用于实际尿样中AZM的检测。
1 实验部分
1.1 试剂与仪器
SP购自河南元春化工有限公司。DA(98%)购自安徽泽升科技有限公司。AZM标准品(98%)和氯霉素购自上海安谱公司。CS购自国药集团化学试剂有限公司。L(+)-抗坏血酸(C6H8O6)、磷酸二氢钾(KH2PO4)和硫酸钠(Na2SO4)购自广东光华科技股份有限公司。甲醇(CH4O)、乙酸(C2H4O2)、磷酸氢二钾(K2HPO4·3H2O)、亚铁氰化钾(K4Fe(CN)6·3H2O)、氢氧化钾(KOH)和葡萄糖(C6H12O6)均购自西陇化工股份有限公司。铁氰化钾(K3Fe(CN)6)和氯化钾(KCl)购自成都市科隆化学品有限公司。柠檬酸(C6H8O7)购自天津永大化学试剂有限公司。所有试剂均为分析纯,实验室用水均为超纯水。
XRD分析仪(Bruker D8)购自长沙艾克赛普仪器设备有限公司;FEI Nova Nano型超高分辨场发射扫描电子显微镜购自FEI公司;Thermo escalab 250Xi型光谱仪购自上海非利加实业有限公司;SK-G081236-3-655型真空/气氛管式电炉购自天津中环电炉股份有限公司;RST5000电化学工作站购自苏州瑞思泰电子有限公司。
1.2 MIP/CNPs-CS/Au的制备
1.2.1 CNPs的制备
将SP放入超纯水中,在90 ℃下加热回流4 h,然后离心去除杂质并在80 ℃下干燥12 h。将干燥好的SP放入惰性气氛管式炉中,在800 ℃下灼烧2 h,其中升温速率为5 ℃/min。待管式炉冷却至室温后,即可制备成CNPs[26]。将CNPs研磨至100目(0.15 mm)备用。
1.2.2 CNPs-CS/Au的制备
CS分散液的配制:将20 mg CS溶于1.0 mL乙酸,用超纯水定容至10.0 mL。
分别用0.30、0.05 μm氧化铝粉浆将Au电极打磨抛光至镜面,再依次在无水乙醇和超纯水中超声洗净,然后用N2气流吹干备用。将25 mg CNPs加入到1.0 mL CS分散液中,超声30 min得到均匀的CNPs悬浮液,取5 μL滴涂到电极表面,在白炽灯下干燥30 min,得到修饰电极(CNPs-CS/Au)。
1.2.3 MIP/CNPs-CS/Au的制备
将CNPs-CS/Au放入含80.0 μmol/L AZM和1.0 g/L DA的PBS缓冲溶液(0.1 mol/L,pH=7.0)中,电聚合制备AZM的MIP/CNPs-CS/Au(图1)。电聚合方法为CV法,在-0.5~0.5 V范围循环扫描10圈,扫描速率为100 mV/s。将未洗脱AZM模板分子的修饰电极(AZM-MIP/CNPs-CS/Au)用水冲洗并自然晾干后,放入甲醇与乙酸体积比为9∶1的洗脱液中浸泡15 min,洗脱AZM模板分子,得到具有AZM孔穴的MIP/CNPs-CS/Au。在电聚合MIP膜过程中不加入AZM,其他实验条件同上,制备非分子印迹电化学传感器(NIP/CNPs-CS/Au)。
1.3 电化学检测
实验采用三电极系统,其中,饱和Ag/AgCl电极为参比电极,Pt丝电极为对电极,Au电极或修饰的Au电极为工作电极。电化学测试在0.1 mol/L PBS溶液中进行,以5.0 mmol/L的Fe(CN)[4-6]/Fe(CN)[3-6]作探针,分别用循环伏安法(cyclic voltammetry, CV)、电化学阻抗法(electrochemical impedance method, EIS)和差示脉冲阳极溶出伏安法(differential pulse anode dissolution voltammotry, DPASV)对MIP/CNPs-CS/Au进行电化学表征。CV测试的电位扫描范围为-0.2~0.6 V,扫描速率为100 mV/s;EIS测试的交变电压为7 mV,频率范围为1~139 000 Hz;用DPASV法在含有5.0 mmol/L Fe(CN)[4-6]/Fe(CN)[3-6]的0.1 mol/L PBS溶液中进行电化学信号测试,扫描的电位范围为-0.2~0.6 V,振幅为0.05 V。
2 结果与讨论
2.1 SP和CNPs表征
对SP和CNPs的形貌和结构分别进行扫描电镜(scanning electron microscope, SEM)表征(图2)。如图2(a)所示,SP表面呈现较光滑的片层状结构;图2(b)为CNPs的SEM图,由SP衍生的CNPs呈致密堆积的颗粒状结构[27],与文献[26]报道的结果一致。
对SP和CNPs材料分别进行X射线衍射(X-ray diffraction, XRD)、Raman表征(图3)。从图3(a)可以看出,SP在2θ为26.64°和29.42°处有2個衍射峰。热碳化后,SP的衍射峰消失,在25.12°和34.72°处出现了强度很弱的宽峰,表明CNPs有一定程度的石墨化[28]。
从图3(b)可以看出,SP在1 572 cm-1处出现G峰,在1 326 cm-1处出现D峰,R=ID/IG=0.85;CNPs在1 591 cm-1处出现G峰,在1 345 cm-1处出现D峰,R=ID/IG=0.75。通过对比SP和CNPs的R值,表明CNPs的有序程度增大[29]。
对CNPs进行(X-ray photoelectron energy spectroscopy, XPS)表征,其全谱扫描如图4所示,在285.08 eV处存在C 1s的特征峰;在532.08 eV处存在O 1s特征峰;在153.08 eV处存在S 2p特征峰(图4(a))。在C 1s谱中,C—S、C—C、C—O和CO键所对应的结合能分别是284.23、284.98、285.73和287.53 eV(图4(b))。在O 1s谱中,CO、O—S和C—O键所对应的结合能分别是531.88、533.18和533.88 eV(图4(c))。在S 2p谱中,C—SOx键为碳与硫氧化物的共价键,所对应的结合能是169.48 eV[27](图4(d))。
2.2 MIP/CNPs-CS/Au的电化学表征
对MIP/CNPs-CS/Au进行CV、DPASV、ESI等表征,结果如图5所示。
2.2.1 CV表征
以Fe(CN)[4-6]/Fe(CN)[3-6]作为探针,用CV法对不同修饰电极进行电化学表征,结果如图5(a)所示。曲线a表示Au电极在Fe(CN)[4-6]/Fe(CN)[3-6]溶液中的氧化还原峰。Fe(CN)[4-6]/Fe(CN)[3-6]在CNPs-CS/Au上的氧化还原峰明显增大,这归因于CNPs具有较大的比表面积(曲线b)。壳聚糖修饰金电极(CS/Au)的氧化还原峰(曲线c)比CNPs-CS/Au的氧化还原峰小,说明CNPs加快了电子的转移。由于在CNPs-CS/Au电极表面形成了一层致密的MIP膜,导致Fe(CN)[4-6]/Fe(CN)[3-6]在AZM-MIP/CNPs-CS/Au電极上的氧化还原峰变小(曲线d)。当AZM-MIP膜上的AZM被洗脱后,留下与AZM相匹配的印迹孔穴,为Fe(CN)[4-6]/Fe(CN)[3-6]提供了传递通道,使得Fe(CN)[4-6]/Fe(CN)[3-6]在MIP/CNPs-CS/Au上的氧化还原峰明显增大(曲线e)。MIP/CNPs-CS/Au电极重新吸附AZM后,导致传递通道堵塞,Fe(CN)[4-6]/Fe(CN)[3-6]在R-MIP/CNPs-CS/Au上的氧化还原峰减小(曲线f)。由于NIP没有印迹孔穴,因此,在洗脱前的NIP/CNPs-CS/Au和洗脱后的E-NIP/CNPs-CS/Au上Fe(CN)[4-6]/Fe(CN)[3-6]的氧化还原峰无明显变化(曲线g和曲线h)。上述实验结果表明,MIP膜制备成功,该MIP电化学传感器对AZM具有特异性识别能力,可显著提高传感器的选择性。
2.2.2 DPASV表征
在Fe(CN)[4-6]/Fe(CN)[3-6]溶液中,采用DPASV法考察了修饰电极的电化学行为,结果如图5(b)所示。曲线a表示Au电极在Fe(CN)[4-6]/Fe(CN)[3-6]溶液中的DPASV曲线。由于CNPs具有较大的比表面积和导电性,Fe(CN)[4-6]/Fe(CN)[3-6]在CNPs-CS/Au上溶出峰明显增大(曲线b)。壳聚糖修饰金电极(CS/Au)的溶出峰(曲线c)比CNPs-CS/Au的溶出峰小,说明CNPs加快了电子的转移。由于在CNPs-CS/Au电极表面形成了一层致密的MIP膜,导致Fe(CN)[4-6]/Fe(CN)[3-6]在AZM-MIP/CNPs-CS/Au上的溶出峰变小(曲线d)。MIP/CNPs-CS/Au存在目标分子的印迹孔穴,Fe(CN)[4-6]/Fe(CN)[3-6]易通过印迹孔穴被吸附到电极表面,因此,Fe(CN)[4-6]/Fe(CN)[3-6]的溶出峰明显增大(曲线e)。MIP/CNPs-CS/Au重吸附AZM后,导致Fe(CN)[4-6]/Fe(CN)[3-6]传递通道堵塞,Fe(CN)[4-6]/Fe(CN)[3-6]在R-MIP/CNPs-CS/Au上的溶出峰减小(曲线f)。由于NIP没有印迹孔穴,在洗脱前的NIP/CNPs-CS/Au和洗脱后的E-NIP/CNPs-CS/Au上Fe(CN)[4-6]/Fe(CN)[3-6]的溶出峰无明显变化(曲线g、h)。上述实验结果表明,该MIP电化学传感器对AZM具有特异性识别能力,利于提高检测选择性。
2.2.3 EIS表征
采用EIS表征不同修饰电极的阻抗变化,结果如图5(c)所示。曲线a表示Au电极的阻抗曲线。CNPs-CS/Au的阻抗图中半圆直径减小,说明阻抗变小(曲线b)。壳聚糖修饰金电极(CS/Au)在阻抗图中半圆直径(曲线c)大于CNPs-CS/Au的半圆直径,说明CNPs加快了电子的转移。由于AZM-MIP膜致密,不利于Fe(CN)[4-6]/Fe(CN)[3-6]探针的传递,因此,AZM-MIP/CNPs-CS/Au的阻抗图中半圆直径变大,阻抗增大(曲线d)。在模板分子AZM被洗脱后,印迹膜上出现印迹孔穴,Fe(CN)[4-6]/Fe(CN)[3-6]探针可被吸附到达MIP/CNPs-CS/Au表面,因此,阻抗图中半圆直径变小,阻抗减小(曲线e)。MIP/CNPs-CS/Au重吸附AZM后,导致Fe(CN)[4-6]/Fe(CN)[3-6]传递通道堵塞,Fe(CN)[4-6]/Fe(CN)[3-6]探针的传递通道减少,电极R-MIP/CNPs-CS/Au表面阻抗增大(曲线f)。由于NIP不含印迹孔穴,Fe(CN)[4-6]/Fe(CN)[3-6]不能被吸附到电极表面,NIP/CNPs-CS/Au的阻抗图中半圆直径较大,阻抗增大(曲线g),且与洗脱后E-NIP/CNPs-CS/Au的阻抗图中半圆直径相似(曲线h)。上述实验结果表明,该MIP电化学传感器对AZM具有特异性识别能力,利于提高传感器的选择性。
以上CV、DPASV和EIS表征结果证明已成功制备具有AZM印记孔穴的MIP/CNPs-CS/Au电化学传感器。
2.2.4 扫描速率
为阐明AZM在MIP/CNPs-CS/Au表面的电化学反应动力学,在含5.0 mmol/L Fe(CN)[4-6]/Fe(CN)[3-6]的PBS中,用CV法考察扫描速率(v)对氧化还原峰电流的影响,如图5(d)所示。当v从20 mV/s增大到200 mV/s时,Fe(CN)[4-6]/Fe(CN)[3-6]的氧化峰电流(Ipa)和还原峰电流(Ipc)也随之同步增加,Ipa和Ipc与v之间的线性回归方程分别为Ipa=0.33v+2.63(R2=0.99),Ipc=-0.49v-1.75(R2=0.99)。可见,Ipa和Ipc分别与v之间呈良好的线性关系,表明Fe(CN)[4-6]/Fe(CN)[3-6]在MIP/CNPs-CS/Au上的电子转移过程受吸附控制[29]。
2.3 实验条件优化
在含有5.0 mmol/L Fe(CN)[4-6]/Fe(CN)[3-6]探针的10.0 mL PBS (0.1 mol/L)溶液中进行实验条件优化(n=3)。
将CNPs滴涂至Au表面,滴涂量固定为5 μL,滴涂的质量浓度范围在15~35 mg/mL内,当CNPs的质量浓度从15 mg/mL增加至25 mg/mL时,溶出峰持续增加,在25 mg/mL时达到最大值;当滴涂量超过25 mg/mL时,溶出峰开始逐渐减小,这是由于CNPs修饰层厚度较大,电极导电性变差,导致溶出峰减小。因此,选择CNPs的最佳滴涂质量浓度为25 mg/mL。
在0.6~1.4 mg/mL范围内,当DA质量浓度从0.6 mg/mL增加至1.0 mg/mL时,溶出峰逐渐增大,在1.0 mg/mL时达到最大值;当用量超过1.0 mg/mL时,溶出峰开始逐渐减小,这是由于聚合膜修饰层厚度较大时,电极导电性变差,溶出峰减小。因此,选择DA的最佳质量浓度为1.0 mg/mL。
在40~120 μmol/L范围内,当AZM浓度从40 μmol/L增加至80 μmol/L时,溶出峰逐渐增大,在80 μmol/L时达到最大值;当超过80 μmol/L时,溶出峰开始逐渐减小,这是因为AZM浓度过大时不利于MIP的形成。因此,选择AZM的最佳浓度为80 μmol/L。
在3~20圈范围内,当聚合圈数从3圈增加至10圈时,溶出峰逐渐增大,10圈时达到最大值;当超过10圈时,溶出峰开始逐渐减小,这是因为随聚合圈数的增多,MIPs厚度逐渐增大,电极的导电性会不断降低。因此,选择MIPs的最佳聚合圈数为10圈。
如图6(a)所示,随着洗脱时间的增加,AZM不断被洗脱,孔穴增多,溶出峰增大;当洗脱到15 min并继续延长时间,溶出峰基本不变,表明洗脱已基本完成。故选择最佳洗脱时间为15 min(曲线c)。随着重吸附时间的增加,AZM不断被吸附,孔穴减少,溶出峰减小;当吸附到10 min并继续延长时间,溶出峰基本不变,表明重吸附已基本完成。故选择最佳重吸附时间为10 min(曲线d)。
在0~0.4 V范围内,当吸附电位从0增加至0.2 V时,溶出峰不断增大,在0.2 V时达到最大值;当吸附电位超过0.2 V时,溶出峰开始减小。因此,选择最佳吸附电位为0.2 V。
在10~50 s内,随着吸附时间增加,溶出峰不断变大;当吸附时间超过30 s时,溶出峰达到最大值并趋于平稳,表明MIPs对AZM已吸附饱和。因此,选择最佳吸附时间为30 s。
如图6(b)所示,在pH值为6.5~8.5范围内,当溶液pH值从6.5增加至7.0时,溶出峰逐渐增大,在7.0时达到最大值;当溶液pH值超过7.0时,溶出峰开始逐渐减小。因此,选择最佳的溶液pH为7.0。
2.4 MIP/CNPs-CS/Au的分析性能
在最佳实验條件下,将制备好的MIP/CNPs-CS/Au电化学传感器置于不同浓度的AZM标准溶液中重吸附10 min,然后放入含有5.0 mmol/L Fe(CN)[4-6]/Fe(CN)[3-6]的10.0 mL 0.1 mol/L PBS中吸附富集30 s。用DPASV法记录溶出峰,结果如图7所示。随着AZM浓度的增大,Fe(CN)[4-6]/Fe(CN)[3-6]的溶出峰逐渐减小,表明MIP对AZM的吸附量不断增加。电流值(Ipa)与AZM浓度(C)分别在0.005~<5.000 μmol/L和5.000~30.000 μmol/L范围内呈良好线性关系。当C在0.005~<5.000 μmol/L时,其线性方程为Ipa= -3.85C + 83.07,R2 = 0.99;当C在5.000~30.000 μmol/L时,线性方程为Ipa = -0.81C + 67.74,R2 = 0.99。MIP/CNPs-CS/Au检测AZM的检出限(LOD)为3.89 nmol/L(S/N=3)。校正曲线分成0.005~<5.000 μmol/L和5.000~30.000 μmol/L两段的原因是:在低浓度溶液中,阿奇霉素分子优先与表面较浅区域的高亲和印迹孔结合,需克服的传质阻力小;随着阿奇霉素浓度升高,高亲和印迹孔逐渐饱和,阿奇霉素分子进一步与位于印迹膜较深区域的低亲和印迹孔结合,需要克服的传质阻力增大,所以存在两段校正曲线[30]。
2.5 重现性和选择性
在相同条件下制备6个MIP/CNPs-CS/Au,将MIP/CNPs-CS/Au分别放入含有5.0 μmol/L AZM的10.0 mL 0.1 mol/L PBS(pH=7.0)溶液中进行重吸附,然后在含有5.0 mmol/L Fe(CN)[4-6]/Fe(CN)[3-6]的PBS溶液中进行DPASV检测,结果如图8(a)所示。6支电极电流值的相对标准偏差(relative standard deviation,RSD)为2.47%,表明该MIP/CNPs-CS/Au传感器检测AZM具有良好的重现性。
在最佳实验条件下,固定AZM的浓度为5.0 μmol/L,考察常见的共存物质对电化学响应的影响,共存物质包括50倍的氯霉素(CAP),100倍的抗坏血酸(ASA)、柠檬酸(CA)和200倍的葡萄糖(glucose)、尿素(urea)。将MIP/CNPs-CS/Au分别放入含有上述共存物质的10.0 mL 0.1 mol/L PBS(pH=7.0)溶液中进行重吸附,然后在含有5.0 mmol/L Fe(CN)[4-6]/Fe(CN)[3-6]的PBS溶液中进行DPASV检测,如图8(b)所示,响应电流的变化均在±5%范围内,表明上述的共存物质对AZM的检测没有明显的干扰。可见,该电化学传感器对AZM的检测具有较好的选择性,可应用于复杂样品中AZM的特异性识别与检测。
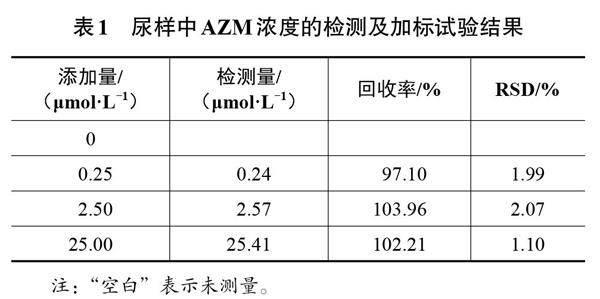
2.6 實际样品的检测
用MIP/CNPs-CS/Au对尿样中AZM的浓度进行检测。尿样不做处理,将100 μL尿样与10.0 mL 0.1 mol/L PBS(pH=7.0)溶液混合。MIP/CNPs-CS/Au在待测液中进行重吸附10 min,然后在含有5.0 mmol/L Fe(CN)[4-6]/Fe(CN)[3-6]中进行DPASV检测,并根据标准曲线计算样品中AZM的浓度,同时进行加标试验,结果如表1所示。由表1可知,尿样的加标回收率为97.10%~103.96%,RSD值为1.10%~2.07%。可见,该传感器可实现对尿样中AZM浓度的准确检测,结果较理想。
3 结论
本实验以SP衍生的CNPs作为增敏材料,制备了修饰金电极CNPs-CS/Au;以DA为功能单体,AZM为模板分子,采用电聚合法在CNPs-CS/Au上成功地制备MIP,获得MIP/CNPs-CS/Au。其中,以SP作为碳源通过热解法制备的CNPs,具有导电性好、比表面积大、活性位点多等优点;以DA作为功能单体,以电化学聚合法制备MIP具有简单、快速、条件温和等优点。电化学传感器MIP/CNPs-CS/Au对AZM的检测表现出良好的电催化性能和优异的选择性。此外,该传感器灵敏度高、检出限低、重现性良好,并能方便、快速及准确地分析尿样中AZM的浓度。
参考文献
[1] ZHANG M Q,WU G Z,ZHANG J P,et al.The comparative analysis of gastrointestinal toxicity of azithromycin and 3'-decladinosyl azithromycin on zebrafish larvae[J].Toxicology and Applied Pharmacology,2023,469:116529.
[2] VAJDLE O,?EKULJICA S,GUZSV?NY V,et al.Use of carbon paste electrode and modified by gold nanoparticles for selected macrolide antibiotics determination as standard and in pharmaceutical preparations[J].Journal of Electroanalytical Chemistry,2020,873:114324.
[3] SHAJAHAN S,ABU HAIJA M.Effective removal of azithromycin by novel g-C3N4/CdS/CuFe2O4 nanocomposite under visible light irradiation[J].Chemosphere,2023,337:139372.
[4] XIANG J J,ZHAXI C D,LIAO Q G,et al.Detection of azithromycin residue in broiler feathers by liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography B,2020,1152:122225.
[5] EL-YAZBI A F,KHAMIS E F,YOUSSEF R M,et al.Green analytical methods for simultaneous determination of compounds having relatively disparate absorbance;application to antibiotic formulation of azithromycin and levofloxacin[J].Heliyon,2020,6(9):e04819.
[6] DOAN C S,BUI V T,TONG T T V,et al.Novel approach for infrared spectroscopic quantitation of azithromycin in commercial tablets employing paracetamol as matrix modifier[J].Heliyon,2023,9(3):e14647.
[7] STOIAN I A,IACOB B C,DUDA C L,et al.Biomimetic electrochemical sensor for the highly selective detection of azithromycin in biological samples[J].Biosensors & Bioelectronics,2020,155:112098.
[8] CHINNAPAIYAN S,DAS H T,CHEN S M,et al.CoAl2O4 nanoparticles modified carbon nanofibers as high-efficiency bifunctional electrocatalyst:an efficient electrochemical aqueous asymmetric supercapacitors and non-enzymatic electrochemical sensors[J].Journal of Alloys and Compounds,2023,931:167553.
[9] MAHNASHI H M,MAHMOUD A M,ALKAHTANI A S,et al.Simultaneous electrochemical detection of azithromycin and hydroxychloroquine based on VS2 QDs embedded N,S @graphene aerogel/cCNTs 3D nanostructure[J].Microchemical Journal,2021,163:105925.
[10] WEI J,LIU C,WU T,et al.A review of current status of ratiometric molecularly imprinted electrochemical sensors:from design to applications[J].Analytica Chimica Acta,2022,1230:340273.
[11] WANG X Y,FENG Y,CHEN H Y,et al.Synthesis of dummy-template molecularly imprinted polymers as solid-phase extraction adsorbents for N-nitrosamines in meat products[J].Microchemical Journal,2023,185:108271.
[12] BOGDANOWICZ N,LUSINA A,NAZIM T,et al.Rapid quantification of 2,4-dichlorophenol in river water samples using molecularly imprinted polymers coupled to ambient plasma mass spectrometry[J].Journal of Hazardous Materials,2023,450:131068.
[13] HATAMLUYI B,SADEGHZADEH S,ZEHI Z B,et al.A rapid and recyclable analysis method for sulfadimethoxine detection based on molecularly imprinted electrochemical sensor reinforced by GQDs/ZIF-8 nanocomposite[J].Microchemical Journal,2023,185:108266.
[14] BONYADI S,GHANBARI K.Application of molecularly imprinted polymer and ZnO nanostructure as a novel sensor for tartrazine determination[J].SSRN Electronic Journal,2022. https://www.engineeringvillage.com/app/doc/?docid=cpx_2e898349183334ca86eM76a71017816355&usageOrigin=share.
[15] REBELO P,PACHECO J G,CORDEIRO M N D S,et al.Azithromycin electrochemical detection using a molecularly imprinted polymer prepared on a disposable screen-printed electrode[J].Analytical Methods,2020,12(11):1486-1494.
[16] 馮雅倩.阿奇霉素分子印迹电化学/电化学发光传感器的研制及其应用研究[D].武汉:华中科技大学,2017.
[17] SHEN M M,KAN X W.Aptamer and molecularly imprinted polymer:synergistic recognition and sensing of dopamine[J].Electrochimica Acta,2021,367:137433.
[18] PATEL M,BISHT N,PRABHAKAR P,et al.Ternary nanocomposite-based smart sensor:reduced graphene oxide/polydopamine/alanine nanocomposite for simultaneous electrochemical detection of Cd2+,Pb2+,Fe2+,and Cu2+ ions[J].Environmental Research,2023,221:115317.
[19] BAI X Y,ZHANG B,LIU M,et al.Molecularly imprinted electrochemical sensor based on polypyrrole/dopamine@graphene incorporated with surface molecularly imprinted polymers thin film for recognition of olaquindox[J].Bioelectrochemistry,2020,132:107398.
[20] WANG K K,CHEN M M,ZHU Y Y,et al.Urea-assisted strategy controlling the pore structure and chemical composition of the porous carbon for high-performance supercapacitors[J].Chemistry Select,2019,4(44):13012-13020.
[21] CHANG P P,LI X G,ZHANG C,et al.Preparation of highly condensed porous carbon used in EDLCs with high voltage and high volumetric energy density[J].Diamond and Related Materials,2023,134:109779.
[22] MENG X,CHANG P P,ZHANG J Z,et al.Porous carbon nanospheres with moderately oriented domains for EDLC electrode[J].Journal of the Chinese Chemical Society,2019,66(11):1499-1506.
[23] LIN R D,GAO F,ZHANG X L,et al.N-doped graphene nanolayer originated from the one-step template-induction methodology as anode for high-performance Li-ion capacitor[J].Carbon,2022,200:84-93.
[24] LI F,LIU R Q,DUBOVYK V,et al.Three-dimensional hierarchical porous carbon coupled with chitosan based electrochemical sensor for sensitive determination of niclosamide[J].Food Chemistry,2022,366:130563.
[25] WANG Y,ZHANG B H,TANG Y,et al.Fabrication and application of a rutin electrochemical sensor based on rose-like AuNPs-MoS2-GN composite and molecularly imprinted chitosan[J].Microchemical Journal,2021,168:106505.
[26] HE L,SUN Y R,WANG C L,et al.High performance sulphur-doped pitch-based carbon materials as anode materials for sodium-ion batteries[J].New Carbon Materials,2020,35(4):420-427.
[27] ZHANG C M,CAI J X,CHENG X W,et al.Interface and crack propagation of cement-based composites with sulfonated asphalt and plasma-treated rock asphalt[J].Construction and Building Materials,2020,242:118161.
[28] ZHU Y Y,GUO Y,WANG C Y,et al.Fabrication of conductive carbonaceous spherical architecture from pitch by spray drying[J].Chemical Engineering Science,2015,135:109-116.
[29] JUSTIN B T D,BLAISE N,VALERY H G.Investigation of the photoactivation effect of TiO2 onto carbon-clay paste electrode by cyclic voltammetry analysis[J].Heliyon,2023,9(2):e13474.
[30] 成诗琦,杨锦,覃上英,等.碳量子点增敏的葡萄糖分子印迹电化学传感器[J].分析化学,2023,51(4):549-558.
Detection of azithromycin by molecularly imprinted electrochemical sensitization with carbon nanoparticles
FENG Xu1,2, GUO Hangyu1,2, QIN Danfeng1,2,3, LI Lijun*1,2
(1.School of Biological and Chemical Engineering, Guangxi University of Science and Technology, Liuzhou
545006, China; 2.Guangxi Key Laboratory of Green Processing of Sugar Resources (Guangxi University of
Science and Technology), Liuzhou 545006, China; 3. Medical Faculty, Guangxi University of Science and
Technology, Liuzhou 545006, China)
Abstract: Carbon nanoparticles (CNPs) were prepared by purification and high-temperature carbonization using sulfonated asphalt (SP) as the carbon source. CNPs were dispersed in chitosan (CS) solution and modified on a gold electrode (Au) using a drop coating method to obtain CNPs-CS/Au. Using azithromycin (AZM) as a template molecule and dopamine (DA) as a functional monomer, AZM molecularly imprinted thin films were prepared on CNPs-CS/Au electrodes using electro polymerization method. A highly sensitive and specific electrochemical sensor (MIP/CNPs-CS/Au) for recognizing AZM molecules was constructed. MIP/CNPs-CS/Au was characterized by scanning electron microscopy (SEM), X-ray diffraction (XRD), X-ray photoelectron energy spectroscopy (XPS), cyclic voltammetry (CV), electrochemical impedance spectroscopy (EIS), and differential pulse anode stripping voltammetry(DPASV), respectively. The results show that the current value (Ipa) and AZM concentration (C) of the sensor show a good linear relationship in the range of 0.005~<5.000 μmol/L and 5.000~30.000 μmol/L, respectively. The limit of detection (LOD) is low (3.89 nmol/L, S/N=3). This sensor can be used for the detection of AZM in actual samples, with the spiked recovery rate of 97.10%~103.96% and a relative standard deviation (RSD) of 1.10%~2.07%.
Keywords: carbon nanoparticles; molecularly imprinted polymers; electrochemical sensors; azithromycin
(責任编辑:于艳霞)
收稿日期:2024-01-03;修回日期:2024-01-11
基金项目:国家自然科学基金项目(82260701);广西自然科学基金重点项目(2019GXNSFDA245025)资助
第一作者:冯旭,在读硕士研究生
*通信作者:李利军,博士,教授,研究方向:电分析化学,E-mail:gxustllj@163.com

