饿蚂蝗抗氧化活性研究
张前军, 刘瑜新, 康文艺, 李传宽
(1.贵州大学化学化工学院,贵州贵阳550025;2.河南大学天然药物研究所,河南开封475004)
饿蚂蝗Desmodium sambuense(D.Don)DC.,为豆科山蚂蝗属植物,生长在山坡草地或林边,分布广西、贵州、云南、福建、台湾等地。该药以根或全株及种子入药。性味甘,凉,具清热解毒,消食,止痛的功能。民间用于治疗胃痛,小儿疳积,腮腺炎,淋巴结炎,毒蛇咬伤,脘腹疼痛,创伤,肠胃炎、乳腺炎、尿道炎、痢疾等疾病[1]。山蚂蝗属植物在全世界约有350种,分布于热带和亚热带地区,我国约27种,主产西南部至东南部。目前国内外对该属植物的化学成分及活性研究仅局限广金钱草(Desmoium styracifolium)、葫芦茶(Desmodium triquetrum)、排钱草(Desmodium blandum)、椴叶山蚂蝗(Desmodium tiliaefolium)、大叶山蚂蝗(Desmodium gangeticum)等少数品种。该属植物的主要成分有黄酮类、生物碱类、酚类、三萜类及酸类化合物,具有消炎、抗菌、止痛、抗氧化、保肝、抗肿瘤、扩张血管和对胰岛素分泌的影响等活性[2-6]。本实验应用多种体外抗氧化方法对饿蚂蝗的叶和茎的醇提物进行抗氧化研究,为开发和利用山蚂蝗属植物提供科学依据。
1 材料与方法
1.1 材料与仪器
饿蚂蝗于2008年8月采自贵州省贵阳市,经贵阳中医学院陈德媛教授鉴定为豆科山蚂蝗属植物饿蚂蝗Desmodium sambuense(D.Don)DC.。二苯代苦味酰基自由基(DPPH,日本东京化成工业株式会社);Fe3+-三吡啶三哑嗪(TPTZ,比利时 Acros organics 公司);6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸(Trolox,美国 Aldrich 公司);[2,2′-连氨-(3-乙基苯并噻唑啉-6-磺酸)二氨盐](ABTS,美国Fluka公司);没食子酸丙酯(PG,比利时Acros organics公司),丁基羟基茴香醚(BHA,比利时Acros organics公司),二丁羟基甲苯(BHT,比利时 Acros organics公司)。甲醇,醋酸钠,FeCl3·6H2O,冰醋酸,过二硫酸钾均为分析纯。UV-2000型紫外可见分光光度计(上海尤尼可仪器有限公司),电子天平(梅特勒-托利多仪器有限公司),旋转蒸发仪(东京理化)。
1.2 方法
1.2.1 醇提物的制备
取饿蚂蝗干燥叶和茎粉碎,以1∶10料液比(即1 g原料加10 mL液体)加入70%乙醇,于圆底烧瓶中经回流提取1 h,同法重复提取3次。合并提取液,浓缩得醇提物浸膏,再经70℃烘干,检测水分小于5%,称重,干燥器内保存备用。
1.2.2 DPPH方法
参照文献[7],选择0.06 mmol/L DPPH 乙醇溶液,将一定浓度的待测定样品对半稀释,取0.1 mL加入到3.5 mL DPPH溶液中,充分混合均匀,在室温下静置30 min后,在515 nm波长下检测DPPH吸光度值,同时设置阳性与阴性对照,通过如下公式计算得到样品清除自由基的能力:
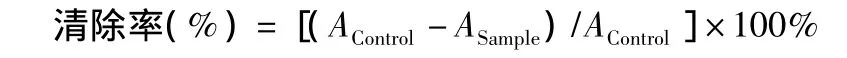
Acontrol为DPPH本身在测定波长的吸收度,Asample为样品对DPPH作用后的吸收度数值(除去样品自身吸收)。同时将样品清除自由基的能力与Trolox清除自由基的能力比较,确定其相对抗氧化活性,当Trolox浓度在25~400 μmol/L时,与DPPH自由基清除率有很好的线性关系,R2=0.999 9。
1.2.3 ABTS方法
参照文献[8],ABTS·+贮备液制备:5 mL 7 mmol/L ABTS的水溶液,加入88 μL浓度为140 mmol/L potassium persulphate(比例为:1∶0.35),混合液使用前在常温下暗室放置12~16 h。ABTS+贮备液用甲醇稀释(比例约:1∶88),得到在734 nm处吸光度为0.80±0.02,并在30℃得到平衡。
方法:1 mL ABTS加入50 μL提取物,在试管中混匀。试管在30℃下保温2.5 min或者5 min或10 min,在734 nm处测吸光度。Trolox的抗氧化活性:5 mmol/L Trolox甲醇贮备液加入此系统中,制定一个标准曲线(Trolox的终浓度为0~20 μmol/L)。
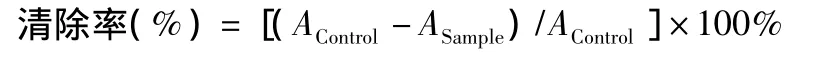
式中,Acontrol为ABTS自由基本身在测定波长的吸收度,Asample为样品对ABTS自由基作用后的吸收度数值(除去样品自身吸收)。同时将样品清除自由基的能力与Trolox清除自由基的能力比较,确定其相对抗氧化活性,当Trolox浓度在25~400 μmol/L时,与ABTS自由基清除率有很好的线性关系,R2=0.999 0。
1.2.4 FRAP方法
参照文献[9],贮备液制备:0.3 mol/L醋酸钠缓冲液,pH 3.6(3.1 g CH3COONa·3H2O,16 mL CH3COOH);10 mmol/L TPTZ溶液用40 mmol/L的盐酸配制;20 mmol/L FeCl3·6H2O溶液。TPTZ工作液由上述3者按体积比为10∶1∶1组成。TPTZ工作液需要新鲜制备,0.2 mL样品溶液加入3.8 mL TPTZ溶液;0.1 mL样品溶液加入3 mL TPTZ溶液;0.15 mL样品溶液加入2.85 mL TPTZ溶液。上述混合液在37℃水浴中反应30 min,在593 nm处测定吸光度。
2 结果与讨论
2.1 结果 见表1。
表1显示,在DPPH方法中,饿蚂蝗叶的醇提物清除DPPH的活性稍大于茎的醇提物。与阳性对照相比,两者清除DPPH的活性约为PG的1/10,BHA的1/5,均高于阳性对照药BHT,可见饿蚂蝗具有较好的清除DPPH自由基能力。从表中还可看出,饿蚂蝗叶和茎的醇提物对ABTS自由基的清除能力相差也不大,与清除DPPH活性不同的是,茎的醇提取物清除ABTS的能力稍大于叶的醇提物。与阳性对照相比,两者清除ABTS自由基的能力约为PG的1/9,BHA的1/4,均大于BHT。在FRAP方法中,饿蚂蝗茎和叶还原Fe3+-三吡啶三哑嗪(TPTZ)的能力相差较大,以叶的还原能力较好,两者还原TPTZ的能力远小于PG和 BHA,且均小于BHT。
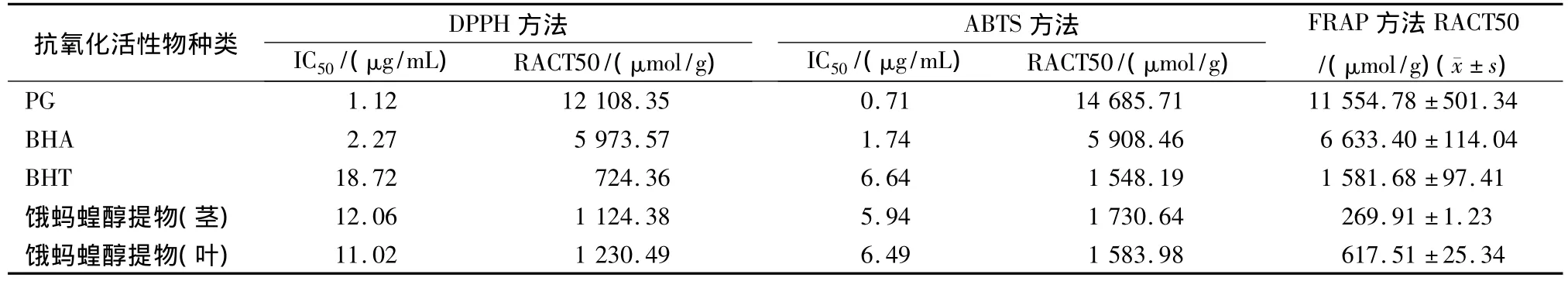
表1 饿蚂蝗醇提物抗氧化活性
图1显示,饿蚂蝗醇提物随着浓度的增加,其清除DPPH自由基的活性增加,当浓度为30 μg/mL时,其对DPPH自由基的清除能力趋于饱和(清除率为90%),再增加提取物浓度清除率也不再增加,说明饿蚂蝗醇提物对DPPH的清除能力具有剂量依赖性。从图中还可以看出,在相同浓度下,饿蚂蝗提取物清除DPPH自由基的能力均大于阳性对照药BHT。说明饿蚂蝗乙醇提取物具有较好的清除自由基的能力。
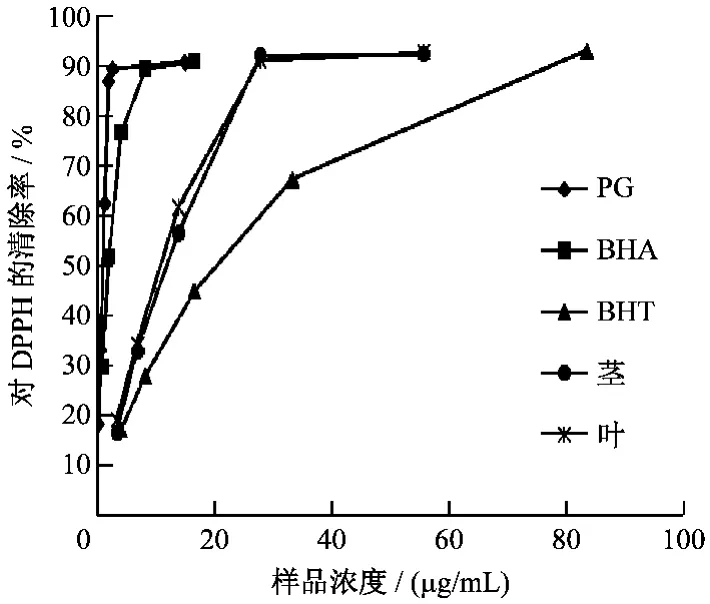
图1 不同浓度样品对DPPH自由基的清除能力
图2显示,饿蚂蝗茎和叶的乙醇提物的清除ABTS自由基的能力基本一致。随着浓度的增加,其清除ABTS自由基的能力增加,当样品浓度达到25 μg/mL时,其清除ABTS自由基的能力达到饱和(清除率为100%),说明饿蚂蝗提取物对ABTS自由基的清除能力也具有剂量依赖性。从图中还可以看出,当样品浓度大于5 μg/mL时,其清除ABTS自由基的活性大于BHT,说明虽然两者的IC50值与BHT相差不大,但是在相同浓度下,其清除ABTS自由基的能力大于BHT。
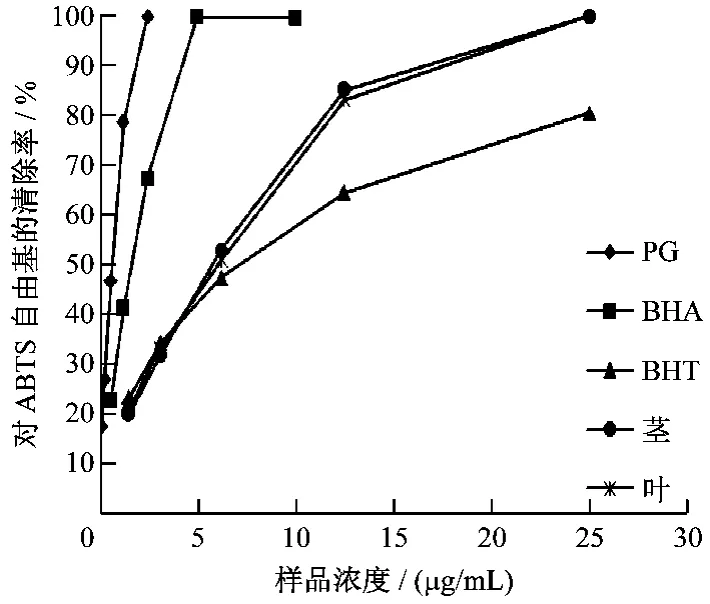
图2 不同浓度样品对ABTS自由基的清除能力
2.2 讨论
DPPH·是一种很稳定的以氮为中心的自由基,若受试物能将其清除,则表明受试物具有降低羟基自由基、烷基自由基或过氧化自由基的有效浓度和打断脂质过氧化链反应的作用[10]。DPPH·在515 nm附近有强吸收。当有供氢能力的抗氧化剂存在时,孤对电子被配对,吸收消失或减弱,而吸光度变小的程度与自由基被清除的程度呈定量关系。实验结果说明饿蚂蝗茎和叶的醇提物具有较好的降低羟基等自由基的有效浓度和打断脂质过氧化的能力,作者认为这可能与饿蚂蝗所含黄酮类成分有关。
ABTS是一种水溶性的自由基引发剂,经活性氧氧化后生成稳定的蓝绿色阳离子自由基ABTS·+。向其中加入被测物质,当待测物质中含有抗氧化物时,该物质会与ABTS·+发生反应而使反应体系颜色褪去,在734 nm处有最大吸收即可反映物质的抗氧化活性[11]。本实验中饿蚂蝗的醇提物具有较好的清除ABTS·+能力,显示较好的抗氧化活性。
在低pH值的溶液中,Fe3+-三吡啶三哑嗪(tripyridyl-triazine,TPTZ)可被抗氧化剂还原为二价铁形式,呈现出明显的蓝色,并在593 nm处有最大吸收,根据吸光度的大小计算出抗氧化活性的强弱。它反映的不是样品针对某一种自由基的清除活性,而是样品总还原能力,一些学者因此认为该法测定结果可用来反映样品总抗氧化活性[12]。从实验结果看出,饿蚂蝗茎和叶的醇提物总还原能力较弱,可能与饿蚂蝗所含成分有关。
通过3种方法对饿蚂蝗的茎和叶的醇提物进行抗氧化活力研究,发现饿蚂蝗乙醇提取物清除DPPH和ABTS自由基的能力比阳性对照BHT好,饿蚂蝗乙醇提取物还原Fe3+的能力不如阳性对照药;研究结果表明,饿蚂蝗茎和叶的醇提物都具有较好的抗氧化能力。
[1]胡熙明,张文康,朱庆生,等.中华草本[M].上海:上海科学技术出版社,1999:1986-1990.
[2]Kurian Gino A,Yagnesh N,Kishan R S,et al.Methanol extract of Desmodium gangeticum roots preserves mitochondrial respiratory enzymes,protecting rat heartagainst oxidative stress induced by reperfusion injury[J].India J Pharm Pharmacol,2008,60(4):523-530.
[3]李晓亮,汪 豪,刘 戈,等.广金钱草的化学成分研究[J].中药材,2007,30(7):802-805.
[4]Lin Yuying,Kong Lingyi.Studies on the chemical constituents of Desmodium styracifolium(Osbeck)Merr[J].Asian J Trad Med,2006,1(1):34-36.
[5]Govindarajan R,Vijayakumar M,Rao C V,et al.Antiinflammatory and antioxidant activities of Desmodium gangeticum fractions in carrageenan-induced inflamed rats[J].Phytother Res,2007,21(10):975-979.
[6]毛绍春,李竹英,李 聪.山蚂蝗属3种植物的抗氧化性能研究[J].云南大学学报,2007,29(4):393-397.
[7]李彩芳,宋艳丽,刘瑜新,等.珍珠菜的抗氧化活性[J].精细化工,2008,25(12):1193-1195.
[8]康文艺,李彩芳,宋艳丽.蝉翼藤抗氧化酮成分研究[J].中国中药杂志,2008,33(16):1982-1985.
[9]宋艳丽,康文艺.帽蕊木抗氧化活性研究[J].精细化工,2009,26(2):150-152.
[10]师梅梅,杨建雄.龙血竭胶囊的体外抗氧化研究[J].中成药,2007,29(11):1591-1594.
[11]朱玉昌,焦必宁.ABTS法体外测定果蔬类总抗氧化能力的研究进展[J].食品与发酵工业,2005,31(8):77-80.
[12]郭长江,杨继军,李云峰,等.FRAP法测定水果不同部分抗氧化活性[J].中国公共卫生,2003,19(7):841-843.

