日本脑炎病毒囊膜蛋白的基因原核表达及抗原性分析
张 宁,金洪涛,夏志平*,张瑞岩,刘 雯,李 勇,薛慧亮,李 丹,丁 壮*
(1.吉林大学动物科技学院,吉林长春130062;2.解放军军事医学科学院军事兽医研究所,吉林长春130062)
日本脑炎(Japanese encephalitis,JE)是由日本脑炎病毒(Japanese encephalitis virus JEV)引起的一种严重的人畜共患虫媒病毒性疾病,是人类中枢神经系统最常见的虫媒病之一[1]。JEV可引起妊娠母猪发生流产和死胎,公猪表现为睾丸炎,育肥猪持续高热,新生仔猪脑炎[2]。本病不但对养猪业造成了巨大的经济损失,而且在世界许多国家广泛存在。在中国,JEV分布于除新疆维吾尔自治区、青海、西藏外的所有省市自治区。由于日本脑炎疫苗的广泛应用,使得疫情大幅度降低[3],但日本脑炎病毒仍然严重威胁着人类健康,因此,有必要及时的了解JEV的流行趋势及建立综合防控的技术措施和示范体系。
日本脑炎病毒属黄病毒科(Flaviviridae),黄病毒属(Flavivirus),病毒基因组为单股正链RNA,其基因组长度约为11 kb,其中5′端有Ⅰ型帽状结构,3′端无polyA尾,病毒基因组仅含有一个开放阅读框(open reading frame,ORF)编码产物通过裂解和加工形成约10个蛋白,由5′端末端编码,而3′端编码非结构蛋白(nonstructural protein,NS)[4]。日本脑炎病毒包括3个结构蛋白基因,7个非结够蛋白基因和2个非翻译区,其中囊膜糖蛋白E表面有囊膜糖蛋白刺突[5]。因此基因工程重组表达的JEV E蛋白抗原有望成为标准化的诊断抗原。试验对JEV E蛋白进行原核表达并对抗原性进行鉴定。
1 材料与方法
1.1 材料
1.1.1 病毒 日本脑炎弱毒株SA 14-14-2,为解放军军事医学科学院军事兽医研究所基础实验室保存。
1.1.2 菌种和质粒 大肠埃希菌DH 5α、BL21(DE3)感受态为解放军军事医学科学院军事兽医研究所基础实验室保存;克隆质粒pMD-18T为宝生物工程(大连)有限公司产品;pET-28a表达载体为本实保存。
1.1.3 试剂 限制性内切酶(XhoⅠ、Eco RⅠ)T4 DNA连接酶、AMV逆转录酶、DNA聚合酶、等为Takara公司产品;兔抗JEV多克隆抗体为解放军军事医学科学院军事兽医研究所基础实验室自制;猪JEV阳性、阴性血清、辣根过氧化物酶标记羊抗猪IgG为深圳绿诗源公司产品;DNA回收试剂盒;金属螯和亲和层析介质(Ni-NTA)为Merck公司产品;IPTG、HRP标记羊抗兔IgG为Promega公司产品。
1.2 方法
1.2.1 病毒RNA提取 参照Trizol法提取病毒RNA,按照试剂盒说明书进行。
1.2.2 RT-PCR扩增JEV E基因及产物的回收取10μL RNA作为模板、2μL随机引物,70℃水浴5min,冰浴5min,0.5μL RNA酶抑制剂、8μL 5×bu ffer、8μL dNTP、0.5μLAMV逆转录酶、加水补足至40μL体系,42℃水浴1 h。取2.0μL反转录产物为模板,以P1:5′-GCGAATTCTTACCATCCTCCTGCTGTTG-3′,P2:5′-ATCTCGAGCGCATCTCATCTCTTTTCTTGT-3′(P1、P2引物的5′端分别含有Eco RⅠ和XhoⅠⅠ内切酶识别位点)作为引物进行PCR扩增,反应条件为:94℃10 min;94℃1 min,58℃1 min,72℃2 m in,35个循环;最后72℃10min,扩增结束,将上述产物用10 g/L琼脂糖凝胶电泳检测,检测正确后,纯化回收PCR产物。
1.2.3 JEV E蛋白基因克隆载体pMD-18T-E的构建 取上述回收产物溶于20μL超纯水,将目的片段连接到pMD-18T中。连接体系:5μL胶回收产物、4.5μL solutionⅠ、0.5μL pMD-18T,16℃过夜。然后将连接产物转化感受态细菌DH 5α,涂布于含Ka+(50μg/mL)的LB平板上,37℃培养过夜,次日挑单菌落于5 mL LB中,37℃摇床振荡(200 r/min)培养过夜。次日,碱裂解法提取质粒,并以Eco RⅠ和XhoⅠ酶切进行鉴定。
1.2.4 重组质粒的序列测定 由宝生物工程(大连)有限公司完成。
1.2.5 JEV E蛋白重组表达载体pET28a-E的构建 以Eco RⅠ+XhoⅠ酶切测序正确的质粒及pET-28a空载体质粒,将上述酶切产物用10 g/L琼脂糖凝胶电泳鉴定,并回收目的片段E基因和载体片段(按照凝胶试剂盒说明书进行回收)。5μL E基因双酶切胶回收产物,3.5μL pET-28a双酶切胶回收产物,0.5μL T4 DNA连接酶,1μL T4缓冲液,16℃连接过夜,然后将连接产物转化感受态细菌DH 5α,碱裂解法提取质粒,以Eco RⅠ+XhoⅠ酶切进行鉴定。
1.2.6 JEV E蛋白的诱导表达
1.2.6.1 JEV E蛋白表达产物的可溶性分析 将酶切正确的质粒转化大肠埃希菌BL21(DE3),涂布于含Kan(50μg/mL)的LB平板上,37℃培养过夜,次日挑取单菌落,于5 mL LB液体培养基中,37℃摇床振荡(200 r/min)培养过夜。以1∶100比例接种于新鲜的含Kan(50μg/mL)的LB培养基中,剧烈振荡,待OD600约为0.4~0.6,加入IPTG诱导剂,终浓度为1.0 mmol/L,继续在摇床37℃(200 r/m in),4 h后收集菌液。并设BL21诱导对照、未诱导的pET-28a(+)/BL21对照、pET-28a(+)/BL21诱导对照、未诱导的pET-E/BL21对照、pET-E/BL21诱导对照、各取1 mL,以6 000 r/min,4℃离心5 min,收菌,用PBS重悬,加入2×SDS-PAGE上样缓冲液进行处理。另外离心收集菌体1mL,以细胞裂解液重悬菌体,超声破菌。分别收集上清和沉淀,取上述各样品做SDSPAGE电泳检测表达情况。
1.2.6.2 不同浓度的IPTG对JEV E蛋白的诱导表达分析 将菌液按1∶100接种于5 mL含有Kan 50μg/mL)抗生素的LB液体培养基中,37℃振荡培养至OD600为0.4~0.6时,加入IPTG至终浓度分别为0.1、0.2、0.4、0.8、1.0、1.5、2.0mmoL/L,37℃诱导表达4 h~5 h,收获细菌,然后进行SDS-PAGE分析。
1.2.6.3 不同时间对JEV E蛋白的诱导表达分析将冻存菌液按1∶100扩大接种于5 mL含有Kan(50μg/mL)抗生素的LB液体培养基中,37℃振荡培养至OD600为0.4~0.6时,加入IPTG至终浓度0.8mmol/L,37℃诱导表达1.0、2.0、3.0、4.0、5.0、6.0 h,收获细菌,然后进行SDS-PAGE分析。
1.2.7 工程菌的大量制备及亲和层析纯化E蛋白
取冻存的阳性菌种,接种于5 mL含Kan(50μg/mL)的LB液体培养基中,37℃,200 r/m in震荡培养过夜,次日,按1∶100转接至100mL含Kan+(50μg/mL)的LB液体培养基中,至OD为0.6左右加入IPTG至终浓度为0.8 mmoL/L,37℃诱导表达6 h;4℃,5 000 r/m in离心15 m in,收集菌体;用10mL l×PBS缓冲液洗涤细菌1遍,然后再用10mL l×PBS缓冲液重悬,用超声破碎重悬的细菌,冰浴超声破碎:超声4 s,停止9 s,15 min,功率为300 w,4℃条件下,以8 000 r/m in,离心15min,弃上清,2 mol/L尿素将沉淀溶解后,4℃条件下,以12 000 r/min离心10 min,弃上清,用8 mol/L尿素将剩下透明沉淀溶解,冰上1 h,4℃条件下,以12 000 r/min离心10 min,取上清。
参照M erck公司镍离子亲和层析柱(Ni-NTA)操作说明进行。将50%的Ni-NTA树脂悬浮液1mL与一定量的清亮裂解上清于室温轻柔混匀(100 r/m in摇60min)后,将混合液装柱;收集穿过峰,留小样进行SDS-PAGE;然后用不同变性缓冲液洗脱,收集洗脱液,取不同峰值样品进行SDSPAGE分析。

图1 JEV E基因PCR产物电泳图Fig.1 PCR amplification products of JEVE gene
1.2.8 纯化E蛋白的Western b lot鉴定 纯化后的目的蛋白做SDS-PAGE,随后将电泳蛋白转移到NC膜上,用50 mL/L的脱脂奶封闭37℃1 h,用TBS°T洗膜3次,10 min/次,1∶800稀释兔抗JEV多克隆抗体,4℃孵育过夜,然后用TBS°T洗膜3次,10 min/次,再用HRP标记羊抗兔IgG 37℃作用90min,TBS°T洗膜3次,10 min/次,DAB显色。
1.2.9 纯化E蛋白的ELISA鉴定 纯化的E蛋白分别按1∶5、1∶10、1∶20、1∶40稀释包被ELISA板,100μL/孔,4℃过夜;弃孔中液体,PBST洗板3次,3 min/次~5 min/次;封闭液200μL/孔,37℃孵育2 h;PBST洗板3次,3 min~5 min/次;分别加入1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640稀释的猪乙型脑炎阴、阳性血清,100μL/孔;37℃孵育1 h;弃孔中液体,洗板3次,5min/次,加入辣根过氧化物酶标记羊抗猪IgG作为二抗,100μL/孔,37℃孵育1 h;弃孔中液体,洗板3次5m in/次,各反应孔中加入OPD底物液,室温孵育15 min,于各反应孔中加2 moL/L H2SO4终止液50μL,在酶标仪(492 nm)上进行检测。
2 结果
2.1 JEV E蛋白基因片段的PCR扩增结果
将PCR扩增产物10μL在10 g/L的琼脂糖上进行电泳,结果显示扩增出约1 500 bp的片段,与目的基因的预期大小相符,扩增出了E蛋白基因(图1)。
2.2 重组E蛋白克隆载体的构建和鉴定结果
获得重组克隆质粒pMD-18T-E,经限制性内切酶Eco RⅠ/XhoⅠ双酶切鉴定,切出了1.5 kb和2.7 kb的片段,与预期大小相符(图2)。

图2 pMD18-T-E质粒酶切鉴定Fig.2 Identification of plasm id pM D-18T-E digested by Eco RⅠ/XhoⅠ
2.3 重组E蛋白表达载体的构建和鉴定结果
重组原核表达载体pET28a-E经限制性内切酶Eco RⅠ/XhoⅠ双酶切鉴定结果如下,切出了1.5 kb和5.4 kb片段,与预期大小相符(图3)。
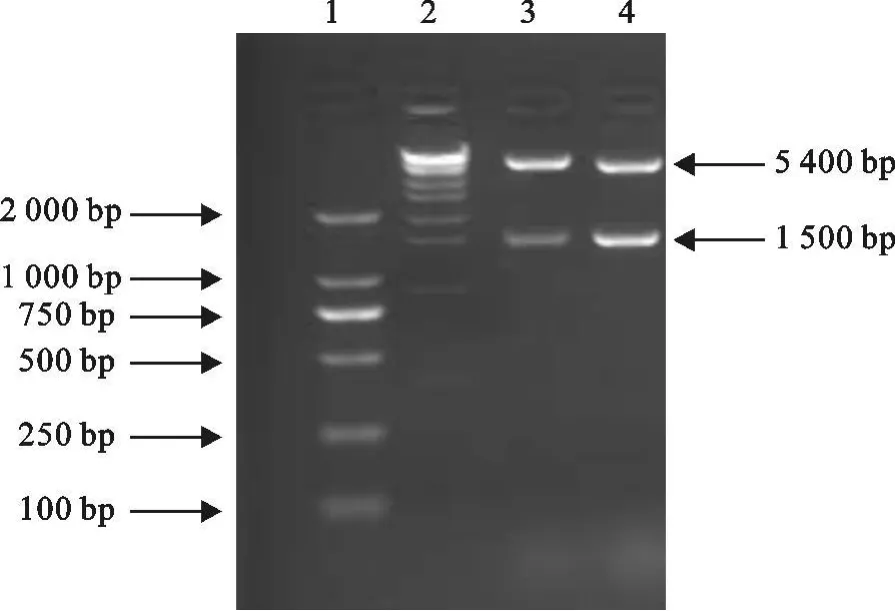
图3 pET28a-E质粒的酶切鉴定Fig.3 Identification of plasmid pET28a-E digested by Eco RⅠ/XhoⅠ
2.4 JEV E蛋白基因核酸序列分析结果
借助Blast软件,进行序列比较发现,该基因片段与减毒株SA 14-14-2、强毒株SA 14、标准强毒株JaOA rS982碱基序列同源性分别为100%、99%、98%,氨基酸序列同源性分别为100%、99%、98%。
2.5 E蛋白的表达及其可溶性分析
重组质粒经IPTG诱导后分别收集上清和沉淀,经SDS-PAGE检测,在相对分子质量约56 ku处有明显的条带,与预期的结果大小相符,融和蛋白主要以包涵体形体存在于沉淀中,上清中也有少量的融和蛋白。诱导空菌,未诱导的和诱导的空载体及未诱导的重组载体对照均无目的蛋白表达(图4)。

图4 乙型脑炎E蛋白的表达及其可溶性分析Fig.4 Expression and solubility analysis of Japanese encephalitis E protein
2.6 不同浓度IPTG对JEV E蛋白的诱导表达分析
加入IPTG至终浓度分别为0.1、0.2、0.4、0.8、1、2 mmol/L,37℃诱导表达4 h收菌,然后进行SDS-PAGE分析。可见基因工程菌诱导加入IPTG至终浓度0.8mm ol/L后,目的蛋白表达量达高峰(图5)。

图5 不同浓度IPTG对JEV E蛋白的诱导表达分析Fig.5 Analysis of induced expression of JEV E protein by different IPTG con centrations
2.7 不同时间对JEV E蛋白的诱导表达分析
加入IPTG至终浓度0.8mmol/L,37℃诱导表达1、2、3、4、5、6 h后收获细菌,然后进行SDSPAGE分析。可见基因工程菌诱导4 h后目的蛋白的表达量达高峰(图6)。

图6 不同时间对JEV E蛋白的表达分析Fig.6 Analysis of the JEV E protein expression at different time
2.8 JEV E蛋白的纯化
利用Ni-NTA柱亲和层析,从诱导表达菌体的沉淀中纯化得到了6His E融合蛋白,SDS-PAGE的鉴定结果表明如下(图7)。紫外光吸收法定量分析表明获得蛋白的浓度约为1.722m g/mL。

图7 JEV E蛋白纯化结果 Fig.7 Purification results of JEV E protein
2.9 纯化JEV E蛋白的Western blot鉴定
经纯化后的E蛋白进行Western b lot分析,在预期大小处可见清晰条带(图8),表达的E蛋白较好地保持了与兔抗JEV多克隆抗体的结合活性,说明,目的蛋白具有较好的抗原性。
2.10 纯化E蛋白的ELISA检测结果
将重组表达并纯化的JEV E蛋白包被于ELISA板上,用不同稀释度的猪JEV阳性血清检测包被于ELISA板上的蛋白,检测结果如表1,结果P/N>2(表2),说明表达并纯化后的蛋白具有较高的抗原性,可明显地区分猪的阳性、阴性血清。

图8 融合E蛋白与JEV多抗的Western blot结果Fig.8 Western blot analysis of E fusion protein with JEV polyclonal antibodies

表1 纯化E蛋白的JEV多抗的ELISATable 1 ELISA of purified E protein with polyclonalantibody of JEV
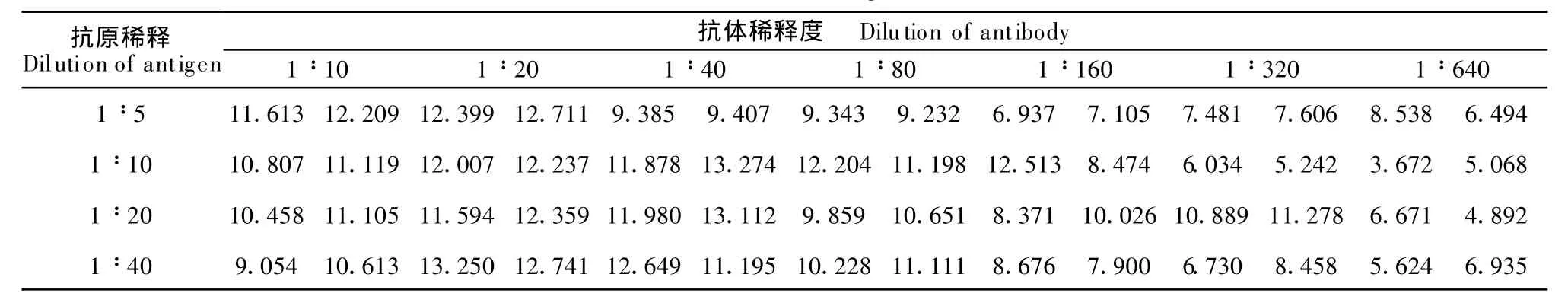
表2 P/N值Table 2 Positive number/negative number
3 讨论
E蛋白是JEV的主要蛋白,基因大约1 500 bp,E结构蛋白基因含有病毒的抗原决定簇,是毒粒表面的重要成份,具有血凝活性和中和活性[6],E蛋白与病毒的毒力、宿主范围、组织嗜性、膜融合保护性免疫、血凝反应和血清特异性有关,它能刺激机体产生中和抗体和血凝抑制抗体,为免疫原性蛋白[7]。因此,克隆乙型脑炎弱毒疫苗SA 14-14-2株E蛋白1 500 bp的基因片段,病毒的天然结构而使构象依赖型抗原表位得以正确呈现,使其更具有免疫原性,这样才会有更高的使用价值,目前,针对乙型脑炎病毒的疫苗大多包含E蛋白中的抗原表位[8-10]。
pET-28a(+)是Novagen公司的一个融合表达载体,具有产物易于纯化,表达效率高的等优点。pET28a-E(+)中的His°Tag融合标签是高度可溶的多肽,可以增强一些蛋白的可溶性。本实验采用pET-28a做为载体,提高了目的蛋白在大肠埃希菌中的表达。本文初步研究了不同浓度IPTG及诱导不同时间对表达的影响,其中以IPTG诱导终浓度为0.8 mmo l/L、37℃、诱导4 h的培养条件最佳,可获得高效率的表达,诱导后目的蛋白主要是以包函体的形式存在,经过Ni-NTA亲和层析法纯化,获得了高纯度的目的蛋白。Western b lot检测抗原性时,兔JEV多抗与目标蛋白结合,出现了目的条带,说明目的蛋白具有抗原性。本文采用猪乙脑病毒抗体血清进行ELISA检测纯化的蛋白抗原性,结果表明抗原稀释1∶40、血清稀释1∶640时,P/N值仍大于2,可见表达的蛋白具有很好的抗原性,所以,本实验制备的乙脑E蛋白可作为鉴别流行性乙型脑炎的实验室诊断抗原,并为进一步研究诊断试剂盒及JEV E蛋白结构与功能奠定了基础。
[1] Verma S K,Gupta N,Pattnaik P,et al.Antibodies against refolded recombinant envelope protein(domain III)of Japanese encephalitis virus inhibit the JEV infection to porcine stable kidney cells[J].Protein PeptLett,2009,16(11):1334-1341.
[2] 吕晓丽,崔保安,陈红英,等.复合RT-PCR检测猪乙脑病毒和猪流感病毒方法的建立[J].华南农业大学学报,2008,29(4):79-82.
[3] Wang H,Li Y,Liang X,et al.Japanese encephalitis in mainland China[J].Jpn J infect Dis,2009,62(5):331-336.
[4] Lin CW,Wu SC.A functional epitope determinant on domain III of the Japaneseencephalitis virusenvelope protein interacted with neutralizing-antibody combining site[J].Virology,2003,77(4):2600-2606.
[5] Verma S K,Kumar S,Gupta N,et al.Bacterially expressed recombinant envelope protein domain III of Japanese encephalitis virus(rJEV-DIII)elicits Th1 type of immune response in BA LB/cm ice[J].Vaccine,2009,27(49):6905-6909.
[6] 邓淑珍,张海林,李金梅.流行性乙型脑炎病毒研究进展[J].中国热带医学,2008(2):306-309.
[7] 汤德元,郭万柱.日本脑炎病毒及其疫苗的研究[J].中国兽医学报,2005,25(2):217-221.
[8] Feng G H,Liu N,Zhou Y,et al.Immunologic analysis induced by DNA vaccine encoding E protein of Beijing-1 strain derived from Japanese encephalitis virus[J].Int Virol,2007,50(2):93-98.
[9] Li Y,Ye J,Cao S,et al.Immunization with pseudotype baculovirusexpressing envelope protein of Japanese encephalitis virus elicits protective immunity in mice[J].JGene Med,2009,11(1):57-65.
[10] Li P,Zheng Q S,Wang Q,et al.Immune responses of recombinant adenoviruses expressing immunodomiant epitopes against Japanese encephalitis virus[J].Vaccine,2008,26(46):5802-5807.

