金丝桃苷对新生大鼠神经细胞缺氧/再给氧损伤的保护作用及其机制
周晓隆,陈志武
在脑缺血/再灌注损伤过程中,由于细胞内钙超载,导致大量的自由基产生,造成脑细胞损伤的加重。金丝桃苷(hyperin,Hyp)为黄酮醇苷类化合物,我们以前的研究表明[1,2]Hyp 有多种药理活性,可以抑制自由基脂质过氧化和钙超载,有一定的抗脑缺血/再灌注损伤作用[3~5]。有研究表明[6]Hyp 对神经细胞缺氧/再给氧损伤有一定的保护作用,本研究探讨了Hyp对神经细胞缺氧/再给氧损伤保护作用的机制。
1 材料
1.1 药品与试剂 Hyp由安徽省医学科学研究所制备,质量分数≥96.0%;尼莫地平(nimodipine,Nim)由新华制药厂出品;Fura 2-AM购自Sigma公司;胰蛋白酶、胎牛血清及RPMI 1640培养基购自Gibco公司;乳酸脱氢酶(LDH)、丙二醛(MDA)和一氧化氮(NO)测试盒购自南京建成生物工程研究所;其他试剂均为市售分析纯。
1.2 动物 新生1~3 d的SD大鼠,由安徽医科大学实验动物中心提供,动物合格证号:皖医实动准第01号。
2 方法
2.1 新生大鼠脑细胞悬液的制备[7,8]无菌条件下取新生1~3 d大鼠的前脑,立即置冰D-Hank's液中,仔细剥离剔除软脑膜和血管,用冰Hank's液洗涤3次,在D-Hank's液(无钙、无镁)中剪成糜状,吸除D-Hank's液,加入0.125%胰蛋白酶于37℃消化15 min,并不时予以摇动。用2倍量的RPMI 1640培养液(含10%胎牛血清)中止消化,离心(1 000 r·min-1,×5 min)弃上清液,加 RPMI 1640培养液重新离心1次,以洗净胰蛋白酶。用RPMI 1640培养液调整细胞浓度为1×109·L-1,置入细胞培养瓶中,37℃、5%CO2培养箱中培养2 h后,台盼蓝染色观察细胞成活率达95%以上可用于实验。
2.2 脑细胞缺氧/再给氧损伤模型[8,9]将上述细胞悬液(需测[Ca2+]i者,则加入 Fura-2 AM)置于37℃、5%CO2培养箱中 40 min 后,离心(1 000 r·min-1,×5 min),用Hank's液洗2 次,换入原体积纯N2饱和30 min的无糖Hank's液(含0.2%胎牛血清蛋白),在培养管通入l L·min-1N240 s以驱除管内O2,同时轻轻吹打分散细胞,加塞密封(测[Ca2+]i者,则直接移入荧光测试杯中,用四周涂有少许凡士林的杯盖密封),置37℃温育。30 min后,分别测定[Ca2+]i或离心(3 000 r·min-1,×5 min)后取上清液,严格按试剂盒说明书操作,采用化学比色法、硫代巴比妥酸盐法及硝酸还原酶法分别测定LDH、MDA 及 NO 含量[8]。
再给氧模型按上法制备缺氧30 min的细胞悬液,离心(1 000 r·min-1,× 5 min),换入正常的Hank's液,置37℃、5%CO2培养箱中(需测[Ca2+]i者,则加入Fura-2 AM)进行再给氧40 min,然后离心,取上清液测LDH、MDA及NO或用含0.2%胎牛血清蛋白的 Hank's洗2次并重新悬浮细胞行[Ca2+]i测定。
实验设假缺氧组(Sham)、对照组(Control)、阳性对照组(Nim)及 Hyp 1.0、4.0 和 16.0 μmol·L-13个浓度组,共5大组,各大组再分为缺氧组和缺氧/再给氧组。Sham组除不缺氧外,实验程序及处理与其他各组一样。用药组在缺氧及再给氧期间均加入Nim或Hyp。
2.3 脑细胞内游离 Ca2+浓度([Ca2+]i)的测定[7,11]将终浓度为 5 μmol的 Fura2-AM 加入细胞悬液中,37℃温育 40 min负载 Fura 2后,离心(1 000 r·min-1,×5 min),弃上清液,沉淀用含0.2%胎牛血清蛋白的Hank's液洗2次并重新调成1 ×109·L-1,测定前细胞在 37℃复温 3 min。
用Hitchi 650-60荧光分光光度仪(λex:340 nm,λem:500 nm)测定不同实验条件下的细胞悬液荧光值(F)、加入终浓度为0.1%TritonX-100后的最大荧光值(Fmax)及加入终浓度为10 mmol·L-1EGTA后的最小荧光值(Fmin)。[Ca2+]i含量按公式:[Ca2+]1=Kd×(F-Fmin)/(Fmax-F)来计算,其中 Kd为 Fura 2与 Ca2+的解离常数,为224 nmol·L-1。
缺氧细胞组的F需校正可能因缺氧致细胞膜透性增加引起的Fura 2少量外漏产生荧光的影响,故每次另测一份同条件的缺氧细胞悬液加入终浓度为 20 μmol·L-1的 MnCl2(以淬灭细胞外荧光)前、后的荧光值,以加入MnCl2后荧光值与加入前荧光值的比值乘以实验组缺氧细胞实测荧光值来校正。
3 结果
3.1 Hyp对缺氧/再给氧诱导的脑细胞损伤的影响 结果如Tab 1所示,缺氧明显地增加细胞上清液中LDH的含量,缺氧/再给氧对细胞上清液中LDH和MDA含量均有明显增加,表明缺氧/再给氧可引起脑细胞的损伤。与5.0 μmol·L-1Nim一样,Hyp 在 1.0 ~16.0 μmol·L-1范围内,可浓度依赖性抑制缺氧/再给氧诱导的细胞上清液中LDH和MDA含量的增加。
Tab 1 Effect of Hyp on anoxia/reoxygenation-induced rat cerebral cell injury(¯ ± s,n=6)
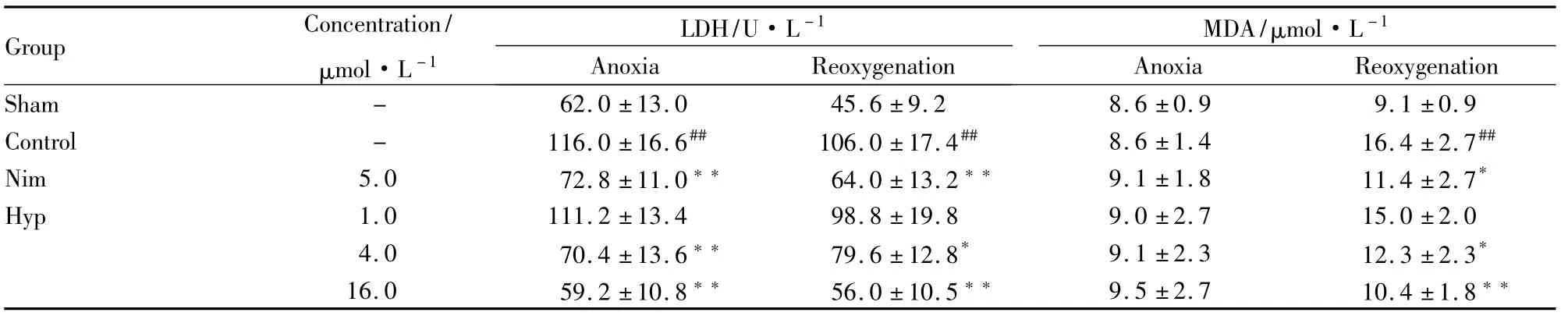
Tab 1 Effect of Hyp on anoxia/reoxygenation-induced rat cerebral cell injury(¯ ± s,n=6)
##P<0.01 vs sham;*P<0.05,**P<0.01 vs control
Group Concentration/μmol·L-1 LDH/U·L -1 Anoxia Reoxygenation MDA/μmol·L -1 Anoxia Reoxygenation Sham - 62.0±13.0 45.6±9.2 8.6±0.9 9.1±0.9 Control - 116.0±16.6## 106.0±17.4## 8.6±1.4 16.4±2.7##Nim 5.0 72.8±11.0** 64.0±13.2** 9.1±1.8 11.4±2.7*Hyp 1.0 111.2±13.4 98.8±19.8 9.0±2.7 15.0±2.0 4.0 70.4±13.6** 79.6±12.8* 9.1±2.3 12.3±2.3*16.0 59.2±10.8** 56.0±10.5** 9.5±2.7 10.4±1.8**
Tab 2Effect of Hyp on anoxia/reoxygenation-induced NO release from rat cerebral cell(μmol·L-1,¯±s,n=6)

Tab 2Effect of Hyp on anoxia/reoxygenation-induced NO release from rat cerebral cell(μmol·L-1,¯±s,n=6)
##P<0.01 vs sham;*P<0.05,**P<0.01 vs control
Group Concentration/μmol·L -1 Anoxia 5 min 15 min 30 min Reoxygenation 40 min Sham - 22.9±6.2 21.8±6.1 20.8±8.3 25.0±6.0 Control - 49.0±9.4## 59.4±14.6## 57.3±7.3## 34.4±6.3##Nim 5.0 33.4±7.3* 39.6±12.5* 38.5±10.5** 25.0±4.2*Hyp 1.0 43.7±8.3 51.0±12.5 53.1±9.4 31.2±5.2 4.0 34.4±6.2* 42.7±6.2* 41.7±6.1** 27.1±4.2 16.0 29.2±8.3** 32.3±10.4** 32.2±5.2** 25.0±5.1*
3.2 Hyp对缺氧/再给氧诱导的脑细胞释放的NO的影响 结果如Tab 2所示,缺氧和缺氧/再给氧可明显地增加细胞上清液中NO含量,表明缺氧/再给氧可引起细胞NO释放的增加。Hyp在1.0~16.0 μmol·L-1范围内,可明显地抑制缺氧/再给氧引起的细胞NO释放的增加,并呈一定的浓度依赖性。5.0 μmol·L-1Nim 有类似的作用。
Tab 3Effect of Hyp on anoxia/reoxygenation-induced change of[Ca2+]iin rat cerebral cell(nmol·L-1±s,n=6)
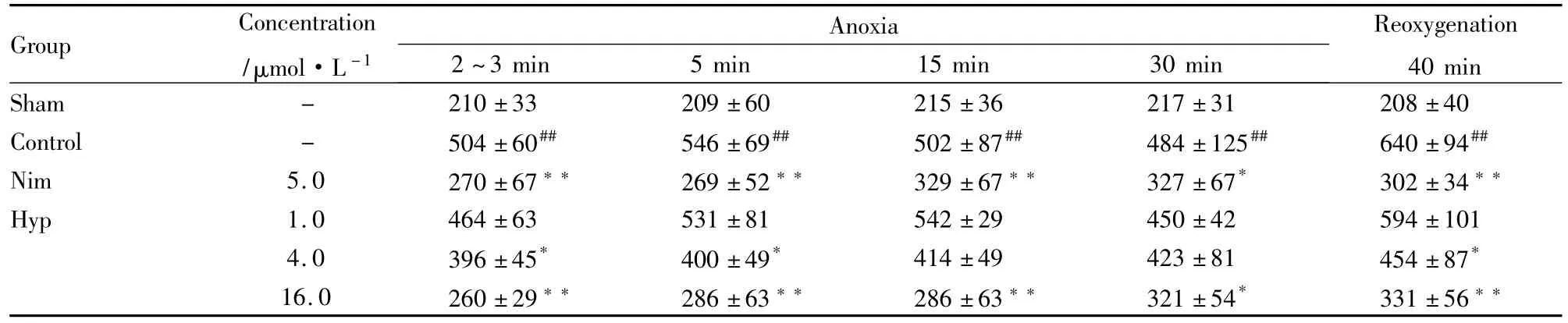
Tab 3Effect of Hyp on anoxia/reoxygenation-induced change of[Ca2+]iin rat cerebral cell(nmol·L-1±s,n=6)
##P<0.01 vs sham;*P<0.05,**P<0.01 vs control
Group Concentration/μmol·L -1 Anoxia 2~3 min 5 min 15 min 30 min Reoxygenation 40 min Sham - 210±33 209±60 215±36 217±31 208±40 Control - 504±60## 546±69## 502±87## 484±125## 640±94##Nim 5.0 270±67** 269±52** 329±67** 327±67* 302±34**Hyp 1.0 464±63 531±81 542±29 450±42 594±101 4.0 396±45* 400±49* 414±49 423±81 454±87*16.0 260±29** 286±63** 286±63** 321±54* 331±56**
3.3 Hyp对缺氧/再给氧诱导的脑细胞[Ca2+]i增加的影响 结果如Tab 3所示,缺氧明显地引起脑细胞[Ca2+]i的增加,缺氧后再给氧则进一步增加脑细胞[Ca2+]i。在 1.0 ~16.0 μmol·L-1范围内,Hyp可浓度依赖性抑制缺氧及再给氧引起的脑细胞[Ca2+]i的增加,5.0 μmol·L-1Nim 有类似的作用。
4 讨论
缺氧/再给氧时,由于脂质过氧化及能量缺乏等因素,脑细胞膜受到损伤,导致细胞膜的通透性增加,使细胞内的一些重要的酶如LDH等大量的外漏释放。本研究中缺氧和再给氧对照组中脑细胞上清液中的LDH明显增加,表明脑细胞有损伤,发生了明显的LDH外漏释放,而Hyp在1.0~16.0 μmol·L-1范围内,可浓度依赖性抑制缺氧/再给氧损伤引起的脑细胞LDH外漏释放,这与彭国平等[6]报道Hyp可阻断缺氧和再给氧引起的神经元细胞MTI比色吸光度值的下降及抑制LDH的释放是一致的。因此,我们的结果支持Hyp对脑细胞缺氧/再给氧损伤有保护作用。
MDA为自由基的脂质过氧化产物,也是细胞损伤的一个重要指标。有资料表明脂质过氧化反应启动于缺氧期,但明显的过氧化反应却表现于再给氧期[12]。这是因为自由基的脂质过氧化的特点是连锁反应,反应后一阶段需要大量的O2才能完成,因缺氧期乏氧,而再给氧期则有充足O2的供给,可使脂质过氧化反应得以进行。我们以前的研究表明[5]在四血管结扎导致的大鼠全脑缺血期间,脑组织中只有氧自由基增多,MDA含量无明显的变化;但脑缺血/再灌注期间MDA却有明显的增多,Hyp可明显抑制MDA的增多[3]。本研究发现脑细胞缺氧期间MDA含量变化也不明显,但再给氧期间MDA含量有明显的增多,这与文献资料及我们以前在脑缺血及再灌整体动物模型上结果是一致的。本研究在细胞水平上发现Hyp对再给氧期间MDA含量的增多有抑制作用,这不仅进一步说明Hyp对脑细胞缺氧/再给氧损伤有保护作用,也提示着其作用可能与抗自由基脂质过氧化有关。
目前研究表明[3]脑缺血/再灌注可致NO释放的增多。虽然生理剂量的NO可扩张脑血管,对脑有保护作用,但NO也是一种自由基,大量增多对细胞有损伤作用,使脑缺血损伤加重[13]。本研究表明在缺氧和再给氧期间,脑细胞释放NO均升高,而Hyp可抑制缺氧/再给氧诱导的脑细胞NO释放的增加,提示抑制NO的释放可能是Hyp对脑细胞缺氧/再给氧损伤产生保护作用的机制之一。
细胞内钙超载是脑细胞缺血/再给血损伤的重要机制,降低细胞内[Ca2+]i可产生保护作用。本研究表明Hyp可以浓度依赖性的抑制缺氧/再给氧诱导脑细胞[Ca2+]i的增加,这与我们以前报道的Hyp可抑制高钾、去甲肾上腺素、5-HT及谷氨酸等引起的神经细胞[Ca2+]i的增高是一致的[11]。
综上所述,本研究发现Hyp对脑细胞缺氧/再给氧损伤有保护作用,其作用可能与抑制NO的释放、钙超载及抗自由基脂质过氧化有关,至于其更深入的作用机制有待于进一步研究。
[1] Wang W Q,Ma C G,Xu S Y.Protective effect of hyperin against myocardial ischemia and reperfusion injury[J].Acta Pharmacol Sin,1996,17(4):341 -4.
[2] 陈志武,马传庚,方 明,徐叔云.金丝桃苷对钙离子内流的影响[J].药学学报,1994,29(1):15 -9.
[2] Chen Z W,Ma C G,Fang M,Xu S Y.The blocking effect of hyperin on the inward flow of calcium ion[J].Acta Pharm Sin,1994,29(1):15 -9.
[3] 陈志武,马传庚,赵维忠.金丝桃苷对脑缺血再灌损伤保护作用的实验研究[J].药学学报,1998,33(1):14 -7.
[3] Chen Z W,Ma C G,Zhao W Z.Protective effect of hyperin against cerebral ischemia-reperfusion injury[J].Acta Pharm Sin,1998,33(1):14-7.
[4] 陈志武,章家胜,马传庚.金丝桃苷对大鼠脑梗塞的保护作用[J].中国中药杂志,1998,23(10):626 -8.
[4] Chen Z W,Zhang J S,Ma C G.Protective effect of hyperin on cere-bral infarction in rats[J].Chin Pharm J,1998,23(10):626 - 8.
[5] 陈志武,马传庚,方 明.金丝桃苷对大鼠缺血性脑损伤中氧自由基和一氧化氮的作用[J].中国中药杂志,1999,24(7):431-3.
[5] Chen Z W,Ma C G,Fang M.Effects of hyperin on oxygen free radicals and nitric oxide in rat cerebral ischemic injury[J].Chin Pharm J,1999,24(7):431 -3.
[6] 彭国平,魏尔清,葛求富,李筱筱.金丝桃苷对离体缺氧/缺糖再灌注脑损伤的保护作用[J].中国药学杂志,2005,40(6):434-7.
[6] Peng G P,Wei E Q,Ge Q F,Li X X.Effects of hyperin on brain injury induced by oxygen-glucose deprivation/reperfusion in vitro[J].Chin Pharm J,2005,40(6):434 -7.
[7] 李 明,王峻峰,韩济生.应用Fura-2/AM检测分离的神经细胞内游离钙及其变化[J].药学学报,1991,26(12):890 -4.
[7] Li M,Wang J F,Han J S.Measurement of intracellular free Ca2+concentration in dissociated rat brain cells using Fura-2/AM[J].Acta Pharm Sin,1991,26(12):890 -4.
[8] 黄慧玲,武俏丽,王 辰,等.脑活素对液压冲击伤后原代神经细胞内游离钙的影响[J].中国药理学通报,2009,25(2):205-9.
[8] Huang H L,Wu Q L,Wang C,et al.Effects of cerebrolysin on intracellular calcium in primary cultured neurons after fluid percussion injury[J].Chin Pharmacol Bull,2009,25(2):205 -9.
[9] Dong L Y,Chen Z W,Guo Y,et al.Mechanisms of vitexin preconditioning effects on cultured neonatal rat cardiomyocytes with anoxia and reoxygenation[J].Am J Chin Med,2008,36(2):385 -97.
[10]吴 艳,万华印.葛根素对培养脑细胞缺氧/再给氧损伤的保护作用[J].中国药理学通报,2006,22(9):1130 -3.
[10]Wu Y,Wan H Y.Protective effect of puerarin on anoxia-reoxygenation induced cerebral cell injury in culture[J].Chin Pharmacol Bull,2006,22(9):1130 -3.
[11]张建华,陈志武,武 征.杜鹃花总黄酮预处理对大鼠心肌缺血再灌注损伤的延迟相保护作用[J].中国中医基础医学杂志,2007,13(3):192 -4.
[11]Zhang J H,Chen Z W,Wu Z.The late protection of total favones of rhododendra pharmacological preconditioning against myocardial ischemic/reperfusion injury in rats[J].Chin J Bas Med TCM,2007,13(3):192-4.
[12]Chen Z W,Ma C G.Effects of hyperin on free intracellular calcium in dissociated neonatal rat brain cells[J].Acta Pharmacol Sin,1999,20(1):27 -30.
[13]陈志武,马传庚.缺血性脑损伤与钙离子、氧自由基及一氧化氮关系[J].中国药学杂志,2002,37(11):803 -6.
[13]Chen Z W,Ma C G.Relation of ischemic cerebral injuries to calcium ion,oxygen free radicals and nitric oxide[J].Chin Pharm J,2002,37(11):803 -6.
[14]孙晓红,李子强,车玉琴,等.局灶缺血早期大鼠脑组织一氧化氮合酶表达的变化[J].中国老年学杂志,2009,29(5):529-31.
[14]Sun X H,Li Z Q,Che Y Q,et al.Changes of nitric oxide synthase gene expression in rat cerebral ischemia at early stage[J].Chin J Gerontol,2009,29(5):529 - 31.

