Snail增强乳腺癌细胞MCF-7中P-gp介导的多药耐药
刘传亮,王 辉,陈伟娟,王晓杰,李洪利,赵修世,李文通
乳腺癌是女性最常见的恶性肿瘤之一,在乳腺癌的综合治疗中,化疗占有十分重要的地位,然而临床上许多肿瘤患者在经历了数次有效的化疗后对化疗药物产生了多药耐药性(multidrug resistance,MDR)。在MDR的研究中发现,多药耐药的乳腺癌细胞株侵袭、转移能力与亲本细胞相比明显增强,近来研究表明耐药细胞在形态上发生了上皮-间质转化(epithelial-mesenchymal transformation,EMT)样改变[1],说明MDR与EMT间存在联系。在本实验中,我们将Snail真核表达载体转染乳腺癌细胞后,再对细胞用阿霉素进行诱导,以观察乳腺癌细胞EMT发生对P-糖蛋白(P-glucoprotein,P-gp)介导的MDR的影响。
1 材料与方法
1.1 主要试剂 MMLV cDNA试剂盒、PCR试剂盒、限制性内切酶、SYBR Real-time PCR试剂盒及Pfu DNA聚合酶购自大连宝生物公司;T/A克隆试剂盒购自上海生工生物工程技术服务有限公司;真核表达载体pCDNA3.1(-)及LipofectamineTM2000脂质体转染试剂盒购自Invitrogen公司;RNA提取试剂TRIzol购自北京索莱宝科技有限公司;P-gp抗体购自北京中杉金桥生物技术有限公司;MTT购自Sigma;阿霉素(adriamycin,ADM)购自江苏恒瑞医药股份有限公司;RPMI 1640培养基和胎牛血清(FCS)购自 Gibco。
1.2 方法
1.2.1 构建pCDNA3.1-Snail真核表达载体 从乳腺癌组织(潍坊市人民医院提供)中用TRIzol提取组织RNA,取2 μg逆转录成 cDNA,以此为模板用Pfu扩增 Snail基因(NM_005985.2),上游引物:5′-CCACTATGCCGCGCTCTTT-3′;下 游 引 物:5′-TCAG CGGGGACATCCTGAGCA-3′;PCR产物末端加 A后连接至T载体,构建成载体pUCm-T-Snail。连接产物转化大肠杆菌DH-5α后,进行蓝白斑筛选,Not I、BamH I做双酶切鉴定,阳性克隆测序鉴定,测序正确后采用Not I、BamH I进行双酶切;酶切产物连接到pCDNA3构建成pCDNA-Snail真核表达载体,并酶切鉴定。
1.2.2 细胞系的建立 人乳腺癌MCF-7细胞培养在含有10%胎牛血清的RPMI 1640培养基中,于37℃,5%CO2培养箱中持续培养。采用脂质体转染法转染载体,按说明书进行操作,G418进行快速筛选。采用阿霉素低浓度加量持续诱导法[2]诱导细胞,并分别命名为MCF-7/ADM100、MCF-7/snail-ADM100和 MCF-7/pCDNA-ADM100。
1.2.3 细胞毒性试验 取生长期细胞,配成1×107·L-1细胞悬液,接种于96孔板。24 h后加入含有0.1、0.4、1.6、6.4、25.4 mg·L-1阿霉素的培养液,培养48~72 h,弃上清,加 MTT。培养4 h,加入DMSO,测550 nm OD值。存活率按实验组与对照组吸收值之比×100%计算,取3次实验的均值作图求 IC50值[3]。
1.2.4 阿霉素外排实验 取生长期细胞,制备细胞悬液并转移到24孔板上;阿霉素诱导组加入含20 μmol·L-1阿霉素的培养基,对照组加入完全培养基培养,在37℃,5%CO2培养箱中孵育30 min后,用预冷的完全培养基冲洗,置于37℃,5%CO2培养箱中孵育1 h,用预冷的PBS冲洗,置于冰上;流式细胞仪(FACS Calibur)测定细胞488 nm的荧光强度。
1.2.5 细胞中P-gp的表达 收集生长期细胞,PBS洗两遍,用4%多聚甲醛固定40 min,PBS洗3次;加P-gp一抗,37℃孵育40 min,PBS冲洗2次;加FITC标记的IgG,4℃避光反应30 min,PBS冲洗3次,加300 ml PBS,用流式细胞仪检测。
1.2.6 Real-time PCR TRIzol法提取细胞中总RNA后,取2 μg使用MMLV逆转录酶逆转成 cDNA;Real-time PCR反应使用SYBR Green I检测,按说明书进行操作。PCR引物 (上海生工合成)序列如(Tab 1)所示。

Tab 1 The primer of Snail,MDR1 and β-actin
1.3 统计学处理 采用SPSS 17.0软件进行统计学分析,结果用¯±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析。
2 结果
2.1 pCDNA3.1-Snail真核表达载体的鉴定 通过RT-PCR可获得特异性Snail基因片段,长约799 bp(Fig 1A)。载体pUCm-T-Snail进行酶切鉴定,阳性克隆约在900 bp处见插入的Snail基因片段(Fig 1B)。阳性克隆测序后在Blast上进行比对(Fig 2)。
2.2 细胞毒性试验 MTT检测结果显示MCF-7/Snail-ADM100细胞耐药性高于MCF-7/ADM100细胞(P<0.05,Tab 2)。而且在同等药物浓度下,MCF-7/Snail-ADM100组细胞生存率高于其它各组(Fig 3)。
2.3 阿霉素外排实验 MCF-7、MCF-7/ADM100,MCF-7/pCDNA-ADM100和MCF-7/Snail-ADM100 4组细胞外排1 h后细胞内的阿霉素的荧光强度分别为196.3±18.97、50.8±6.33、48.3±4.98和7.1±0.85。MCF-7/Snail-ADM100细胞中药物浓度明显降低(P<0.05,Fig 4)。

Fig 1 A:Electrophoresis of Snail PCR amplification products;B:Enzyme digestion map of pUCm-T-Snail vector

Fig 2 Results of pUCm-T-Snail sequencing(From 9 bp to 834 bp)
Tab 2IC50value of cells to doxorubicin(±s,n=3)

Tab 2IC50value of cells to doxorubicin(±s,n=3)
*P<0.05 vs IC50value of MCF-7;#P<0.05 vs IC50value of MCF-7/ADM100;▲P<0.05 vs IC50value of MCF-7/pCDNA-ADM100
IC50values/mg·L-1RR MCF-7 0.03±0.015 1 MCF-7/ADM100 0.96±0.132* 32.1 MCF-7/pCDNA-DM100 0.95±0.098* 31.7 MCF-7/Snail-ADM100 32.76 ±4.531*#▲109.2
2.4 细胞中P-gp的表达 流式细胞术的结果显示,MCF-7、MCF-7/ADM100、MCF-7/pCDNA-ADM 100和MCF-7/Snail-ADM100 4组细胞上P-gp荧光强度分别为 5.7±0.48、78.3±8.33、77.5±7.97、91.6±9.42。与MCF-7/ADM100细胞相比MCF-7/Snail-ADM100细胞上P-gp荧光强度明显升高(P<0.05)。
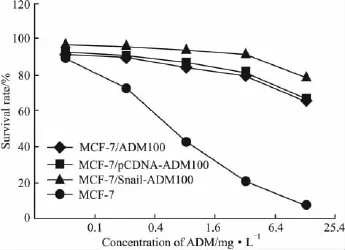
Fig 3 Survival rate of cell lines

Fig 4 The result of ADM efflux assy
2.5 MDR1,Snail在细胞中的表达 分别将MCF-7细胞中 MDR1,Snail的均作为 1,在 MCF-7/ADM100细胞中两种mRNA水平分别为20.42±2.45、34.48±4.31,MCF-7/pCDNA-ADM100 细胞两种mRNA水平分别为21.02±3.09、33.79±4.11,而在MCF-7/Snail-ADM100细胞中两种mRNA水平分别为130.2±15.76和112.2±13.27,较之其它细胞明显升高(P<0.05,Fig 5)。
3 讨论
MDR是指肿瘤细胞对一种化疗药物产生耐药性后,对结构和作用机制不同的抗肿瘤药物产生耐药性,与肿瘤化疗效果降低紧密相关[4];EMT是指上皮细胞失去极性,获得间质细胞表型的现象。在EMT发生过程中,细胞骨架重塑,细胞迁移能力增强,可引起肿瘤细胞的浸润和转移[5]。在多数肿瘤的进展过程中,均可出现MDR与EMT现象。近年来研究发现高表达 P-gp的多药耐药肿瘤细胞表现出较强的侵袭和转移能力[6]。采用阿霉素诱导MCF-7细胞在使细获得MDR的同时,也使细胞发生EMT样变化[1],这说明肿瘤细胞MDR与EMT之间可能存在一定的内在联系,但肿瘤细胞能否通过EMT产生MDR变化尚不清楚,国内外亦未见该方面相关报道。为能证明EMT的发生能导致和促进P-gp介导的MDR,我们进行了初步研究。
Massoumi等[7]研究表明,通过转染 Snail表达载体可使细胞获得EMT样组织学特征,而体外应用siRNA技术抑制Snail表达则观察到相反变化[8],这表明Snail可以在一定程度上反映肿瘤细胞的侵袭能力,是上皮性肿瘤EMT过程中的一个重要调节因素。因此,本实验将Snail真核表达载体pCDNA3.1-Snail转染人乳腺癌MCF-7细胞;对转染后的细胞采用阿霉素诱导。将诱导后的细胞进行细胞毒性实验,结果显示MCF-7/ADM100细胞和MCF-7/Snail-ADM100细胞的相对耐药指数分别为32.1和109.2,MCF-7/Snail-ADM100细胞耐药性明显升高;阿霉素外排实验显示MCF-7/Snail-ADM100细胞中药物浓度降至7.1,相对MCF-7/ADM100细胞明显降低,说明药物外排能力提高;两次试验结果与流式细胞术和Real-time PCR所显示的P-gp表达增多和MDR1 mRNA表达增多的结果相一致。实验结果表明Snail与P-gp的表达相关,因此,在肿瘤进展过程中两者的发生并不是一个孤立事件,它们之间可能存在密切联系。

Fig 5 The mRNA relative level of Snail and MDR1
Yan等[9]的研究表明通过激活PI3K/AKT信号转导通路,可导致细胞发生EMT变化;也有研究表明PI3K/AKT信号转导通路的激活能上调P-gp的表达,从而导致肿瘤发生MDR[10]。此外,在对信号传导通路的研究中还发现,激活MAPK通路也能导致细胞 EMT的变化和耐药的发生[11,12]。这说明EMT和MDR的发生过程可能存在多种共同的信号转导通路,这些信号通路在两者发生的机制中可能起到了某种作用。另外,低氧环境作为恶性肿瘤生长的必要环境和导致EMT的重要因素,同时也能上调 P-gp 的表达[13,14]。这进一步说明了 EMT 与MDR之间可能存在共同激活的机制。然而,EMT和MDR的发生机制复杂,两者相互作用的机制尚需进一步的研究。
[1] Li Q Q,Xu J D,Wang W J,et al.Twist1-mediated adriamycin-induced epithelial-mesenchymal transition relates to multidrug resistance and invasive potential in breast cancer cells[J].Clin Cancer Res,2009,15(8):2657 - 65.
[2] Uchiyama-Kokubu N,Watanabe T.Establishment and characterization of adriamycin-resistant human colorectal adenocarcinoma HCT-15 cell lines with multidrug resistance[J].Anticancer Drugs,2001,12(9):769 -79.
[3] 师以康,张胜华,黄云虹,等.乳腺癌细胞的HER2过表达降低其对紫杉醇的药物敏感性[J].中国药理学通报,2009,25(4):444-8.
[3] Shi Y K,Zhang S H,Huang Y H,et al.HER2 overexpression in breast cancer cells reduces the sensitivity to taxol[J].Chin Pharmacol Bull,2009,25(4):444 -8.
[4] 陈昌杰,刘臣彪,杨清玲,等.葡萄籽提取物通过抑制Survivin的表达而抑制乳腺癌MCF-7细胞的增殖[J].中国药理学通报,2009,25(7):955 -9.
[4] Chen C J,Liu C B,Yang Q L,et al.Grape seed extract inhibits proliferation of breast cancer cell MCF-7 through the inhibition of Survivin expression[J].Chin Pharmacol Bull,2009,25(7):955-9.
[5] Geiger T R,Peeper D S.Metastasis mechanisms[J].Biochim Biophys Acta,2009,1796(2):293 -308.
[6] Li L,Jiang A C,Dong P,et al.MDR1/P-gp and VEGF synergistically enhance the invasion of Hep-2 cells with multidrug resistance induced by taxol[J].Ann Surg Oncol,2009,16(5):1421 -8.
[7] Massoumi R,Kuphal S,Hellerbrand C,et al.Down-regulation of CYLD expression by Snail promotes tumor progression in malignant melanoma[J].J Exp Med,2009,206(1):221 -32.
[8] Zhuo W,Wang Y,Zhuo X,et al.Knockdown of Snail,a novel zinc finger transcription factor,via RNA interference increases A549 cell sensitivity to cisplatin via JNK/mitochondrial pathway[J].Lung Cancer,2008,62(1):8 -14.
[9] Yan W,Fu Y,Tian D,et al.PI3 kinase/Akt signaling mediates epithelial-mesenchymal transition in hypoxic hepatocellular carcinoma cells[J].Biochem Biophys Res Commun,2009,382(3):631 -6.
[10]Han Z,Hong L,Han Y,et al.Phospho Akt mediates multidrug resistance of gastric cancer cells through regulation of P-gp,Bcl-2 and Bax[J].J Exp Clin Cancer Res,2007,26(2):261 - 8.
[11]Davies M,Robinson M,Smith E,et al.Induction of an epithelial to mesenchymal transition in human immortal and malignant keratinocytes by TGF-beta1 involves MAPK,Smad and AP-1 signalling pathways[J].J Cell Biochem,2005,95(5):918 -31.
[12]Zhu H,Chen X P,Luo S F,et al.The role of extracellular signalregulated kinase/mitogen-activated protein kinase pathway in multidrug resistance of hepatocellular carcinoma[J].Chin J Surg,2007,45(13):917 -20.
[13]Sun S,Ning X,Zhang Y,et al.Hypoxia-inducible factor-1alpha induces Twist expression in tubular epithelial cells subjected to hypoxia,leading to epithelial-to-mesenchymal transition[J].Kidney Int,2009,75(12):1278 -87.
[14]Callaghan R,Crowley E,Potter S,et al.P-glycoprotein:so many ways to turn it on[J].J Clin Pharmacol,2008,48(3):365 - 78.

