降解黄曲霉毒素枯草芽孢杆菌的解毒性、抗菌性及抗逆性研究
雷元培 赵丽红 马秋刚 郑文革 高欣 计成
黄曲霉毒素(AFT)主要是由黄曲霉(Aspergillusflavus)和寄生曲霉(Aspergillus parasiticus)产生的具有强烈毒性的次级代谢产物[1]。现已发现18种结构衍生物,其中黄曲霉毒素B1毒性最大,其具有极强的致癌、致突变、致畸和免疫抑制性[2-3]。黄曲霉毒素广泛存在于玉米、花生粕等饲料原料中,严重威胁动物的生产性能,每年给饲料工业和畜牧业造成巨大的经济损失[4-5]。自1960年被发现以来,AFT已经受到广泛的重视,人们纷纷研究和采用各种方法来去除粮食和饲料中的AFT,其中包括各种物理、化学和微生物脱毒方法等[6-7]。然而,传统的物理和化学去除霉菌毒素的方法存在效果不稳定、营养成分损失大、影响饲料适口性且难以规模化生产等缺点而不能被广泛应用到实际生产中。微生物及生物酶解毒因具有解毒效率高、特异性强、对饲料和环境没有污染等特点和优势而备受研究者的重视[8-9]。
枯草芽孢杆菌(Bacillus subtilis)是一种嗜温性好氧产芽孢革兰氏阳性细菌,对人畜无毒、无害,不污染环境,具有广谱抗菌活性和极强的抗逆能力,能分泌多种抗生素和酶。枯草芽孢杆菌的商品制剂是国际公认的可直接饲喂动物的、安全级(GRAS)微生物制品,对动物饲料酶制剂的开发有很好的应用前景。鉴于芽孢杆菌诸多功能特性,我们尝试了从不同种类芽孢杆菌中筛选对黄曲霉毒素有降解活性的菌株,从35株实验室分离并保藏的芽孢杆菌中得到一株对黄曲霉毒素有高效降解活性的菌,其发酵液对AFB1、AFG1和AFM1的降解率分别可达到81%、78%和63%。经16S rDNA鉴定为枯草芽孢杆菌(Bacillus subtilis),根据其功能特性命名为霉立解060菌。本试验对筛选得到的能够高效降解黄曲霉毒素B1、G1和M1的霉立解060菌的解毒活性、抗菌活性及抗逆性进行研究,为将该株具有多功能特性的枯草芽孢杆菌应用到动物实际生产中提供理论支持。
1 材料与方法
1.1 试验菌株
霉立解060菌,经鉴定为枯草芽孢杆菌(Bacillus Subtilis),本实验室从动物肠道分离得到并保藏,该株菌已经保藏在中国普通微生物菌种保藏管理中心(CGMCC),保藏号为CGMCC NO.3440。同时,该株菌已申请国家发明专利并获授权(专利号:ZL 200910242938.3)。
沙门氏菌(Salmonella Typhimurium)、大肠杆菌(Escherichia Coli)、金黄色葡萄球菌(Staphylococcus Aureus),本实验室保藏,作为试验用指示菌。
枯草菌619(对黄曲霉毒素没有降解作用的另一株枯草芽孢杆菌),本实验室保藏,用于抑菌性和抗逆性对比试验。
1.2 试验试剂与设备
黄曲霉毒素 B1、G1、M1购于 Sigma 公司;LB 培养基(1000 ml):胰蛋白胨 10 g、酵母浸粉 5 g、NaCl 10 g,pH 值 7.0~7.2,蛋白酶 K。
1.3 试验方法
1.3.1 霉立解060菌降解黄曲霉毒素活性组分的确定
采用50 ml/250 ml装液量的LB培养基对霉立解060菌进行接种,在37℃、200 r/min条件下摇瓶培养24 h制得霉立解060菌发酵液。取5 ml发酵液,4℃离心20 min(8000 r/min),分离上清液与菌体,上清液于4℃备用;离心后的菌体用蒸馏水洗涤,再离心,取菌体加入5 ml蒸馏水制得菌悬液备用;以同样的方法再制备一份菌体,对菌体进行破碎,然后溶于5 ml蒸馏水制成胞内液,备用。
对制得的等量的发酵液、上清液、菌悬液及胞内液对黄曲霉毒素B1、G1和M1的降解活性进行测定。取800 μl霉立解060菌发酵液,加入200 μl黄曲霉毒素B1(500 μg/kg),在37℃黑暗的培养箱中反应72 h;以等量的LB培养基加黄曲霉毒素B1为对照组;以同样的方法向霉立解060菌发酵液中分别加入AFG1和AFM1进行解毒反应试验,用HPLC及柱后光化学衍生的方法分别对AFB1、AFG1和AFM1的降解率进行测定。
1.3.2 霉立解060菌发酵液活性组分性质的研究
对霉立解060菌发酵上清液分别进行热处理(100℃加热10 min)和蛋白酶K处理(0.01 g/ml蛋白酶K与发酵上清液反应2 h)。按上述方法进行解毒反应试验,研究解毒活性物质的性质。
1.3.3 黄曲霉毒素含量测定
黄曲霉毒素含量测定可分为3个步骤:萃取、净化、检测。首先使用甲醇:水(6:4)溶液对其进行萃取,然后使用免疫亲和柱对样品残留毒素进行净化提取(方法参照免疫亲和柱使用说明书);最后用HPLC(柱后光化学衍生)对净化提取得到的样品进行检测。
首先,应当制定促进科技发展方面的立法。比如,我国制定《科技促进法》、《科技人才促进法》等促进科技发展的法律,为科技发展提供制度环境。其次,应当完善已有的科技相关法律。比如,应当从促进科技发展的角度出发,完善《著作权法》、《专利法》、《商标法》、《网络安全法》等,为科技创新保驾护航,同时维护科研人员的智慧成果,激发其创新的积极性。最后,制定和完善规范科技运行的法律。比如,我国可以制定《科技伦理法》,对科技工作者和科学研究活动提出伦理性要求,禁止他们从事有违社会伦理道德的科研活动。另外,还可以制定法律禁止科学研究用于违法的行为。
HPLC检测条件为流动相甲醇:水=1:1;流速 1 ml/min;色谱柱 C18150 mm×4.6 mm,0.5 μm;激发波长360 nm,检测波长440 nm;进样量 20 μl。
AFB1降解率(%)=[(对照组AFB1含量-处理组AFB1含量)/对照组 AFB1含量]×100。
AFG1和AFM1与AFB1降解率的检测方法相同。
1.4 霉立解060菌的抗菌性与抗逆性试验
1.4.1 抗菌性试验
指示菌悬液制备时,用接种针从斜面上挑取少量的指示菌,分别接种到营养肉汤培养基中,37℃培养24 h,调节菌悬液的浓度为109CFU/ml左右。
采用平板扩散的方法(Lyver等,1998;林东等,2001)[10-11],将霉立解060菌或枯草菌619用接种棒取少许分别点种到倒好的营养琼脂平板中央,37℃培养24 h,然后把平板倒扣于盛一薄层氯仿的培养皿盖上并熏蒸约30 min,以便杀死活细胞并能让菌落固定于平板的表面,然后移去培养皿盖并让平板里的残余氯仿彻底挥发20 min。在平板表面铺一层刚培养好的指示菌培养液,均匀布满后倾倒出剩余的菌液,晾干平板,置平板于37℃培养24 h,观察点种的芽孢杆菌周围抗菌圈的大小和清晰程度来判断受试菌对指示菌的抗菌能力。
1.4.2 抗逆性试验
芽孢悬液的制备方法:将霉立解060菌或枯草菌619培养液置于80℃水浴保温15 min,离心收集芽孢,菌体用磷酸缓冲液洗涤两次,最后复溶在缓冲液中即为芽孢悬液。
加热处理试验:分别取保存好的霉立解060菌或枯草菌619菌液5 ml注入到离心管中,采用分级稀释,平板涂布。再将装有剩余菌液的离心管置于80℃水浴锅中加热15 min,取加热后的菌液进行逐级稀释,平板涂布。最后将加热前和加热后的平板均在37℃条件下培养24 h,计算两株芽孢杆菌加热前后的活菌数。
模拟胃液的耐受性试验:模拟胃液的制备借鉴Huang等(2004)[12]的方法。取0.5 ml的菌液加入4.5 ml的模拟胃液中,并迅速在振荡器上充分混和,然后置于37℃培养箱静置培养。分别在0、2和4 h的时候取出培养液并立即计数残存芽孢的活菌数。
模拟胆盐的耐受试验:模拟胆盐的制备借鉴Huang等(2004)[12]的方法。取0.5 ml的菌液加入4.5 ml的模拟胆盐中,并迅速在振荡器上充分混和,然后置于37℃培养箱静置培养。分别在0、24 h的时候取出培养液并立即计数残存芽孢的活菌数。
芽孢总数的测定:样品用无菌生理盐水10倍梯度稀释,选择合适的稀释梯度用于计数。采用营养琼脂培养基,取0.5 ml稀释液涂布在平板上,在37℃培养24 h。
2 结果与分析
2.1 霉立解 060菌发酵上清液对 AFB1、AFG1和AFM1有较高的降解活性(见图1)

图1 霉立解060菌发酵液不同组分对黄曲霉毒素B1、G1和M1的降解率
由图1可知,霉立解060菌发酵上清液对AFB1、AFG1和AFM1的降解活性最高,分别为73%、71%和59%;而菌悬液和胞内液对黄曲霉毒素B1、G1和M1的降解率不高,仅在10%左右。因此,初步认为霉立解060菌对黄曲霉毒素降解的活性物质是一种胞外分泌物,主要存在于其发酵后的上清液中。
2.2 热处理和蛋白酶K处理后霉立解060菌上清液对 AFB1、AFG1和 AFM1降解活性(见图 2)

图2 霉立解060菌发酵后的上清液热处理和蛋白酶K处理后对AFB1、AFG1和AFM1的降解率
由图2可知,霉立解060菌发酵后的上清液经热处理和蛋白酶K处理后其对黄曲霉毒素的降解率显著降低,发酵后的上清液经热处理后对AFB1、AFG1和AFM1的降解率分别降低为20%、15%和17%,经蛋白酶K处理后分别降低为34%、28%和19%。因此,可初步判断霉立解060菌对黄曲霉毒素的降解活性物质是一种细胞所产胞外酶。
2.3 霉立解060菌抑菌性测定(见表1)

表1 霉立解060菌对大肠杆菌、鸡白痢沙门氏菌、金黄色葡萄球菌的抑菌活性
由表1可知,霉立解060菌对大肠杆菌有显著的抑制活性,其抑菌圈直径为0.98 cm,而枯草菌619对大肠杆菌没有抑制作用,抑菌圈直径为0;尽管枯草菌619对鸡白痢沙门氏菌和金黄色葡萄球菌抑菌圈直径比霉立解060菌的大,但由于其没有抑制大肠杆菌的活性,因此,霉立解060菌是一株对多种有害菌有抑制作用、抑菌性强的有益微生物。
2.4 霉立解060菌抗逆性测定
模拟胃液对霉立解060菌活性的影响见表2。由表2可知,在模拟胃液条件下,霉立解060菌活菌数比枯草菌619活菌数高;与0 h活菌数相比,霉立解060菌经2 h和4 h模拟胃液处理后活菌数没有显著变化,活菌数仍达到98.83%和97.95%,说明霉立解060菌对胃酸具有很强的耐受性。

表2 模拟胃液对霉立解060菌活性的影响
模拟胆盐对霉立解060菌耐受性的影响见表3。由表3可知,在模拟胆盐的条件下,霉立解060菌0 h和24 h的活菌数没有显著变化(P>0.05),模拟胆盐处理24 h后其活菌数仍然能达到96.03%;而枯草菌619经胆盐处理24 h后活菌数为0,对胆盐没有耐受能力,进一步说明霉立解060菌是一株对胆盐具有很好耐受性的菌。

表3 霉立解060菌对胆盐耐受性试验结果
霉立解060菌对高温耐受性试验的研究结果见表4。由表4可知,霉立解060菌在80℃加热15 min后活菌数没有变化(P>0.05),其活菌数仍能达到98.69%;枯草菌619在经过80℃加热后,活菌数为0,结果表明,霉立解060菌对80℃高温具有很好的耐受性,适合作为动物用饲料添加剂。
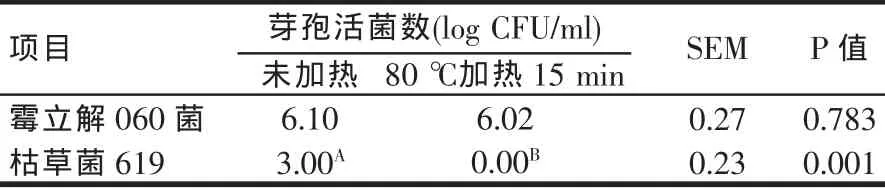
表4 霉立解060菌对高温耐受性试验结果
3 讨论
霉立解060菌是课题组从动物肠道分离得到的,进一步研究表明,该株枯草芽孢杆菌对黄曲霉毒素降解的活性组分存在于发酵上清液中,菌悬液和胞内液对黄曲霉毒素的降解率很低。发酵上清液经热处理和蛋白酶K处理后对黄曲霉毒素的降解率显著降低,初步认为霉立解060菌对黄曲霉毒素的解毒活性物质是一种细胞所产胞外酶。众所周知,枯草芽孢杆菌酶是工业酶市场的主体,其生产的蛋白酶、淀粉酶是工业酶中应用最为广泛的酶,仅这两种酶就占了整个工业酶市场的50%[13]。目前报道的能够降解黄曲霉毒素的细菌不多,有橙色黄杆菌(Flavobacterium aurantiacum)[14]、分支杆菌(Mycobacterium fluoranthenivorans)[15]、红串红球菌(Rhodococcus erythropolis)[16]及橙红色粘球菌(Myxococcus fulvus)[17]等。这些菌如果要应用到动物生产中还需要对其做进一步的安全性评价,而枯草芽孢杆菌是农业部允许直接添加到动物饲料中的有益微生物,因此芽孢杆菌霉立解060菌及其所产的毒素降解酶具有非常大的应用价值和广阔的应用前景。
为进一步研究霉立解060菌的抑菌特性和抗逆活性,将该株菌应用到动物实际生产中,尽可能地发挥该菌的功能特性,我们对霉立解060菌和另外一株对黄曲霉毒素没有降解作用的枯草芽孢杆菌进行对比试验研究。动物肠道环境复杂,肠道菌群多样性变化,除附殖有益微生物(乳酸菌、芽孢杆菌、肠球菌)外,还包含有害微生物,如大肠杆菌、鸡白痢沙门氏菌、金黄色葡萄球菌等,进入动物肠道的有益微生物若能较好的发挥其功能,必须要抵抗各种不利因素,包括抵抗有害菌的抑制作用。通过以这三株菌为指示菌,以另外一株对黄曲霉毒素没有解毒活性的枯草菌619做对比,研究了霉立解060菌的抑菌活性,结果表明,霉立解060菌对大肠杆菌、鸡白痢沙门氏菌和金黄色葡萄球菌有较好的抑菌活性,可以抵抗动物肠道有害菌的不利影响而发挥正常的生理功能。试验结果还表明,并不是所有的枯草芽孢杆菌都对多种有害菌同时具有抑菌活性。
目前,有益微生物均以口服方式饲喂动物,因此,它们必须首先具备耐受胃的低pH值的能力才可能进入动物肠道存活、繁殖,发挥其作用。除应具备耐胃低pH值能力外,还需具备耐受小肠中胆盐等形成的高渗透压环境的能力。枯草芽孢杆菌等益生菌株在菌液浓缩或制作膨化颗粒料时,都要进行加热处理,对高温的耐受性也成为选择有益微生物的必备条件[18]。因此,试验对霉立解060菌株进行了模拟胃液、胆盐及热耐受试验。结果表明,与另外一株对黄曲霉毒素没有解毒活性的枯草芽孢杆菌相比,霉立解060菌除具有降解黄曲霉毒素的特性外,还能显著抑制动物肠道有害菌的繁殖,同时抵抗胃酸、胆盐、高温等不利环境而正常生长。因此,霉立解060菌具备良好的开发前景和应用价值。
4 结论
课题组从动物肠道分离筛选到的枯草芽孢杆菌(霉立解060菌)对黄曲霉毒素B1、G1和M1具有较高的降解活性;初步试验证明,解毒活性物质是该菌分泌的一种胞外蛋白酶;同时,霉立解060菌具有很好的抑菌活性和抗逆性,非常适合用于动物饲料微生态制剂的开发和应用。
[1]Cotty P J,Bhatnagar D.Variability among atoxigenic Aspergillus flavus strains in ability to prevent aflatoxin contamination and production of aflatoxin biosynthetic pathway enzymes[J].Applied and Environmental Microbiology,1994,60(7):2248-2251.
[2]Alberts J F,Engelbrecht Y,Steyn P S,et al.Biological degradation of aflatoxin B1 by Rhodococcus erythropolis cultures[J].International Journal of Food Microbiology,2006,109(1/2):121-126.
[3]Pitt J I,Basilico J C,Abarca M L,et al.Mycotoxins and toxigenic fungi[J].Medical Mycology,2000,38(SUPPL.1):41-46.
[4]Massey T E,Stewart R K,Daniels J M,et al.Biochemical and molecular aspects of mammalian susceptibility to aflatoxin B1 carcinogenicity[J].Proceedings of the Society for Experimental Biology and Medicine,1995,208(3):213-227.
[5]计成.霉菌毒素与饲料食品安全[M].北京:化学工业出版社,2007.
[6]王宁,马秋刚,张建云,等.黄曲霉毒素的传统去毒方法和生物降解研究进展[J].饲料与畜牧,2008(7):18-20.
[7]Desheng Q,Fan L,Yanhu Y,et al.Adsorption of aflatoxin B1 on montmorillonite[J].Poultry Science,2005,84(6):959-961.
[8]Kabak B,Dobson A D W,Var I.Strategies to prevent mycotoxin contamination of food and animal feed:A review[J].Critical Reviews in Food Science and Nutrition,2006,46(8):593-619.
[9]Schatzmayr G,Zehner F,T Ubel M,et al.Microbiologicals for deactivating mycotoxins[J].Molecular Nutrition and Food Research,2006,50(6):543-551.
[10]Lyver A,Smith J P,Austin J,et al.Competitive inhibition of Clostridium botulinum type E by Bacillus species in a valueadded seafood product packaged under a modified atmosphere[J].Food Research International,1998,31(4):311-319.
[11]林东,徐庆,刘忆舟,等.枯草芽孢杆菌SO113分泌蛋白的抑菌作用及抗菌蛋白的分离纯化 [J].农业生物技术学报,2001,9(1):77-80.
[12]Huang Y,Adams M C.In vitro assessment of the upper gastrointestinal tolerance of potential probiotic dairy propionibacteria[J].International Journal of Food Microbiology,2004,91(3):253-260.
[13]Schallmey M,Singh A,Ward O P.Developments in the use of Bacillus species for industrial production[J].Canadian Journal of Microbiology,2004,50(1):1-17.
[14]Ciegler A,Lillehoj E B,Peterson R E,et al.Microbial detoxification of aflatoxin[J].Applied Microbiology,1966,14:934-939.
[15]Hormisch D,Brost I,Kohring G W,et al.Mycobacterium fluoranthenivorans sp.nov.,a fluoranthene and aflatoxin B1 degrading bacterium from contaminated soil of a former coal gas plant[J].Systematic and Applied Microbiology,2004,27(6):653-660.
[16]Teniola O D,Addo P A,Brost I M,et al.Degradation of aflatoxin B1 by cell-free extracts of Rhodococcus erythropolis and Mycobacterium fluoranthenivorans sp.nov.DSM44556T[J].International Journal of Food Microbiology,2005,105(2):111-117.
[17]Zhao L H,Guan S,Gao X,et al.Preparation,purification and characteristics of an aflatoxin degradation enzyme from Myxococcus fulvus ANSM068 [J].Journal of Applied Microbiology,2011,110(1):147-155.
[18]刘虹,姚文,于卓腾,等.一组鸡源乳酸菌产乳酸及其耐受特性研究[J].微生物学通报,2006(5):1-5.

