2006年至2010年山东省鸡传染性支气管炎病毒分子变异的研究
任海松,张秀美,胡北侠,许传田,杨少华,朱雯迎,李建亮,崔言顺*
(1.山东农业大学动物科技学院,山东泰安271018;2.山东农科院畜牧兽医研究所山东省畜禽疫病防治与繁育重点实验室,山东济南250100)
鸡传染性支气管炎(Avian infectious bronchitis,IB)是由IB病毒(IBV)引起鸡的一种急性、高度接触性、传染性呼吸道疾病。IBV基因组为单股正链RNA,长约27.6kb。该病毒含有3种主要结构蛋白:即纤突蛋白(S)、膜蛋白(M)和核衣壳蛋白(N)。S蛋白位于IBV粒子的表面,由S1和S2两个亚单位组成,其中S1基因是IBV基因组中最容易发生变异的基因,而S1蛋白是血清中和抗体的主要诱导者,是决定IBV血清型特异性的主要蛋白。N蛋白在病毒的组装和复制过程中发挥重要作用,并且N蛋白是重要的免疫原,在刺激机体的细胞免疫和体液免疫中起重要作用。M蛋白与病毒的复制有关,控制并介导病毒粒子从内质网膜出芽,在病毒装配期间将核衣壳连接到囊膜上,在有补体存在的情况下可以中和病毒的感染。此外,M蛋白还与抗感染、诱导白细胞产生干扰素等有关。
本研究2006年~2010年从山东省发病鸡群中分离鉴定了17个IBV流行株,通过对S1基因、N基因和M基因序列测定和分析,探讨山东省IBV分子特征和遗传变异规律,为IB的防控提供依据。
1 材料和方法
1.1 病毒株及鸡胚 17个IBV分离株均为本实验室从山东省不同地区发病鸡群采集的病料中分离获得,通过鸡胚传代保存,并采用鸡胚矮小化试验、新城疫干扰试验等方法鉴定。各分离株背景资料及基因序列的GenBank登录号见表1。

表1 山东IBV分离株及其S1、N和M基因GenBank登录号Table 1Seventeen IBV strains isolated from commercial flocks in Shandong province of China
1.2 引物、菌种、质粒和试剂 S1、N和M基因引物序列参考文献[1]和[2],由上海生工生物工程技术服务有限公司合成;pEASY-T1载体购自北京全式金生物技术有限公司;PrimeScriptTMOne Step RT-PCR Kit、TRIzol和Gel Ext raction Kit均购自宝生物工程(大连)有限公司;DH5α菌种为本实验室保存。
1.3 病毒增殖及RNA的提取 将IBV分离株分别接种9日龄~11日龄SPF鸡胚,37℃培养72h(弃去24h内死亡的鸡胚),无菌收集尿囊液,离心,按TRIzol试剂说明书提取病毒基因组RNA。
1.4 IBV分离株S1、N和M基因的扩增、克隆与鉴定 应用RT-PCR方法,扩增17株IBV分离株S1基因和N基因。回收PCR产物并与pMD18-T载体连接,转化大肠杆菌DH5α感受态细胞。经菌液PCR初步鉴定后,由北京六和华大基因科技股份有限公司测序。
1.5 S1、N和M基因核苷酸序列的比较分析 利用Lasergene7.0软件,将17个IBV分离株S1、N和M基因分别与GenBank中IBV参考株的S1、N和M基因核苷酸序列及推导的氨基酸序列进行同源性比较和系统进化分析。
2 结 果
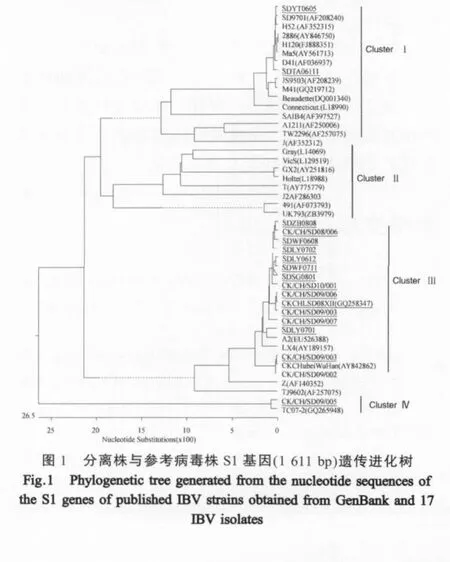
2.1 S1基因序列及遗传进化分析 17个IBV分离株S1基因序列分析结果表明:其中14个分离株S1基因的ORF长度为1620bp,分别编码540个氨基酸(包括蛋白酶裂解位点);分离株SDTA06111和SDYT0605S1基因ORF长度为1611bp,编码537个氨基酸;CK/CH/SD09/005株S1基因ORF长度为1640bp,编码546个氨基酸;17个分离株间S1基因核苷酸序列及其推导的氨基酸序列的同源性分别为58.2%~98.9%和67.1%~99.8%。与参考病毒株核苷酸序列以及推导的氨基酸序列的同源性分别为56.6%~99.1%和64.0%~99.8%。
根据S1基因核苷酸序列绘制的遗传进化树显示:17个分离株和25个参考病毒株共形成4个进化群。SDYT0605和SDTA06111株与 H120、MA5和T株等参考病毒株形成基因Ⅰ群。第Ⅱ基因群以491为代表,包括UK793和Gray等分离株。14个分离株与国内近年来分离的参考株形成以LX4(AY189157)为代表的第Ⅲ基因群。其中分离株CK/CH/SD09/005和参考株TC07-2形成独立的第Ⅳ基因群(图1)。以我国常用疫苗株H120为参考,17个分离株S1基因存在广泛的基因突变和氨基酸替代现象,除与H120处于同一基因群的SDYT0605和SDTA06111外,15个分离株在24(A/D)和122位~123位(GS/DS/GI)位共插入3个氨基酸,其中分离株 CK/CH/SD09/005还在 96(R)、141(D)和 289位~292位(QKER)位共插入6个氨基酸(图略)。
2.2 N基因序列及遗传进化分析 17个分离株的N基因均扩增出目的片段,测序结果均为1230bp,编码409个氨基酸。其核苷酸及推导氨基酸序列的同源性分别为85.9%~99.5%和85.9%~99.8%;分离株与参考株核苷酸及推导氨基酸的同源性分别为83.8%~98.9%和86.3%~98.9%。与我国常用疫苗株H120进行比较显示,17个分离株的N基因序列均无碱基的缺失和插入现象,但存在点突变和氨基酸的替代。
根据N基因绘制的遗传进化树显示,分离株与17个参考株形成2个进化群。其中14个分离株属于以LX4为代表的基因Ⅰ群,SDYT0605、SDWF0608和CK/CH/SD09/0053个分离株与H120等参考株属于基因Ⅱ群(图2)。

2.3 M基因序列及遗传进化分析 17个分离株M基因测序结果显示:分离株CK/CH/SD09/005的M基因片段长度为681bp,编码226个氨基酸;剩余16个分离株的M基因片段长度均为678bp,编码225个氨基酸。分离株与参考株核苷酸和氨基酸同源性分别为87.5%~98.2%和88.5%~98.2%。多数分离株之间同源性较高,其中SDWF0711、SDZB0808、CK/CH/SD09/003与 CK/CK/SD09/006以及CK/CH/SD09/002与CK/CH/SD10/001核苷酸同源性分别为100%。以疫苗株H120为参考株,对其M基因推导的氨基酸序列分析表明,除分离株CK/CH/SD09/005插入了一个氨基酸外,多数分离株仅存在少数氨基酸的替代现象,并且多数替代发生在转录起始后的前100个氨基酸内。
根据M基因核苷酸序列绘制的遗传进化树显示:17个分离株和14个参考株形成4个进化群;其中,15个分离株和参考株形成以LX4为代表的基因Ⅰ群;基因Ⅱ群由Gray、Connecticut和GX2-98等参考株组成;分离株SDYT0605与疫苗株H120等组成基因Ⅲ群;分离株CK/CH/SD09/005独自构成一个分支(图3)。

3 讨论
由于IBV基因组核苷酸的高突变率和变异机制,导致新的血清型和变异株不断出现,目前为止IBV存在20多个血清型,并且各血清型之间缺乏或者无交叉保护[3-5],给IB的防制造成困难,也导致IB在免疫鸡群中不断爆发。因此,对IB流行株分子变异规律进行研究,选择合适的疫苗株,对防止IB的爆发具有重要的作用。
S1是病毒的主要免疫原蛋白,S1基因在高变区内的点突变和适应性进化是IBV抗原性变异的主要原因。研究表明,与IBV中和抗体产生有关的5个抗原位点分别位于S1蛋白的24位~61位、132位~149位和291位~398位氨基酸区域[6-8];S1基因序列比对显示:与疫苗株H120相比,除2006年的两个分离株(SDTA06111、SDYT0605)与疫苗株H120氨基酸同源性较高(98.8%和99.5%)外,其他分离株在上述3个抗原区域存在广泛的基因突变以及氨基酸替代和插入现象。在抗原表位区如此多的变异很可能引起病毒抗原性和血清型的改变,导致疫苗免疫失败。相对于S1基因,N基因和M基因相对保守。N基因主要以广泛的点突变为主,无核苷酸的插入和缺失,这与路希山[1]报道一致。分离株M基因与参考株之间的同源性较高,部分分离株之间M蛋白氨基酸的同源性高达100%,在一定程度上表明它们可能具有相同的来源。
综合S1、N和M基因的遗传进化分析结果表明:2006年分离的4个分离株中有3个分离株(SDYT0605、DYT06111和 SDWF0608)的 S1基因、N基因或M基因与H120等疫苗株遗传关系较近,属同一个进化分支;2007年~2010年分离的病毒株多数3种基因在进化关系上平行,与国内分离株LX4同属一个基因群,而与疫苗株关系较远。可见2006年~2010年间,IBV在山东省流行趋势发生了变化:2006年期间,疫苗株H120的基因变异株可能是山东省主要的流行株;而2007年~2010年,以LX4为代表的流行株则是山东省IBV流行的优势基因型。
在疫苗的长期免疫压力下,山东省IBV一直在通过基因突变、插入、缺失以及基因重组不断产生新的变异株或血清型[9-11]。因此,在对IBV流行株进行及时监测的同时,完善养殖场的各项生物安全措施对于IB的科学防控具有重要意义。
[1]路希山,胡北侠,黄艳艳,等.2006-2008年山东鸡传染性支气管炎病毒分离株S1与N基因的分子特征[J].畜牧兽医学报,2009,40(6):879-885.
[2]时莉,肖朝庭,张秀美,等.我国部分地区1996-2008年传染性支气管炎病毒分离株膜蛋白基因的遗传变异与系统进化分析[J].中国动物传染病学报,2009,17(2):31-37.
[3]Hofstad M S.Cross immunity in chickens using seven isolates of avian infectious bronchitis virus[J].Avian Dis,1981,25:650-654.
[4]Lambrechts C,Pensaert M,Ducatelle R.Challenge experiments to evaluate cross-protection induced at the trachea and kidney level by vaccine strains and Belgian Nephropathogenic isolates of avian infectious bronchitis virus[J].Avian Pathol,1993,22:577-590.
[5]Cavanagh D.Coronavirus avian infectious bronchitis virus[J].Vet Res,2007,38:281-297.
[6]Kant A,Koch G,van Roozelaar D J,et al.Location of antigenic sites defined by neutralising monoclonal antibodies on S1avian infectious bronchitis virus glycopolypeptide[J].JGen Virol,1992,73:591-596.
[7]Koch G,Kant A,Cook J K A,et al.Epitopes of neutralising antibodies are locaised w ithin three regions of the S1spike protein of infectious bronchitis virus[C].In:Proc Second International Symposium on Infectious Bronchitis,World Veterinary Poultry Association,Rauischholzhausen,1991:154-160.
[8]Moore K M,Jackwood M W,Hilt D A.Identification of amino acids involved in a serotype and netralisation specific epitope within the S1subunit of avian infectious bronchitis virus[J].Arch Virol,1997,142:2249-2256.
[9]Dolz R,Pujols J,Ordonez G,et al.Molecular epidem iology and evolution of avian infectious bronchitis virus in Spain over a fourteen-year period[J].Virology,2008,374:50-59.
[10]Liu SW,Zhang Q X,Chen JD,et al.Genetic diversity of avian infectious bronchitis coronavirus strains isolated in China between 1995and 2004[J].Arch Virol,2006,151:1133-1148.
[11]Kuo Shu-ming,Wang Ching-ho,Hou M ing-hon,et al.Evolution of infectious bronchitis virus in Taiwan:characterisation of RNA recombination in the nucleocapsid gene[J].Vet M icrobiol,2010,144(3-4):293-302.

