大肠杆菌O111∶B4内毒素对大鼠肝脏Fas蛋白表达的影响
李 勇,高 洪,严玉霖,杨桂梅,彭 洁,孔令青,刘海峰
(1.云南农业大学动物科学技术学院,云南昆明650201;2.云南省药物研究所GLP中心,云南昆明650111;3.昆明医学院,云南昆明650031;4.云南农业职业技术学院,云南昆明650212)
内毒素(Endotoxin,ET)是革兰氏阴性细菌(Gram negative bacteria,GNB)细胞壁外膜的组成成分,其化学本质为脂多糖(LPS),它作为GNB的主要致病因子,在GNB感染中发挥着重要作用,常造成人畜ET血症和ET休克,严重危害人畜健康。肝脏既是清除ET的场所,同时又是ET血症、休克过程中最易受损的器官之一[1]。近年来研究表明,细胞凋亡与肝损伤有着密切的联系,在许多肝脏疾病中均有细胞凋亡的发生,它往往通过直接或间接的途径造成肝脏损伤。Fas/FasL系统是目前研究较为深入的一类与凋亡有关的基因系统,而由Fas基因表达的Fas蛋白是一种促凋亡蛋白[2-4]。大量研究表明,Fas/FasL途径是肝细胞的主要凋亡路径[5-8]。而肝细胞凋亡是造成肝损伤的原因之一,Erwei等[9]利用RNA干扰(RNAi)技术,使Fas蛋白表达沉默,凋亡减少,保护肝细胞免受细胞毒性作用,从而避免肝脏受损。而ET能够有效地促进肝细胞凋亡,从而造成肝损伤[10-11]。但在此过程中,ET对大鼠肝细胞Fas蛋白表达的影响尚未见报道。本实验通过建立ET致大鼠肝脏损伤模型,应用western blot和流式细胞术(FCM),探讨ET对大鼠肝细胞Fas蛋白表达的影响。
1 材料和方法
1.1 主要试剂、实验动物与仪器 大肠杆菌O111∶B4内毒素(L2630)购自美国Sigma公司;Fas兔多克隆 抗 体(BA0484)、HRP-羊 抗 兔 IgG(BA1054)、β-Actin鼠单克隆抗体(BM 0627)、HRP-羊抗鼠IgG(BA1050)均购自武汉博士德生物公司;异硫氰酸荧光素(FITC)-羊抗兔IgG(ZF-0311)、浓缩型DAB试剂盒(ZLI9017)均购自北京中杉金桥生物技术有限公司;NC膜购自美国M illipore公司;SD大鼠由昆明医学院实验动物科提供;FACS Vantage SE流式细胞仪为美国Becton Dickinson公司产品;超速冷冻离心机为美国Beckman Coulter公司产品;DYCZ-24DN型垂直电泳槽和DYCZ-40D转移槽均为北京六一仪器厂产品。
1.2 动物分组、处理与样品制备 48只实验用SD大鼠,体质量140g~160g,雌(无孕)雄不限。临床检查确认健康后,预饲养3d,自由饮水,随机分为2组:第Ⅰ组为试验组(n=24),按5mg/kg剂量尾静脉注射ET(1mg/m L);第Ⅱ组为对照组(n=24),按5m L/kg剂量尾静脉注射无热源生理盐水;两组大鼠分别于3h、4h、8h和12h各迫杀6只,采集肝脏。一部分用于Fas蛋白的western blot检测;另一部分用于Fas蛋白的FCM检测。
1.3 肝脏Fas蛋白的western blot检测 组织经研磨离心后,获得蛋白样品,取适量进行SDS-PAGE电泳,而后转印至NC膜进行western blot检测,一抗为Fas蛋白兔多克隆抗体(1∶300),二抗为HRP-羊抗兔 IgG(1∶300), DAB显色,利用 Quantity one 4.6.2软件扫描分析条带灰度值,与内参条带灰度值之比作为结果。
1.4 肝脏Fas蛋白的FCM检测 取适量肝脏组织于200目尼龙筛搓取,将滤液于2000r/min离心5min,清洗两次;加入4%多聚甲醛,室温固定15m in后1800r/min离心5min去上清,清洗;分别加入1∶100稀释的Fas兔多克隆抗体和1∶50稀释的FITC-羊抗兔IgG各避光37℃水浴孵育40m in,并清洗;最后加入冷PBS重悬细胞,调整细胞浓度为 2×106/m L~5×106/m L。取 0.3m L细胞悬液于FACS Vantage SE流式细胞仪,采用Cell quest软件获取细胞并进行测定,以W inMDI2.9软件分析并经计算机处理得出蛋白的表达率。
1.5 统计与分析 各组数据以平均值(X)±标准差(SD)表示,组间差异采取显著性t检验分析。
2 结果
2.1 肝脏Fas蛋白的western blot检测结果 肝脏Fas蛋白表达的western blot检测结果显示,试验组Fas蛋白的表达随时间的推移呈增加趋势(图1),其灰度值明显高于对照组(p<0.01),并且始终呈上升趋势(表 1)。


表1 肝脏Fas蛋白的表达结果(灰度值比)(n=6,X±SD)Table 1The expression results of Fas protein in liver(relative values of expression levels)(n=6,X±SD)
2.2 肝脏Fas蛋白的FCM检测结果 检测结果图中横坐标表示细胞大小,纵坐标表示荧光强度,根据强度大小自动换算为信道数值分别以线性和对数形式表示。根据默认值分为4个象限,其中B象限、D象限为细胞团块或多细胞集聚体,C象限为细胞与荧光抗体的非特异结合,所以仅A象限数据为有效表达率。结果显示,Fas蛋白随时间延长表达量增加(图2);表达率明显高于对照组(p<0.01),并且呈上升趋势(表2)。

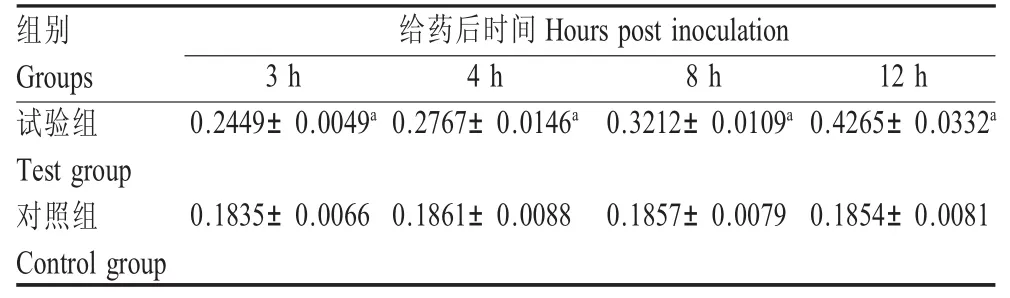
表2 肝脏Fas蛋白的表达结果(表达率,%)Table 2The expression results of Fas protein in liver(expression rates,%)(n=6,X±s)
3 讨 论
ET在动物机体内受血浆和细胞内的多种内源性物质的调节。其中脂多糖结合蛋白(LBP)与LPS刺激肝细胞和巨噬细胞的关系最为密切,LBP与LPS结合为可溶性LBP-LPS复合体,再与肝细胞表面的CD14受体结合并直接作用于肝细胞,从而诱导肝细胞Fas配体(FasL)等基因的表达[12]。
本研究采用western blot和FCM相结合的方法对ET致大鼠肝损伤中Fas蛋白表达的变化进行检测,结果显示:对照组和试验组大鼠肝脏均有Fas蛋白的表达,对照组肝脏Fas蛋白表达均明显低于试验组,并且试验组Fas蛋白表达随着时间的延长而增加。Fas是一种促凋亡蛋白,FasL与Fas的结合导致Fas胞内的死亡域形成三聚体的活化形式,随后引起与之结合的Fas相关死亡结构域蛋白(FADD)构象发生改变,FADD通过其死亡效应功能区(DED)再与第3个N末端有该同源功能区称为Fas激活的FADD样白介素1-β转化酶(ICE)结合导致后者的活化并被裂解,其裂解产物p10和p20亚基形成异聚体后即成为有活性的半胱氨酸蛋白酶,从而启动ICE相关蛋白酶及caspase级联反应,最终导致细胞的凋亡[13-14]。本研究结果表明在ET作用下Fas蛋白表达随时间推移而增加,而在Fas蛋白的促凋亡作用下,肝细胞的凋亡也随时间的推移而加剧,在一定程度上造成肝脏的损伤。可见ET能够诱导Fas蛋白表达的上调从而促进肝细胞凋亡,是ET致肝损伤的机制之一。
本研究中,试验组Fas蛋白表达随时间推移而逐渐增加,与对照组相比ET明显表现出对Fas蛋白表达的促进作用,而Fas蛋白的促凋亡作用依赖于一系列的信号转导;同样在ET血症及ET性休克过程中也伴随着多条ET信号转导途径,它们彼此之间是否共同作用造成肝损伤?其共同作用的联系如何?以及ET促进Fas蛋白表达更深层的机制又是什么?这些问题还有待于深入的研究和探讨。
[1]谢国旗,蒋建新,陈永华,等.内毒素至急性肝损伤机制的实验研究[J].中华急诊医学杂志,2002,11(1):6-9.
[2]Wetzel M,Li L,Harms K M,et al.Tissue inhibitor of metalloproteinases-3facilitates Fas-mediated neuronal cell death follow-ingmild ischemia[J].Cell Death Differ,2008,15:143-151.
[3]Katherine D,Crew,Marilie D.Genetic polymorphisms in the apoptosis-associated genes FAS and FASL and breast cancer risk[J].Carcinogenesis,2007,28(12):2548-2551.
[4]Katarzyna Z,Krystyna K,M iroslawa C,et al.Fas and FasL expression on cells of two transplantablemelanoma lines according to their different biological properties[J].Folia Histochem Cytobiol,2008,46(3):337-343.
[5]Jodo S,Kung J T,Xiao S,et a1.Anti-CD95-induced lethality requires radioresistant Fcgamma RII+cells A novel mechanism for fulm inant hepatic failure[J].J Biol Chem,2003,278(9):7553-7557.
[6]Xia M in,Xu Cun-shuan,JISheng-dong,et a1.Shedding of Fas ectodomain that affects apoptosis of hepatocytes occurring in regenerative liver[J].JGastroenterol,2002,37(12):1042-1047.
[7]Bajt M L,Vonderfecht S L,Jaeschke H.Differential protection w ith inhibitors of caspase-8and caspase-3in murine models of tumor necrosis factor and Fas receptor-mediated hepatocellular apoptosis[J].Toxicol Appl Pharmacol,2001,175(3):243-252.
[8]Nakae H,Zheng Y J,Wada H,et a1.Involvement of IL-18and soluble fas in patients with postoperative hepatic failure[J].Eur Surg Res,2003,35(2):61-66.
[9]Erwei S,Sang-Kyung L,Wang Jie,et al.RNA interference targeting Fas protectsm ice from fulm inant hepatitis[J].Nat Med,2003,9(3):347-351.
[10]严玉霖,高洪,高斌,等.内毒素诱导肝细胞凋亡的机制及阳离子A的保护效应[J].畜牧兽医学报,2006,37(1):61-64.
[11]翁银标,高洪,杨建发,等.内毒素对肝细胞凋亡及Bcl-2表达的影响[J].中国预防兽医学报,2008,30(5):359-362.
[12]张馨,余卫平.内毒素损伤肝脏机制的研究进展[J].国外医学消化系统疾病分册,2002,22(3):163-166.
[13]刘立跃,傅童生.肝细胞凋亡的基因调控[J].实验动物科学与管理,2005,22(3):33-36.
[14]高梅,张建军.Fas相关死亡域蛋白在肝细胞凋亡研究中的意义[J].国外医学消化系统疾病分册,2004,24(3):150-153.

