一次性免疫传感器快速检测阪崎肠杆菌的研究*
赵广英,张 晓,窦文超,张 冕,唐维潞,王文华
(浙江工商大学食品与生物工程学院,浙江省食品安全重点实验室,杭州 310035)
阪崎肠杆菌(Enterobacter Sakazakii,E Sakazakii)曾名为黄色阴沟肠杆菌。该菌是寄生在人和动物肠道内的条件致病菌,对成人危害不明显,但对婴幼儿危害非常严重,能引起新生儿脑膜炎、致死性小肠炎以及菌血症,死亡率高达50%以上[1]。E Sakazakii引起的脑膜炎常可致脑梗塞、脑脓肿、囊肿的形成和脑室炎等并发症,并可引起神经系统后遗症或迅速死亡[2]。现已明确,婴幼儿配方奶粉是婴幼儿感染E Sakazakii的主要途径。对于免疫机能尚不健全且以婴幼儿配方奶粉为主要母乳代用品和营养食品的婴幼儿而言,该菌的危害是非常大的。2002年,国际食品微生物标准委员会(International Commission for Microbiological Specifications for Foods,ICMSF) 将E Sakazakii列为“严重危害特定人群,危害生命或慢性实质性后遗症或长期影响”的致病菌[3]。2004年,FAO/WHO在制定婴幼儿配方奶粉标准时,经过风险评估,认为E Sakazakii与单核细胞李斯特菌(Listeria Monocytogenes)、肉毒梭菌(Clostridium Botalinum)的A型毒素和B型毒素有同等的危害[4]。2005年,我国发布了检测E Sakazakii的行业标准和国家标准[5-7],并于 2008 年和 2010 年进行了改进[8-9]。虽然标准规定的检测方法准确性较高,但实验步骤繁琐,检测时间长达6 d~7 d,可操作性差。对该菌的快速检测方法也有些报道,如分子生物学方法[10]、显色培养基[11]等。开发更良好的快速检测方法对该菌的及时监测、监管、质控、感染的预防和感染后的及时确诊的有效实施都是非常重要的。
离子液体(Ionic Liquids,ILs)是只含阴离子和阳离子且在室温下呈液态的熔融盐。因其具有离子导电率高、溶解性好、电化学窗口宽、相稳定性好、低毒等独特的物理化学性质,ILs被应用于萃取分离[12]、色谱[13-14]、质谱[15]、光谱[16]、毛细管电泳[17]等分析化学领域。1992年,Wiikes等[18]合成了对水和空气稳定的ILs,这使得ILs成为酶促反应溶剂的又一良好选择。Fuller等[19]证明部分ILs是有较好生物相容性的介质。在含阴离子 BF-4、PF-6、Tf2N-的 ILs 中酶的活性好[20],这可能是 BF-4、PF-6、Tf2N-较小的氢键力减少了溶剂与酶内部的氢键作用,减小了溶剂与酶结构中正电荷区的作用使酶构象不易改变,从而延长酶的保存时间。Mori等[21]研究证明在离子液体1-丁基-3-甲基咪唑六氟磷酸盐(1-Butyl- 3 - Methylimidazolium Hexafluorophosphate,[BMIM]PF6)中多种酶表现出较好的活性。近几年,用ILs构建酶传感器的研究报道较多,对传感器多方面的改进效果明显[22-23],但尚未见有将ILs用于改善免疫传感器的报道。
MWCNT主要是由石墨的碳原子层卷曲成数层到数十层的同轴圆管,表现出小尺寸效应、表面与界面效应和量子尺寸效应[24-25]既具有金属的性质又具有半导体特性[26],有优良的导电性和催化活性,能促进生物分子的电子传递[27-28]。基于这些特点,MWCNT成为生物传感器制作的良好材料[29-30]。但MWCNT几乎不溶于所有溶剂,这极大地限制了其在修饰电极方面的应用。Nafion对MWCNT有较好的分散能力,有效的解除了MWCNT应用的限制,而且 Nafion也具有良好的生物相容性[31-32],国内外已大量应用Nafion制作高灵敏度葡萄糖传感器的报道[35-36]。用 MWCNT/Nafion 构建的生物传感器虽然在多方面的性能已有明显的改进,但尚存在电化学信号的稳定性,循环伏安(CV)峰的峰形还不够理想[37-38]、传感器储存时间不够长[39]等不足。本研究将MWCNT分散于Nafion溶液中制备了具有很好稳定性的悬浮液。
丝网印刷电极作为支持电极,相比于固体电极制作的免疫传感器,减少了电极每次使用后都要进行物理或化学处理带来的实验误差和麻烦,提高了检测的准确性和简便性;丝网印刷电极的价格非常便宜,一次性使用,可实现批量化生产。
本研究尝试用Nafion、多壁碳纳米管(Multi-Wall Carbon Nanotube,MWCNT)结合离子液体[BMIM]PF6对丝网印刷电极进行修饰,研制了一种新型的电化学免疫传感器,用于快速检测阪崎肠杆菌。
1 实验部分
1.1 仪器与试剂
CHI 1030A电化学工作站、CHI 760C电化学工作站(上海辰华仪器公司);SPM-9500J3原子力显微镜(日本岛津);丝网印刷碳电极(SPCE,本研究团队与嵘斌生物科技有限公司共同开发研制);阪崎肠杆菌(E Sakazakii,ATCC 29544); 大 肠 杆 菌(Escherichia coli,E coli,ATCC 8739)、金黄色葡萄 球 菌 (Staphylococcus aureus,S Aureus,ATCC 27217)、副溶血性弧菌(Vibrio Parahaemolyticus,VP,VP 17802)、蜡样芽胞杆菌(Bacillus Cereus,B Cereus,ATCC 7064)(购于中国工业微生物菌种保藏中心,CICC);纯化MWCNT(中国科学院成都有机化学有限公司);[BMIM]PF6(中国科学院兰州化学物理研究所)、Nafion117(5%,Fluka)、HRP-Anti-E Sakazakii(北京赛驰生物科技有限公司)、牛血清蛋白(BSA,杭州昊天生物技术有限公司)、硫堇(Thionine,Thi,分析纯,国药集团化学试剂有限公司)、磷酸盐缓冲溶液(PBS,0.01 mol/L,pH 7.4)、H2O2、NaCl、冰醋酸、无水乙酸钠等试剂均为分析纯,实验用水为二次蒸馏水。电化学测量前,支持电解质均充N220 min除氧。
1.2 免疫电极的制备
取适量5%Nafion,用乙醇/水混合物(V乙醇∶V水=1∶2)分别稀释至 0.5%和 0.1%。准确称量 1.0 mg已纯化的MWCNT溶于1.5 mL 0.5%Nafion溶液中,超声处理30 min。将MWCNT悬浮液室温过夜,除去沉淀。用0.1%Nafion配制13%[BMIM]PF6溶液。
酶免疫电极按照如下步骤制备:①用微量移液器吸取3 μL MWCNT/Nafion溶液均匀滴涂于SPCE的工作电极表面,室温晾干;②将13%[BMIM]PF6溶液与 HRP-Anti-E Sakazakii(6 μg/mL)等体积混合,在混匀器上震荡均匀,4℃保存;③吸取3 μL[BMIM]PF6/Nafion/HRP-Anti-E Sakazakii混合液均匀滴涂到步骤①修饰的工作电极上,室温晾干;④制得的免疫电极4℃保存备用。

图1 免疫电极制备及工作原理示意图
1.3 实验方法
将不同修饰电极于SPM-9500J3型AFM进行成像观察,扫描方式为轻敲模式,所用探针为商用OMCL-AC240TS-C2 型(日本Olympus公司),所有图像均通过自动平滑处理以消除慢扫方向的低频噪音。
电化学实验采用三电极体系:免疫电极为工作电极,碳电极为对电极,Ag/AgCl电极为参比电极。采用循环伏安法(CV,应用CHI 1030A电化学工作站)和交流阻抗法(EIS,应用CHI 760C电化学工作站)对免疫电极电化学表征,用CV检测E Sakazakii。测试底液为含1.0 mmol/L Thi的0.3 mmol/L H2O2HAc-NaAc(0.1 mol/L,pH 6.5)缓冲溶液。用生理盐水制备的各浓度梯度的E Sakazakii悬液,在每个免疫电极上滴加3 μL菌悬液,于无菌密闭容器中30±0.5℃孵育20 min,用双蒸水仔细冲洗干净,晾干。用CV法检测免疫电极还原峰电流值的变化值(ΔIpc)来测定样品中的 E Sakazakii,ΔIpc=Ipc1-Ipc2,其中Ipc1为免疫电极在测试底液中的还原峰电流值,Ipc2为免疫电极孵育抗原后在测试底液中的还原峰电流值。
2 结果与讨论
2.1 电极表征
2.1.1 AFM 表征
通过AFM对修饰电极做了形态表征,如图2所示。由图1a可见MWCNT露出部分的形态,这表明Nafion成功地将 MWCNT修饰到了电极上。[BMIM]PF6/Nafion包埋的酶标抗体明显地固定在MWCNT/Nafion修饰的电极上(图2b)。免疫电极孵育后(图2c),E Sakazakii覆盖了抗体层(图2c),这表明HRP-Anti-E Sakazakii与E Sakazakii发生了特异性结合。

图2 电极修饰的AFM表征
2.1.2 电极修饰过程的循环伏安表征
采用CV研究不同修饰物对电极电化学特性的影响(图3)。
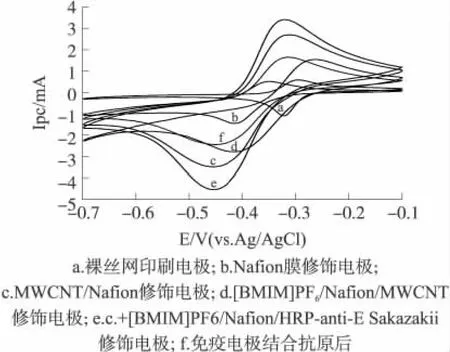
图3 不同电极在测试底液中的CV图
由图3可知,裸丝网印刷碳电极(SPCE)在底液中出现一对可逆的Thi(硫堇)氧化还原峰(曲线a);当电极修饰Nafion后,氧化峰电流值基本不变,还原峰电流值增大(曲线b),这是由于Nafion侧链上的-HSO-3离子束的静电作用,可以使得Nafion膜通过离子交换固定测试底液中的电活性物质Thi,这促进了电子从电极向Thi的传递从而导致了还原峰电流增大;当MWCNT/Nafion修饰到电极表面后,氧化还原峰电流明显增大(曲线 c),这是因为MWCNT具有大比表面积能有效地改变电极表面特性,MWCNT管端类似于高度有序石墨电极有较快的电子传递能力,MWCNT的独特电化学特性使得电极CV时信号明显放大;用[BMIM]PF6/Nafion修饰电极后,氧化还原峰降低(曲线 d),这是由于[BMIM]PF6/Nafion阻碍了Thi和H2O2向电极修饰层内部的扩散,虽然减弱了底物与MWCNT间的电子传递,在一定程度上降低了电极的电流响应,却使得免疫电极孵育前后的电流变化值ΔIpc中所占的比例提高,使得检测结果更准确。当HRP-anti-E Sakazakii固定后,电极氧化还原电流峰电流显著增大(曲线e),这表明酶标抗体已成功地包埋在[BMIM]PF6/Nafion复合膜中。免疫反应后,免疫电极氧化还原峰电流值大幅减小(曲线f),表明抗原-抗体免疫反应后生成的免疫复合物在部分空间上阻碍了媒介体和底物向HRP活性中心和电极内部的扩散,电子传递受到阻碍,从而导致了氧化还原电流峰值的大幅降低。
2.1.3 免疫传感器的交流阻抗法(EIS)表征
以Thi为探针对免疫电极进行交流阻抗法表征。如图4所示,裸电极的阻抗图谱近似一条直线(曲线a),这表明电极过程只受扩散控制;电极上修饰Nafion/MWCNT后,电极的阻抗值明显增大(曲线b)。修饰离子液体[BMIM]PF6/Nafion/HRP-anti-E Sakazakii后电极在动力学上变慢(曲线c),这是因为酶标抗体是生物大分子,固定于电极后使得电极表面电子传递受到较大阻力。免疫电极经免疫反应后阻抗值明显增大(曲线d),这表明修饰在电极上的抗体保持了很好的活性,成功的结合了抗原。

图4 不同电极在测试底液中的Nyquist图
2.2 实验条件的优化
2.2.1 测试底液中H2O2浓度确定
H2O2浓度对HRP催化反应影响较大。如图5所示,在H2O2浓度为0~0.1 mmol/L时,免疫电极还原峰电流值急剧增大;在0.1 mmol/L~1 mmol/L间,随着H2O2浓度的增加,免疫电极还原峰电流值增加平缓。考虑到检测的灵敏度、酶催化活性以及CV峰形,选取0.3 mmol/L浓度的H2O2。

图5 测试底液中H2O2浓度与免疫电极还原峰电流的关系
2.2.2 pH 的确定
底液pH值对免疫电极氧化还原峰电流响应的影响如图6所示。在含1.0 mmol/L Thi和0.3 mmol/L H2O2的底物溶液中,pH 4.0 ~8.0 范围内,免疫电极在pH 5.0时氧化峰电流值最大,之后逐渐降低;还原峰电流值随pH的增加而增大。在pH 6.5时,免疫电极峰形最为良好,因此实验选择测试底液pH为6.5。

图6 测试底液pH与免疫电极氧化峰电流(a)和还原峰电流(b)的关系
2.2.3 孵育条件的选择
孵育温度和时间对免疫反应有显著影响。图7(a)显示,在(30±0.5)℃温度下,免疫反应前后免疫电极还原峰电流值减少量ΔIpc最大。在这一温度下,免疫反应10 min后,还原峰电流值变化平缓;孵育50 min时ΔIpc出现较大波动(图7(b)),这是由稀释抗原的生理盐水中NaCl形成结晶难以被洗脱而导致的现象。考虑到免疫反应的充分性和检测周期,实验中选择孵育时间为20 min。

图7 孵育温度和孵育时间与还原峰电流的关系
2.3 免疫电极对E Sakazakii的响应
在以上优化的实验条件下进行E Sakazakii的电化学免疫测定,采用CV法检测免疫前后还原峰电流的变化值 ΔIpc。图8表明E Sakazakii浓度在103cfu/mL~109cfu/mL之间变化时,ΔIpc与细菌浓度的对数成良好的线性关系,线性方程为ΔIpc(μA)=0.2580lg[C/(cfu·mL-1)]-0.6469,相关系数为0.9987。检出限为3.4×102cfu/mL(S/N=3)。

图8 免疫电极还原峰电流变化值对E Sakazakii浓度对数值的标准曲线
2.4 特异性
特异性是衡量免疫电极性能好坏的一个重要指标。实验中选取 PBS空白液和 VP、E coli、S flexneri、S Aureus、B Cereus(浓度与 E Sakazakii相同,均为109cfu/mL)这些食品中常见致病微生物进行特异性实验。图9显示免疫电极检测E Sakazakii时,电流变化远大于其他致病菌和PBS引起的电流变化(ΔIpc均小于0.3 μA),这表明该免疫电极具有较好的特异性。
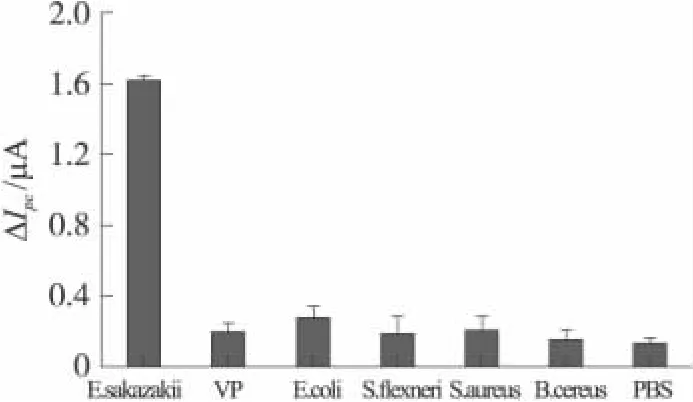
图9 免疫电极的特异性
2.5 重现性、稳定性、准确性
2.5.1 重现性、稳定性
分别取不同批次制备的免疫电极对E Sakazakii进行测定,测定结果RSD<6%(n=7),这表明该免疫电极具有良好的重现性。将免疫电极于4℃下放置30 d,每隔5 d对电极测试并记录其电流响应,并与只用Nafion包埋酶标抗体制作的免疫电极对照。图10显示,由 Nafion/[BMIM]PF6/HRP-anti-E Sakazakii制备免疫电极的响应信号为初始信号的95.50%(n=6),而对照组信号降至初始信号的88.10%。这说明离子液体[BMIM]PF6能有效地延长 HRP-anti-E Sakazakii的半衰期而保持其活性,使得免疫电极有较长的储存周期。

图10 免疫电极的储存稳定性
2.5.2 准确性
根据免疫电极特异性实验,当免疫电极检测实际样品的电流变化值ΔIpc≥0.3 μA时,将样品定为阳性样品,ΔIpc<0.3 μA 时定为阴性样品。采用免疫电极检测十种婴幼儿配方奶粉,平行测3份,并与国标法比较。结果见表1,十种样品均为阴性,两种检测方法结果一致。由于免疫电极检测确定阴性样品的判据是还原峰电流值变化 ΔIpc<0.3 μA,所以检测结果存在假阴性的可能。本团队利用感官评价中的三点检验法进一步检测结果的准确性。实验分为样品制备和免疫电极检测两部分,由两组人员独立完成。样品准备人员随机选取三种无E Sakazakii检出的奶粉,在其中两种奶粉中接种E Sakazakii。经处理,制备六组试样用于检测,每组试样包含3份,分别由3种奶粉制备。由作者用免疫传感器对试样检测。表2显示,免疫电极准确地鉴别出17份试样是否被E Sakazakii污染,出现1例假阴性,出现假阴性的概率为5.56%。在清除电极表面NaCl和未免疫结合抗原过程中,冲洗强度过大是出现假阴性的主要原因,选择更合适的试剂分散E Sakazakii是降低冲洗强度的有效方法。

表1 免疫电极准确性实验结果(n=30)
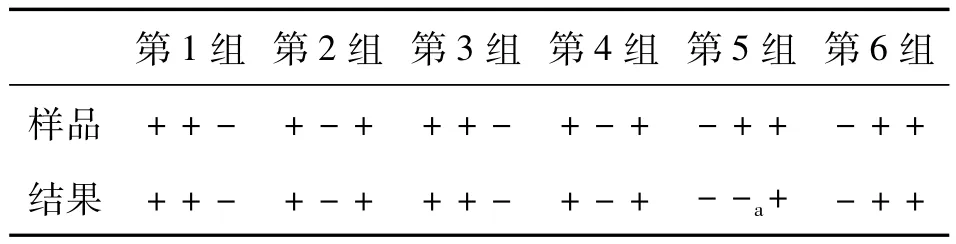
表2 免疫电极三点检验法准确性检测的结果
3 结论
本文采用[BMIM]PF6/Nafion基质将HRP-anti-E Sakazakii固定于Nafion/MWCNT修饰的丝网印刷碳电极上,制成检测E Sakazakii的免疫电极。该免疫电极具有较好的电化学信号、选择性、重现性(RSD<6%)、准确性(出现假阴性的概率为5.56%)和储存稳定性(4℃放置30 d后电流响应值问为初始值的 95.50%)。该方法检测的线性范围为>103cfu/mL~109cfu/mL。此免疫电极制作简便、成本低廉,利用其检测目标抗原简单易行,有望成为快速检测微生物的一种新方法。
[1]Joshoa B G,Jeffrey L K,Larry R B.Enterobacter Sakazakii:A coliform of Increased Concern to Infant Health[J].Food Microboil,2005,104(1):1-34.
[2]裴晓燕,刘秀梅.阪崎肠杆菌的生物学性状与健康危害[J].中国食品卫生杂志,2004,16(1):550-555.
[3]ICMSF.Microorganism in Food Mumber 7.Microbiological Testing in Food Safety Management[R].Netherlands:Kluwer A Cadem ie/Plenum Publishers,2002.
[4]Joint FAO/WHO Workshop on Enterobacter Sakazakii and Other Microoganisms in Powdered Infant Formula,Geneva.2004-02-02-05.
[5]SN/T 1632.1—2005.奶粉中阪崎肠杆菌检验方法.第1部分[S].
[6]SN/T 1632.2—2005.奶粉中阪崎肠杆菌检验方法.第2部分[S].
[7]SN/T 1632.3—2005.奶粉中阪崎肠杆菌检验方法.第3部分[S].
[8]GB/T 4789.40—2008,食品卫生微生物学检验.阪崎肠杆菌检验[S].
[9]GB/T 4789.40—2010,食品卫生微生物学检验.阪崎肠杆菌检验[S].
[10]Ji Y B,Chankyu P,Insoo C,et al.Development of Multiplex Real-Time PCR with Internal Amplification Control for Simultaneous Detection of Salmonella and Cronobacter in Powdered Infant Formula[J].Food Microbiology,2010,144(1):177-181.
[11]Seung Y B,Hyun H J,Sun Y L.Inhibitory Effect of Organic Acids Against Enterobacter Sakazakii in Laboratory Media and Liquid Foods[J].Food Control,2009,20(10):867-872.
[12]Hongdeng Q,Shengxiang J,Xia L.N-Methylimidazolium Anion-Exchange Stationary Phase for High-Performance Liquid Chromatography[J].Chromatography A,2006,1103:265-270.
[13]Fenghua L,Ye J.Room Temperature Ionic Liquid as Matrix for the Determination of Residual Solvents in Pharmaceuticals by Static Gas Chromatography[J].Chromatography A,2007,1167(1):116-119.
[14]Pino V,Baltazar Q,Anderson J L.Examination of Analyte Partitioning to Monocationic and Dicationic Imidazolium-Based Ionic Liquid Aggrefates Using Solid-Phase Microextraction-Gas Chromatography[J].Chromatography A,2007,1148(1):92-97.
[15]Tolstogouzov A,Bardi U,Nishikawa O,et al.Mass Spectro-metricanalysis of Imidazolium-Basedionic Liquids by Scanning Atom Probe[J].International Journal of Mass Spectrometry,2009,281(1-2):37-40.
[16]Jean M A,Fabian J,Alfons B.Decolorization of Ionic Liquids for Spectroscopy[J].Supercritical Fluids,2010,55(1):395-400.
[17]Michal P M,Michal J M,Roman K.Separation of Nicotinic Acid and Its Structural Isomers Using 1-Ethyl-3-Methylimidazolium I-onic Liquid as a Buffer Additive by Capillary Electrophoresis[J].Pharmaceutical and Biomedical Analysis,2006,41:329-332.
[18]Wilkes J S,Zaworotko M J.Air and Water Stable 1-Ethyl-3-Methylimidazolium Based Ionic Liquids[J].Chem.Soc.Chem.Commun,1992,13:965-967.
[19]Fuller J,Carlin R T,Osteryoung R A.The Room Temprature Ionic Liquid 1-Ethyl-3-Methylimidazolium Tetrafluoroborate:Electrochemical Couples and Physical Properties[J].Electrochem.Soc.,1997,144(11):3881-3885.
[20]Kaar J L,Jesionowski A M,Berterich J A,et al.Impact of Ionic Liquid Physical Properties on Lipase Activity and Stability[J].Chem.Soc.,2003,125(14):4125-4131.
[21]Mori M,Garcia R G,Belleville M P,et al.A New Way to Conduct Enzymatic Synthesis in an Active Membrane Using Ionic Liquids as Catalyst Support[J].Catalysis Taday,2005,104(3):313-317.
[22]Fei X,Faqiong Z,Deping,et al.Nonenzymatic Glucose Sensor Based on Ultrasonic-Electrodeposition of Bimetallic PtM(M=Ru,Pd and Au)Nanoparticles on Carbon Nanotubes-Ionic Liquid Composite Film[J].Biosensor and Bioelectronics,2009,24(12):3481-3486.
[23]Afsaneh S,Norouz M,Elaheh F.Fabrication of a Glucose Sensor Based on a Novel Nanocomposite Electrode[J].Biosensor and Bioelectronics,2009,24(6):1655-1660.
[24]Meunier V,Lambin P H.Tight-Binding Computation of the STM Image of Carbon Nanotubes[J].Phys Pev Lett,1998,81(25):5588-5591.
[25]Kasumov A,Deblock R,Kociak M,et al.Supercurrents Through Single-welled Carbon Nanotubes[J].Science,1999,284:1508-1511.
[26]Collins P G,Zettl A,Bando H,et al.Nanatube Nanodevice[J].Science,1997,278(5335):100-102.
[27]Wang L,Yuan Z B.Direct Electrochemistry of Glucose Oxidase at a Gold Electrode Modified With Single-Wall Carbon Nanotubes[J].Sensor,2003,3(12):544-554.
[28]Cai C X,Chen J.Direct Electron Transfer of Glucose Oxidase Promoted by Carbon Nanotubes[J].Analytical Biochemistry,2004,332(2):75-83.
[29]赵广英,詹学佳.一次性免疫传感器电极快速检测福氏志贺氏菌的研究[J].传感技术学报,2009,22(9):1221-1226.
[30]林伟,黄世震,陈文哲.射频反应磁控溅射SnO2/MWCNTs薄膜材料的气敏性能研究[J].传感技术学报,2009,22(6):771-775.
[31]惠国华,陈裕泉.基于纳米管微传感器阵列和随机共振的气体检测方法研究[J].传感技术学报,2010,23(2):179-182.
[32]Yu C T,Ping C H,Yen W L,et al.Silver Nanoparticles in Multi-Walled Carbon Nanotube-Nafion for Surface-Enhanced Raman Scattering Chemical Sensor[J].Sensor and Actuators B,2009,138,5-8.
[33]许红岩,王丽莉,王彦怀,等.没食子酸在Nafion/单壁碳纳米管/聚(3-甲基噻吩)复合膜修饰电极上的电化学行为及测定[J].传感技术学报,2009,21(7):1113-1118.
[34]Upadhyay A K,Ya Y P,Shen M C.Immobilization of Horseradish Peroxidase and Nile Blue into the Ormosil Nanocomposite for the Fabrication of Hydrogen Peroxide Biosensor Based on MWCNT Modified Glassy Carbon Electrode[J].Sensors and Actuators B,2009,141:557-565.
[35]Manesh K M,Hyun T K,Santhosh P,et al.A Novel Glucose Biosensor Based on Immuobilization of Glucose Oxidase into Multi-Wall Carbon Nanotubes-Polyelectrolyte-Loaded Electro Spun Nanofibrous Membrane[J].Biosensors and Bioelectronics,2008,23:771-779.
[36]王美芳,张伟,方宾.基于Nafion/碳纳米粒子修饰的葡萄糖传感器[J].分析化学,2010,38(1):125-128.
[37]Upadhyay A K,PengY Y,ChenSM.Immobilizationof Horseradish Peroxidase and Nile Blue into the Ormosil Nanocomposite for the Fabrication of Hydrogen Peroxide Biosensor Based on MWCNT Modified Glassy Carbon Electrode[J].Sensors and Actuators B,2009,141:557-565.
[38]Anantha I G,Kwang P L,Dhanusuraman R,et al.An Electrochemical Glucose Biosensor Exploiting a Polyaniline Grafted Multiwalled Carbon Nanotube/Perfluorosulfonate Ionomer-Silica Nanocomposite[J].Biomaterials,2009,30:5999-6005.
[39]赵广英,吴淑春.基于四通道丝网印刷碳电极的禽流感(H5N1)抗体电化学免疫传感器的研制[J].传感技术学报,2008,21(8):1295-1300.

