一氧化氮在休克大鼠离体淋巴管对P物质反应性中的作用*
司永华,牛春雨,秦立鹏,赵自刚,张 静
(河北北方学院微循环研究所,基础医学院病理生理学教研室,河北 张家口 075029)
淋巴循环是循环系统的重要组成部分,淋巴管收缩性是淋巴循环的动力。整体动物实验表明,失血性休克(hemorrhagic shock,HS)早期淋巴管收缩性升高、后逐渐下降[1],淋巴管收缩功能状态与休克转归相关[2];一氧化氮(nitric oxide,NO)的周期性变化参与了淋巴管生理状态下的收缩、舒张以及张力调节[3-4],且NO参与了休克离体淋巴管收缩性双相变化的调节[5]。进一步研究发现,休克2 h整体动物与离体淋巴管对缩血管物质去甲肾上腺素的反应性均下降,其机制与钙敏感性降低有关[6-7];P物质(substance P,SP)作为一种与淋巴组织感觉神经支配有关的神经肽,不仅对正常淋巴管平滑肌具有重要的正性肌力和变时性作用[8],同时,还可增加休克各期离体淋巴管的泵功能[9],休克离体淋巴管对SP的反应性呈双相变化。但NO是否参与了休克离体淋巴管反应性的双相变化?这也是针对淋巴管反应性调控淋巴管收缩性的切入点之一,值得关注。本实验应用离体淋巴管灌流技术,观察NO/一氧化氮合酶(nitric oxide synthase,NOS)工具药对休克离体淋巴管反应性的影响,探讨NO在休克淋巴管反应性中的作用。
材料和方法
1 材料
1.1 动物与主要试剂 SPF级雄性Wistar大鼠42只,体重250~300 g,购自中国军事医学科学院实验动物中心;L-精氨酸(L-arginine,L-Arg)购于Sigma;1H -[1,2,4]恶二唑[4,3 -a]喹喔啉 -1 - 酮(1H -[1,2,4]oxadiazolo[4,3 - a]quinoxalin -1 -one,ODQ)购于Sigma;L-硝基-精氨酸甲酯(NG-nitro-L-arginine methyl ester,L-NAME)购于 Sigma;氨茶碱(aminophylline,AP)购于 Sigma;SP购于Alexis。
1.2 主要仪器 CH/2型微血管压力-直径测定仪(Living Systems Instrumentation,LSI);PS/20 型压力伺服系统(LSI);TS100型倒置显微镜(Nikon);NE-1000型程控微量抽注泵(New Era Pump Systems Inc.);308/opt-o型视频卡尺(Colorado Video Inc.);SSZ型手术显微镜(上海光学仪器厂);RM6240BD型生物信号采集处理系统(成都仪器厂)。
2 方法
2.1 失血性休克模型的复制 大鼠经1%戊巴比妥钠(50 mg/kg)肌肉注射麻醉后,常规方法分离右侧股静脉和股动脉,股静脉注射肝素钠(500 U/kg)全身抗凝,股动脉插管并通过生物信号采集处理系统监测平均动脉血压(mean artery pressure,MAP);同时,分离左侧股动脉,插管后连接注射器固定于抽注机上备放血用。待所有手术完成、稳定30 min后,经左股动脉、应用抽注机缓慢匀速放血,10 min内将MAP降至40 mmHg,实验中通过调整放血量维持MAP在(40±2)mmHg水平,复制HS模型。其中,18只动物在低血压0.5 h制备离体淋巴管条,作为休克0.5 h组;18只动物在低血压2h制备离体淋巴管条,作为休克2 h组;其余6只动物仅麻醉、手术,作为对照组(control)。
2.2 离体淋巴管条的制备、固定与稳定 所有大鼠在相应时点,腹腔注射大量戊巴比妥钠(120 mg/kg)后,按我们方法[5,9],取出胸导管,去除周围组织,制备离体淋巴管条;将淋巴管条移入预先充有PSS缓冲液的微血管压力-直径测定仪的浴槽内,将淋巴管两端嵌套于浴槽内2个直径相匹配的毛细玻璃管(450~550 μm),尼龙丝线结扎两端固定,检查胸导管壁有无渗漏、损伤和扭转;通过压力伺服系统设置压力为3 cmH2O,待其温度自然升到室温,然后再30 min将温度逐渐加热到37℃[10]。淋巴管出现自发性收缩后稳定30 min(若无自发性收缩则弃去),然后换1次液,以减少由于蒸发而引起的渗透压变化[11]。
2.3 与NO工具药共孵育 将出现自发性收缩的休克0.5 h淋巴管分别与L-Arg、L-Arg+ODQ孵育5 min(分别为休克0.5 h+L-Arg组、休克0.5 h+L-Arg+ODQ组);休克2 h淋巴管分别与 LNAME、L-NAME+AP孵育5 min(分别为休克2 h+L-NAME组、休克2 h+L-NAME+AP组),均n=6。其中,L-Arg浓度为 1×10-3mol/L,ODQ、L-NAME和AP浓度均为1×10-5mol/L。
2.4 离体淋巴管收缩反应性观察 各组淋巴管在跨壁压3 cmH2O下、稳定10 min、出现稳定的自发性收缩后,休克0.5 h、休克2 h各12根淋巴管条分别与NO工具药孵育5 min后,记录淋巴管的收缩频率(contraction frequency,CF)、舒张末期口径(end - diastolic diameters,EDD)和收缩末期口径(end-systolic diameters,ESD),待每条淋巴管收缩性观察结束后,将其在无钙PSS缓冲液中孵育15 min,测得淋巴管的最大被动舒张口径(passive diameters,PD)。结合文献[3,10-11],计算紧张性指数(tonic index,TI)、收缩幅度(contraction amplitude,CA)、泵流分数(fractional pump flow,FPF),其中:TI=(PD -EDD)/PD ×100%;CA=(EDD-ESD)/PD×100%;FPF=(EDD2- ESD2)/EDD2× CF。以 CF、TI、CA 和 FPF作为淋巴管收缩性的指标,以本次数据作为淋巴管收缩的基础数值。随后在各组淋巴管的浴槽中依次从低到高浓度加入SP母液,使浴槽中SP终浓度为10-8、3 ×10-8、10-7和 3 ×10-7μmol/L,在每次加入SP 1 min后,分别记录 CF、SDD 和 ESD,计算 TI、CA和FPF等收缩性指标。以在每一SP浓度下的CF、TI、CA和FPF与未加SP前淋巴管基础值的差值ΔCF、ΔCA、ΔFPF 和 ΔTI,作为淋巴管对 SP 反应性的指标,评价NO对休克淋巴管反应性的作用。
3 统计学处理
采用SPSS 16.0统计软件包,计量数据以均数±标准差()表示,首先进行方差齐性检验,方差齐的资料多组间比较采用单因素方差分析,方差不齐的资料采用Kruskal-Wallis检验。
结 果
1 NO对休克淋巴管ΔCF的影响
如图1所示,休克0.5 h组淋巴管的ΔCF在SP浓度为 1×10-8mol/L、3×10-8mol/L 和 1 ×10-7mol/L时均显著高于对照组(P<0.01),用L-Arg孵育后,ΔCF显著降低(P<0.05);与 L-Arg和ODQ同时孵育后,ΔCF升高至未加药组水平,且在SP浓度为1×10-8mol/L和3×10-8mol/L时显著高于对照组,在SP为1×10-8mol/L时显著高于休克0.5 h+L-Arg组(P<0.05,P<0.01)。
休克2 h淋巴管ΔCF在SP浓度为3×10-7mol/L时低于对照组(P<0.05);而用L-NAME孵育后,ΔCF显著增高(SP浓度为3×10-7mol/L除外),且在SP浓度为3×10-8mol/L时,显著高于对照组(P<0.05,P<0.01);与 L-NAME和AP同时孵育后,在各浓度SP下,ΔCF呈下降趋势,与未加药组相比差异无统计学意义,但在1×10-8mol/L和3×10-8mol/L时显著低于休克2 h+L-NAME组(P<0.05)。
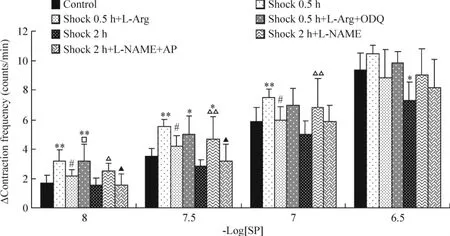
Figure 1.Effects of ODQ and/or L -Arg,aminophylline(AP)and/or L -NAME on Δcontraction frequency of lymphatics after hemorrhagic shock.ΔContraction freguency:the maximal change in contraction freguency after the administration of SP..n=6.*P<0.05,**P <0.01 vs control;#P <0.05 vs shock 0.5 h;△P <0.05,△△P <0.01 vs shock 2 h;□P <0.05 vs shock 0.5 h+L-Arg;▲P<0.05 vs shock 2 h+L-NAME.图1 ODQ和/或L-Arg、AP和/或L-NAME对休克淋巴管ΔCF的影响
2 NO对休克淋巴管ΔTI的影响
由图2可见,休克0.5 h组淋巴管的ΔTI在SP浓度为3×10-8mol/L时显著高于对照组(P<0.05);休克0.5 h组淋巴管与L-Arg孵育后,在SP为3×10-7mol/L和1×10-7mol/L时,ΔTI显著降低(P<0.05,P<0.01);休克0.5 h组淋巴管与LArg和ODQ共孵育后,ΔTI呈上升趋势,达对照组水平,且在SP浓度为1×10-7mol/L时显著高于休克0.5 h+L-Arg组(P<0.05)。
休克2 h组淋巴管的ΔTI在SP浓度为1×10-7mol/L时显著低于对照组(P<0.05);与L-NAME孵育后,在不同浓度SP时,ΔTI出现增高趋势,在1×10-8mol/L和3×10-8mol/L时显著高于对照组与休克2 h组(P<0.05,P<0.01);休克2 h组淋巴管与L-NAME和AP共孵育后,ΔTI在SP为1×10-8mol/L和3×10-8mol/L时显著低于休克2 h+LNAME 组(P<0.05,P<0.01)。

Figure 2.Effects of ODQ and/or L - Arg,aminophylline(AP)and/or L - NAME on Δtonic index of lymphatics after hemorrhagic shock.Δtonic index:the maximal change in tonic index after the administration of SP..n=6.*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs shock 0.5 h;△P<0.01 vs shock 2 h;□P<0.05 vs shock 0.5 h+L-Arg;▲P<0.05,▲▲P<0.01 vs shock 2 h+L-NAME.图2 ODQ和/或L-Arg、AP和/或L-NAME对休克淋巴管ΔTI的影响
3 NO对休克淋巴管ΔCA的影响
图3所示,各组淋巴管与不同物质孵育,在梯度浓度的SP下,除休克0.5 h淋巴管的ΔCA在SP为3×10-8mol/L时显著高于对照组(P<0.05)外,其他均未见统计学差异。

Figure 3.Effects of ODQ and/or L-Arg,aminophylline and/or L -NAME on Δcontraction amplitude of lymphatics after hemorrhagic shock.ΔContraction amplitude:the maximal change in contraction amplitude after the administration of SP..n=6.*P <0.05 vs control.图3 ODQ和/或L-Arg、AP和/或L-NAME对休克淋巴管ΔCA的影响
4 NO对休克淋巴管ΔFPF的影响
由图4可见,休克0.5 h淋巴管在SP浓度为1×10-8mol/L和3×10-8mol/L时的ΔFPF均显著高于对照组(P<0.05,P<0.01);与L-Arg孵育组在1×10-8mol/L、3×10-8mol/L和1×10-7mol/L时均显著低于休克0.5 h组(P<0.05),与对照组无显著差异;与L-Arg和ODQ共同孵育的休克0.5 h+LArg+ODQ组淋巴管的ΔFPF在SP浓度为1×10-8mol/L和3×10-8mol/L时显著高于对照组与休克0.5 h+L-Arg组(P<0.05,P<0.01)。
休克2 h淋巴管的ΔFPF与对照组比较,差异无统计学意义;在SP浓度为1×10-8mol/L和3×10-8mol/L时,休克2 h淋巴管与 L-NAME孵育后,ΔFPF显著增高(P<0.01),且在1×10-8mol/L时高于对照组(P<0.05);休克2 h淋巴管与 LNAME和AP同时孵育,与对照组相比差异无统计学意义,但SP在1×10-8mol/L和3×10-8mol/L时,显著低于休克2 h+L-NAME组(P<0.01)。
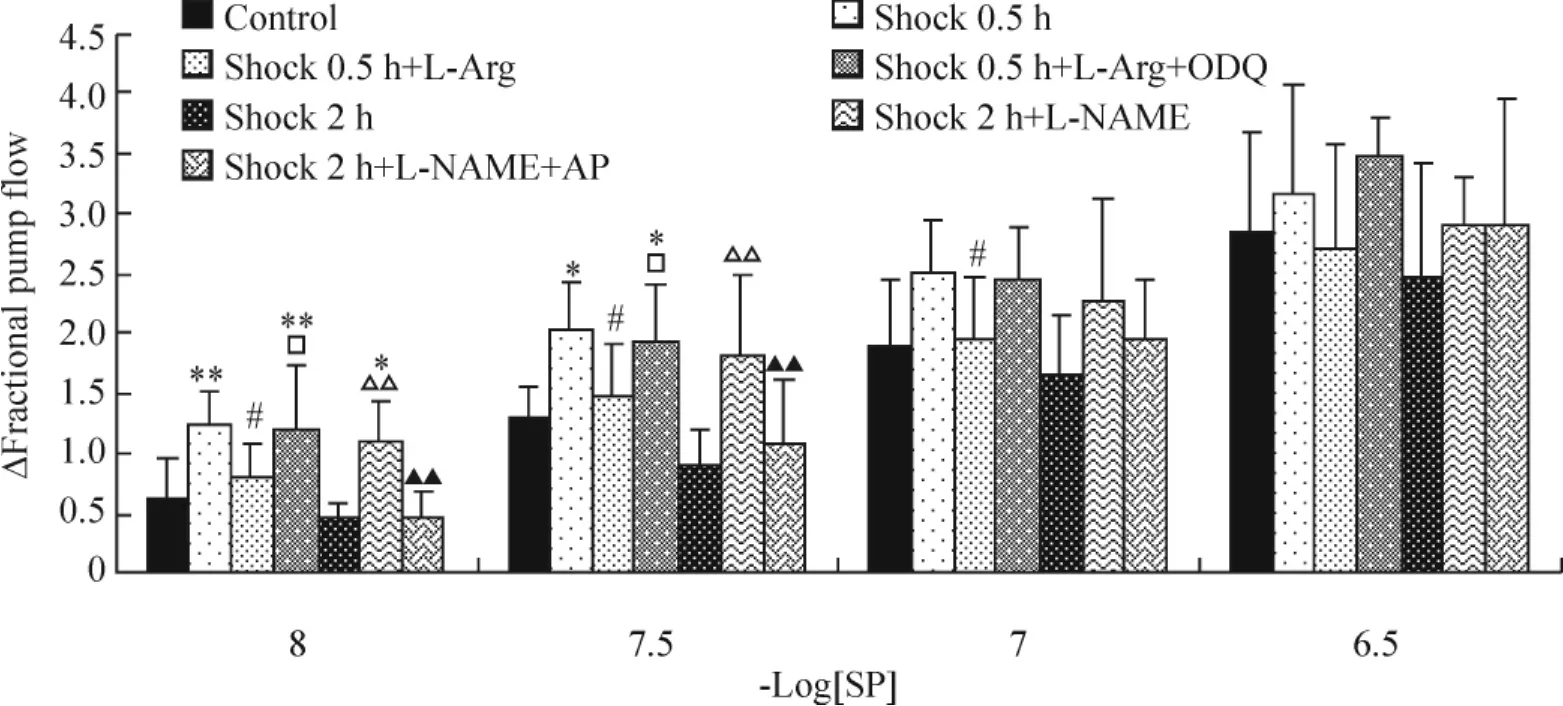
Figure 4.Effects of ODQ and/or L -Arg,aminophylline and/or L -NAME on Δfractional pump flow of lymphatics after hemorrhagic shock.ΔFractional pump flow:the maximal change in fractional pump flow after the administration of SP..n=6.*P<0.05,**P <0.01 vs control;#P<0.05 vs shock 0.5 h;△△P <0.01 vs shock 2 h;□P <0.05 vs shock 0.5 h+L-Arg;▲▲P<0.01 vs shock 2 h+L-NAME.图4 ODQ和/或L-Arg、AP和/或L-NAME对休克淋巴管ΔFPF的影响
讨 论
生理状态下,淋巴管内皮细胞仅表达内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS),在淋巴管收缩引起淋巴流的同时,产生剪切力,激活淋巴管内皮细胞中的eNOS,产生并释放NO,瓣膜和管壁都会出现快速、短暂的NO增加,引起淋巴管舒张;随着淋巴管舒张,NO含量减少,引起淋巴管下一步的收缩[12]。在淋巴管收缩过程中,NO几乎随收缩频率的增快成比例增多;当淋巴管收缩减弱时,NO开始减少[13];可见,NO在正常淋巴管活动的调节中具有重要作用。在炎症、感染、休克、创伤等病理状态下,受多种因素诱导,淋巴管内皮细胞表达诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)显著增加[14];淋巴管平滑肌细胞也可产生 iNOS[15],引起NO升高。我室前期的实验也证实了NO与休克后期淋巴管的低收缩性有关。
为了进一步证实NO在休克淋巴管反应性中的作用,在前期工作基础上,我们选择了淋巴管反应性双相变化的2个关键时点:休克0.5 h和休克2 h,制备离体淋巴管条,分别与NO供体L-Arg和NOS抑制剂L-NAME孵育,结果发现,L-Arg可显著降低休克0.5 h淋巴管对多个SP浓度点的ΔCF、ΔTI与ΔFPF;L-NAME均可提高休克2 h淋巴管对多个SP浓度点的ΔCF、ΔTI与ΔFPF,且高于对照组水平。结果提示,NO/NOS途径参与了休克后淋巴管反应性的双相调节。应当指出,L-Arg作为底物在NOS的作用下生成NO,该过程依赖于NOS活性[16],为了观察NO/NOS的作用,故本文在休克0.5 h采用了NO前体L-Arg,与休克2 h应用NOS抑制剂L-NAME相对应,而未应用直接代谢即可生成NO的供体硝普钠;当然,硝普钠在休克0.5 h时对淋巴管反应性的作用还有待进一步观察。
研究表明,NO通过激活胞内可溶性鸟苷酸环化酶(soluble guanylate cyclase,sGC),使三磷酸鸟苷环化产生环鸟苷酸(cyclic guanosine monophosphate,cGMP),增高的cGMP激活cGMP依赖性蛋白激酶G,通过调节淋巴管平滑肌细胞内的Ca2+浓度、Ca2+敏感性,进而调控淋巴管的收缩性[17]。为此,我们选择了cGMP生成的关键酶sGC的抑制剂ODQ(减少cGMP生成)、磷酸二酯酶抑制剂AP(抑制cGMP裂解,增加cGMP浓度,提高胞内Ca2+水平)作为调节cGMP水平的工具药,分别与休克0.5 h+L-Arg、休克2 h+L-NAME孵育,观察对淋巴管反应性的影响。结果发现,在某些SP浓度点上,ODQ可显著抑制L-Arg的作用,使ΔCF、ΔTI和ΔFPF显著高于休克0.5 h+L-Arg组,ΔCF和 ΔFPF高于对照组水平;AP显著抑制 L-NAME的作用,使 ΔCF、ΔTI与ΔFPF均明显低于休克2 h+L-NAME组。结果提示,NO调节休克淋巴管反应性双相变化的机制可能是通过cGMP实现的。
应当指出,SP作用于淋巴管平滑肌细胞,通过Ca2+-钙调蛋白-肌球蛋白轻链激酶通路,增加肌球蛋白轻链20磷酸化水平,使淋巴管收缩,调节生理与休克状态下离体淋巴管的收缩功能[9,18],故本文应用SP作为评价淋巴管反应性的工具药,观察NO/NOS的作用与机制;至于SP是否参与了NO的调节,还有待进一步观察。同时应该看到,在SP浓度较高(尤其是3×10-7mol/L)时,各组间离体淋巴管反应性多数未出现显著差异,究其原因,可能为:淋巴管反应性除与神经、体液因子以及自身张力多种因素的调节有关外,还与淋巴管本身的结构与物质基础相关,而过高浓度的SP可能掩盖了休克淋巴管结构基础对反应性的影响。
综上,本研究应用离体淋巴管灌流技术,证实了NO参与了休克淋巴管反应性的双相调节,其作用机制可能与cGMP有关;这对于以NO作为药物靶点调控休克淋巴管的收缩性是一个有益的补充。
[1]Zhang J,Liu YK.Changes of mesenteric lymph microcirculation and intestinal lymph circulation during shock in rat[J].Lymphology,1994,27(Suppl):721 -724.
[2]牛春雨,张 静,穆 铮,等.不同转归的过敏性休克大鼠淋巴微循环的变化[J].中国病理生理杂志,1997,13(6):620-623.
[3]Gasheva OY,Zawieja DC,Gashev AA.Contraction-initiated NO-dependent lymphatic relaxation:a self-regulatory mechanism in rat thoracic duct[J].J Physiol,2006,575(Pt 3):821-832.
[4]秦立鹏,牛春雨,赵自刚.一氧化氮在淋巴管收缩中的作用[J].生理科学进展,2011,42(3):237-240.
[5]秦立鹏,牛春雨,赵自刚,等.一氧化氮对失血性休克大鼠离体淋巴管收缩性双相变化的调节作用[J].生理学报,2011,63(4):301-309.
[6]刘志权,牛春雨,赵自刚,等.失血性休克大鼠淋巴管对去甲肾上腺素反应性的变化[J].中国病理生理杂志,2010,26(7):1366-1369.
[7]刘志权,牛春雨,赵自刚,等.失血性休克大鼠淋巴管低反应性的钙敏机制[J].中国病理生理杂志,2010,26(12):2383-2388.
[8]Davis MJ,Lane MM,Davis AM,et al.Modulation of lymphatic muscle contractility by the neuropeptide substance P[J].Am J Physiol Heart Circ Physiol,2008,295(2):H587-H597.
[9]秦立鹏,牛春雨,赵自刚,等.P物质增加失血性休克大鼠离体淋巴管的泵功能[J].中国病理生理杂志,2011,27(7):1323-1328.
[10]Zhang R,Gashev AA,Zawieja DC,et al.Length-dependence of lymphatic phasic contractile activity under isometric and isobaric conditions[J].Microcirculation,2007,14(6):613-625.
[11]Davis MJ,Davis AM,Ku CW,et al.Myogenic constriction and dilation of isolated lymphatic vessels[J].Am J Physiol Heart Circ Physiol,2009,296(2):H293 -H302.
[12]Kawai Y,Yokoyama Y,Kaidoh M,et al.Shear stressinduced ATP-mediated endothelial constitutive nitric oxide synthase expression in human lymphatic endothelial cells[J].Am J Physiol Cell Physiol,2010,298(3):C647-C655.
[13]Bohlen HG,Wang W,Gashev A,et al.Phasic contractions of rat mesenteric lymphatics increase basal and phasic nitric oxide generation in vivo[J].Am J Physiol Heart Circ Physiol,2009,297(4):H1319 - H1328.
[14]Mizuno R,Koller A,Kaley G.Regulation of the vasomotor activity of lymph microvessels by nitric oxide and prostaglandins[J].Am J Physiol,1998,274(3 Pt 2):R790-R796.
[15]Robertson DA,Hughes GA,Lyles GA.Expression of inducible nitric oxide synthase in cultured smooth muscle cells from rat mesenteric lymphatic vessels[J].Microcirculation,2004,11(6):503-515.
[16]王露茜,贾 静,郭明发,等.L-精氨酸、氨基胍和胍丁胺在大鼠局灶性脑缺血再灌注损伤中的作用[J].中国病理生理杂志,2011,27(6):1213-1217.
[17]Sauzeau V,Le Jeune H,Cario-Toumaniantz C,et al.Cyclic GMP-dependent protein kinase signaling pathway inhibits RhoA-induced Ca2+sensitization of contraction in vascular smooth muscle[J].J Biol Chem,2000,275(28):21722-21729.
[18]Wang W,Nepiyushchikh Z,Zawieja DC,et al.Inhibition of myosin light chain phosphorylation decreases rat mesenteric lymphatic contractile activity[J].Am J Physiol Heart Circ Physiol,2009,297(2):H726 - H734.

