4-氯-7-甲氧基-6-(3-氯丙氧基)喹唑啉的合成
杨绍娟孟令强李志军张爱琴曹黎华
(1.南昌航空大学科技学院,南昌 330034;2.国防科技大学理学院,长沙 410000;3.南昌航空大学环境与化学工程学院,南昌 330034)
4-氯-7-甲氧基-6-(3-氯丙氧基)喹唑啉的合成
杨绍娟1孟令强2李志军1张爱琴3曹黎华1
(1.南昌航空大学科技学院,南昌 330034;2.国防科技大学理学院,长沙 410000;3.南昌航空大学环境与化学工程学院,南昌 330034)
以3-羟基-4-甲氧基苯甲酸为初始原料,经过6步反应,合成了喹唑啉类酪氨酸激酶抑制剂Gefitinib及一系列衍生物的关键中间体4-氯-7-甲氧基-6-(3-氯丙氧基)喹唑啉,其中涉及到喹唑啉环的合成、羟基的合理保护等,反应总收率为44.56%;产物结构经H NMR确证。该方法反应条件温和,原料易得操作简便,适合于工业化生产。
4-氯-7-甲氧基-6-(3-氯丙氧基)喹唑啉;酪氨酸激酶抑制剂;合成
近年来对喹唑啉类化合物的研究已成为一个重要的领域。喹唑啉环广泛存在于天然产物、药物中间体以及抗癌药等化合物中[1-2]。目前对高活性酪氨酸激酶抑制剂喹唑啉类化合物的构效关系的研究已取得丰富的成果,其中以喹唑啉环为母体结构合成的Gefitinib及一系列衍生物是治疗非小细胞肺癌的重要药物[3-6]。
4-氯-7-甲氧基-6-(3-氯丙氧基)喹唑啉是合成这一系列抗癌药的关键中间体,因此对它的研究具有广泛的应用前景。本研究设计了4-氯-7-甲氧基-6-(3-氯丙氧基)喹唑啉的合成路线,并就合成过程进行了试验。
1 实验部分
1.1 合成路线的选择
喹唑啉的合成方法有:
1)Lee Tai Liu、杜鹏等采用 4,5-二甲氧基-2-胺基苯甲酸为起始原料,经过环合、取代等反应合成4-氯喹唑啉[7-8]。该路线条件容易控制,不需要柱色谱来分离,后处理简便。存在不足:原料贵;第2步选择性脱甲氧基收率低;需要进行保护酚羟基和脱保护反应,步骤繁杂。
2)Xing-Ping Liu等报道了喹唑啉类化合物的合成方法[9]。该路线以4,5-二甲氧基-2-硝基苯甲酸为原料,首先与二氯亚砜生成酰氯,再迅速与氨水反应生成酰胺,再使用硼氢化钠和硫酸铜还原,甲酸环合得喹唑啉环,三氯氧磷氯代得到4-氯喹唑啉。此路线有2点缺陷:原料国内无销售,自行制备需多步反应;硼氢化钠价格昂贵;同合成方法1),选择性脱甲氧基收率低,且需要进行保护酚羟基和脱保护反应,步骤繁杂。
3)Venkateshappa Chandregowda 、 Gudapati Venkateswara Rao等以异香兰素为原料,经过取代、硝化、连二亚硫酸钠还原、DMF-DMA加成、环合等反应合成喹唑啉类化合物[10]。此反应改善了还原的方法,该路线中的还原和环合方法新颖,因而具有很好的借鉴意义。其主要缺陷有2点:首先在6-位侧链上已经连接了吗啉基,这样就不能连接别的基团,不利于新化合物的合成;该路线已有专利保护。
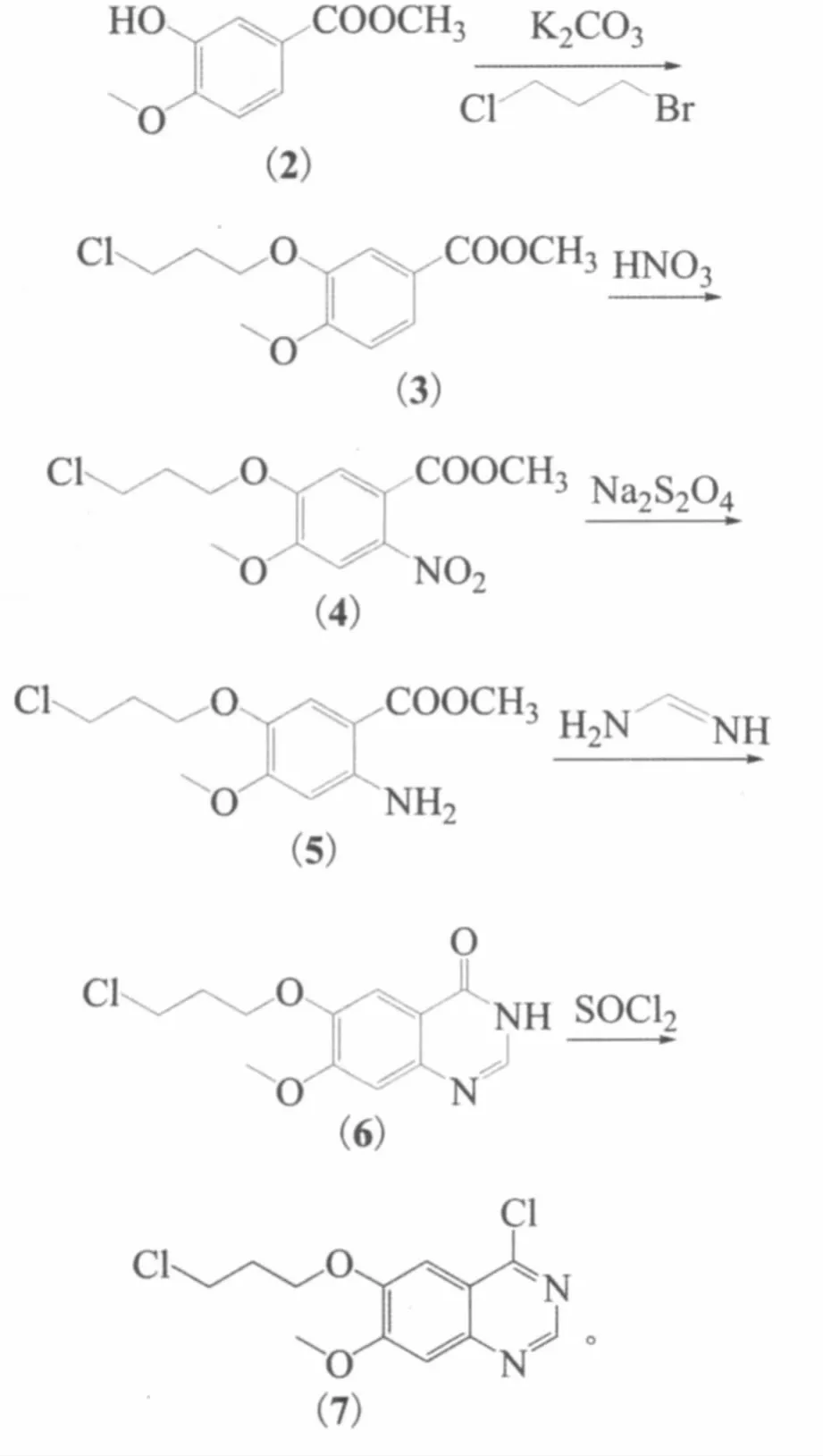
合成4-位具有不同的基团,6-位引入不同的取代基的喹唑啉类酪氨酸激酶抑制剂的方法大多都是先保护羟基,引入4-位基团后再脱保护,步骤比较繁琐。本研究设计了1个新的合成方案,该路线引入3-氯丙氧基,既可以做保护基,又是合成一系列抗癌药的必备基团,缩短了反应路线,反应条件温和、原料经济易得、操作简便,且后处理方便,适合于工业化生产。反应式如下:

1.2 仪器和药品
DF-101S磁力搅拌器;DB30电子天平;三用紫外分析仪;SHI-MADCU高效液相色谱仪(HPLC),进样泵LC-10AT,检测器SPD-10A;Bruker Advance DMX 400型核磁共振仪,400 MHz,四甲基硅烷(TMS)为内标,CDCl3为溶剂;WRS-1B数字熔点仪(温度计未校正)等。
3-羟基-4-甲氧基苯甲酸,1-溴-3-氯丙烷,醋酸脒等,所用试剂均为市场出售化学纯和分析纯,并按要求进行纯化处理。
1.3 制备方法
1.3.1 3-羟基-4-甲氧基苯甲酸甲酯(2)
80 mL甲醇加入250 mL圆底烧瓶中,加入异香草酸 20 g(119 mmol),搅拌下加入硫酸 11.68 g(119 mmol),室温搅拌10 h。蒸干甲醇,剩余物搅拌下加入到少量冰水中(50 mL),乙酸乙酯(50 mL×3)萃取,饱和碳酸钠洗涤酯层,无水硫酸钠干燥,蒸干,静置析晶,得19.9 g类白色固体,收率91.77%。熔点64~67 ℃。
1.3.2 4-甲氧基-3-(3-氯丙氧基)苯甲酸甲酯(3)
在100 mL茄形瓶中加入30 mL N,N-二甲基甲酰胺(DMF),再依次加入 10 g (55 mmol)2,17.3 g(110 mmol)1,3-溴氯丙烷和 11.4 g(83 mmol)无水碳酸钾,75℃反应2.5 h,趁热倒入40 mL冰的稀盐酸中,有乳白色固体析出,抽滤,水洗,干燥得白色固体13.5 g。收率95.1%。熔点52~53.5℃。
1.3.3 2-硝基-4-甲氧基-3-(3-氯丙氧基)苯甲酸甲酯(4)
150 mL三颈瓶插入温度计和冷凝管,加入50 mL 氯仿,搅拌下加入 10 g(39 mmol)3,滴液漏斗滴加由4.06 mL质量分数65%的硝酸和4.88 mL质量分数98%的硫酸配成的混酸溶液,20℃以下反应5 h。将产物加入60 mL冰水中稀释反应液,分去水层,氯仿层用30 mL饱和碳酸氢钠水溶液洗涤,再水洗,无水硫酸钠干燥,蒸干溶剂,静置析晶,得黄色产物10.8 g。收率92.1%。熔点67.5~80.5℃。
1.3.4 2-氨基-4-甲氧基-3-(3-氯丙氧基)苯甲酸甲酯(5)
100 mL三颈瓶插入温度计和冷凝管,加入50 mL 甲醇、水、四氢呋喃(THF)体积比 1:1:1 的混合液,再加入 10 g(33 mmol)4,28.5 g(160 mmol)连二亚硫酸钠,50℃反应2 h,再升温至10℃,3 h内用滴液漏斗滴加质量分数25%的盐酸50 mL,冷却,用质量分数50%的NaOH溶液调pH为10,有淡红色固体产生,抽滤,水洗,干燥得7.03 g。收率78%。熔点 82.5~84.5 ℃,纯度 98.5%(HPLC)。
1.3.5 7-甲氧基-6-(3-氯丙氧基)喹唑啉-4-(3H)-酮(6)
在100 mL茄形瓶中依次加入50 mL无水乙醇,10 g(37 mmol)5 和 9.2 g(90 mmol)醋酸脒,加完以后回流反应2 h,冷却,抽滤,乙醇重结晶,抽滤,干燥得淡黄色固体9 g。收率91.58%。熔点212.5~214.5℃,纯度 97.5%(HPLC)。
1.3.6 4-氯-7-甲氧基-6-(3-氯丙氧基)喹唑啉(7)
在100 mL茄形瓶中加入30 mL氯化亚砜,室温搅拌下慢慢加入10 g(37 mmol)6,再加入3 mL吡啶,回流反应1 h,蒸干氯化亚砜,再倒入50 mL冰水中,静置,有淡黄色固体析出,抽滤,水洗滤饼至中性,干燥得到乳白色固体8.29 g。收率77.6%。熔点206~209 ℃,纯度 99.2%(HPLC),1H NMR(400 MHz,CDCl3)δ:1.991(m,2H,CH2),3.371 (t,2H,J=6.4 Hz,CH2),3.830(s,3H,CH3),4.065(t,2H,J=6 Hz,CH2),7.24(s,1H),7.41(s,1H),9.56(s,1H)。
2 结果与讨论
文献中酚羟基的氧烃化反应按文献处理结果显示产品中杂质多,并未达到文献中的收率,为71%,本研究改进了后处理方法,将反应完的产物倒入冰的稀盐酸中,中和产物中剩余的碳酸钾,该处理方法使收率有较大的提高。
硝化反应按文献方法所得产品是黄色油状物,难以固化,本研究加入乙醇,静置,很快析出淡黄色固体,反应收率高,副产物少,解决了提纯的问题,该后处理具有一定的创新性。
本研究采用连二亚硫酸钠做还原剂,避免了文献中铁粉还原的不足之处,该方法收率提高了15个百分点,时间短、副产物少、设备要求低,可以实现工业化生产。
氯代反应采用氯化亚砜回流反应,加入吡啶做催化剂,与文献方法相比反应时间短,且副产物少,收率也有所提高,为80.8%。
3 结论
以3-羟基-4-甲氧基苯甲酸、1,3-溴氯丙烷等为原料,经过酯化反应、酚羟基的氧烃化反应、硝化反应等步骤合成出结构和作用机制新颖的抗癌药物Gefitinib的关键中间体4-氯-7-甲氧基-6-(3-氯丙氧基)喹唑啉,总收率44.56%。与以往合成方法相比,原料廉价易得、总产率高、操作简便,在合成的每一步反应最大投料量都有500 g以上的批次,反应过程中发现并未出现反应异常,且收率有升高趋势,各步后处理简单易行,为中试工艺的研究打下了良好的基础。
[1]D W Fry,A J Kraker,A McMichael,et al.A Specific Inhibitor of the Epidermal Growth Factor Receptor Tyrosine Kinase[J].Science,1994,265(5175):1093-1095.
[2]Manuel Hidalgo,Lillian L Siu,John Nemunaitis,et al.Phase I and pharmacologic study of OSI-774,an epidermal growt h factor receptor tyrosine kinase inhibitor,in patients with advanced solid malignancies[J].J Clin Oncol,2001,19(13):3267-3279.
[3]Alexander J Bridges,Hairong Zhou,Donna R Cody,et al.Tyrosine Kinase Inhibitors.8.An Unusually Steep Structure-Activity Relationship for Analogues of 4-(3-Bromoanilino)-6,7-dimethoxyquinazoline (PD153035),a Potent Inhibitor of the Epidermal Growth Factor Receptor[J].J Med Chem,1996,39(1):267-276.
[4]Gordon W Rewcastle,William A Denny,Alexander J Bridges,et al.Tyrosine Kinase Inhibitors.5.Synthesis and Structure-Activity Relationships for 4-[ (Phenylmethyl)amino]- and 4-(Phenylamino)quinazolinesasPotent Adenosine 5'-Triphosphate Binding Site Inhibitors of the Tyrosine Kinase Domain of the Epidermal Growth Factor Receptor[J].J Med Chem,1995,38(18):3482-3487.
[5]Schuette W,Nagel S,B1akenburg T,et al.Phase III study of second-Iine chemotherapy for advanced nonsmall cell lung cancer with weekly compared with 3-weekly docetaxel[J].J Clin Oncol,2006,23:8389-8395.
[6]张晓彤,李龙芸,穆新林,等.肺癌分子靶向治-ZD1839(Iressa)在晚期非小细胞肺癌治疗中的应用[J].中国肺癌杂志,2004,8(4):47-50.
[7]Lee Tai Li,Ta-Tung Yuan,Hung-Huang Liu,et al.Synthesis and biological evaluation of substituted 6-alkynyl-4-anilinoquinazoline derivatives as potent EGFR inhibitors[J].Bioorganic&Medicinal Chemistry Letters,2007,22(17):6373-6377.
[8]杜鹏,潘春跃,彭东明.吉非替尼的合成工艺改进[J].中国新药杂志,2006,15(21):1849-1851.
[9]Xing-Ping Liu,Rama Krishna Narla,Fatih M Uckun.OrganicPhenylArsonicAcid Compoundswith Potent Antileukemic Activity[J].Bioorganic&Medicinal Chemistry Letters,2003,13(3):581-583.
[10]Venkateshappa Chandregowda,Gudapati Venkateswara Rao,GoukanapalliChandrasekara Reddy.Convergent Approach for Commercial Synthesis of Gefitinib and Erlotinib[J].Organic Process Research&Development,2007,11(5):813-816.
Research on Synthesis of 4-Chloro-7-Methoxy-6-(3-Chloropropyloxy)Quinazoline
Yang Shaojuan1,Meng Lingqiang2,Li Zhijun1,Zhang Aiqin3,Cao Lihua1
(1.College of Sciences and Technology,Nanchang Hangkong University,Nanchang 330034;2.College of Science,National University of Defense Technology,Changsha 410000;3.College of Environmental and Chemical Engineering,Nanchang Hangkong University,Nanchang 330034)
4-chloro-7-methoxy-6-(3-chloropropyloxy)quinazoline is a key intermediate for quinazoline tyrosine kinase inhibitor Gefitinib and there derivatives synthesis which was realized and reacted starting from 3-hydroxy-4-methoxy-benzoic acid via six steps,including the synthesis of the quinazoline,reasonable protection of hydroxyl and so on.The total yield was 44.56%.Its structure was confirmed by HNMR.The method has mild reaction conditions,easily available raw materials,and simple operation,suitable for industrialized production.
4-chloro-7-methoxy-6-(3-chloropropyloxy)quinazoline;tyrosine kinase inhibitor;synthesis
TQ254.16
A DOI10.3969/j.issn.1006-6829.2012.03.006
2012-03-29;
2012-04-05

