PRRSV XH-GD株Nsp2部分缺失感染性克隆的构建
张民泽,谢杰雄,郭泗虎,王 衡,闫明菲,赵孟孟,黄 震,粟 硕,孙 龙,张桂红
(华南农业大学兽医学院,广东广州510642)
猪繁殖与呼吸障碍综合征(Porcine reproductive and respiratory syndrome,PRRS)是由 PRRS病毒(PRRSV)引起的一种以妊娠母猪严重繁殖障碍以及仔猪的呼吸道症状和高死亡率为特征的高度接触性传染病[1]。Nsp2具有半胱氨酸蛋白酶活性(Cysteine proteinse,Cp),介导Nsp2/Nsp3切割,也是PRRSV感染细胞后最早复制及特异性的蛋白之一,也是Nsp4丝氨酸蛋白酶的辅助因子[2]。不同病毒株间Nsp2编码区差异较大,可能与病毒对细胞或组织的嗜性有关。2006年国内分离的高致病性PRRSV(HP-PRRSV)在其Nsp2编码区第483位和535位~563位存在不连续的30个氨基酸的缺失[3],推测其致病力增强可能与Nsp2区域的缺失有关。但随后有研究证明该缺失与毒力增强无直接关系[4]。相关研究表明Nsp2上的免疫显性表位不是病毒复制所必需,但在宿主的适应性免疫应答反应中起到一定作用[5]。Nsp2半胱氨酸蛋白酶结构域抑制IFN的调节因子IRF-3的激活[6]。这些研究表明,PRRSV Nsp2缺失型病毒株在感染动物机体的过程中发挥一定的作用。
本实验在PRRSV XH-GD Nsp2编码区缺失部分氨基酸序列,构建Nsp2部分缺失株的全长cDNA的重组质粒,并对拯救的重组病毒进行鉴定,进而研究这些缺失区域对病毒复制的影响。
1.3 Nsp2蛋白部分缺失区域的选择 根据序列比对分析表明Nsp2的321位~530位处于Nsp2可耐受插入或缺失突变等操作的中间高变区,同时该位置包括了自然29+1个氨基酸不连续缺失中的480位缺失,以及3个最新鉴定的抗原表位,为了解Nsp2该区域的生物学特性,选择出下列区域进行缺失研究。缺失位置如图1所示:

1.4 引物的设计及合成 在本实验室构建的DNA-launched的反向遗传操作平台-PRRSV XH-GD株全长感染性克隆的基础上进行引物的设计[7]。应用Primer Premier 5.0软件设计引物用于扩增缺失部位的上游和下游片段(表1),对A1片段进行改造。引物由上海英骏生物技术有限公司合成。
1 材料和方法
1.1 病毒株、菌株、细胞及相关载体 美洲型HP-PRRSV XH-GD株、Marc-145细胞和BHK细胞均由本实验室保存;感受态细胞DH5α购自天根生化科技(北京)有限公司;低拷贝载体pOKq、含有部分PRRSV基因片段的重组质粒pJET-CMV-A1、pJET-A2(q)、pOK-BCD(c)及 PRRSV全长 cDNA的重组质粒pOK-A2BCD由本实验室制备保存。
1.2 主要试剂 RNA提取试剂TRIzolRReagent、platinumRpfx DNA聚合酶、SuperscriptTMⅡ反转录酶、platinum R pfx DNA聚合酶、RNaseH(RNA酶H)、RNase OUT RNA酶抑制剂、TRIzol R Reagent和脂质体DMRIE-C和脂质体lipofectamine 2000均购自Invitrogen公司;DNA Marker及LA PCRTMKit Ver.2.1均购自TaKaRa公司;限制性内切酶及T4DNA连接酶均购自NEB公司;DNA纯化试剂盒E.Z.N.A.TMGel Extraction Kit和质粒快速提取试剂盒E.Z.N.A.TMPlasmid M ini Kit购自Omega公司;Clone JET PCR Cloning Kit购自Fermentas公司;Opti-MEM I无血清培养基购自Gibco公司;抗美洲型PRRSV M蛋白的单克隆抗体(MAb)由中国农业科学院上海兽医研究所惠赠。

表1 设计引物用以改造A1片段Table 1Primer design for fragment A1reconstruction
1.5 pOK-Aa、pOK-Ab、pOK-Ac质粒的构建基因缺失片段A1a、A1b及A1c上下游片段的扩增,回收后进行融合PCR扩增,回收纯化产物与pJET 1.2Blunt Vector载体进行连接,测序正确后从菌液提取重组质粒,将双酶切后回收纯化的产物A1a、A1b、A1c基因片段与A2及pOKq进行连接,使用NEB T4DNA连接酶对得到的双酶切产物进行连接,转化,测序鉴定。
1.6 Nsp2部分缺失全长质粒的构建 用限制性内切酶 NotⅠ和 AflⅡ对 pOK-Aa、pOK-Ab、pOK-Ac及pOK-BCD进行酶切,将双酶切后回收纯化的产物Aa、Ab、Ac基因片段分别与同样酶切处理的pOK-BCD进行连接,连接产物进行NotⅠ-HFTM单酶切鉴定,并分别将构建的感染性克隆转染BHK-21细胞进行病毒拯救[8]。
1.7 拯救病毒的稳定性分析及RT-PCR鉴定 将拯救病毒连续在Marc-145细胞中传至12代,并对1、3、6、9、12代进行TCID50测定。通过设计与合成鉴别引物进行PCR扩增测序鉴定。鉴别引物:F:5'-GTTCCTGAGCTTGGGGTGCT-3'; R: 5'-CGAAT TTCTTTGTACTGAAC-3'
1.8 间接免疫荧光试验(IFA)检测 利用BHK-21细胞转染后上清接种Marc-145细胞按常规方法进行IFA检测,一抗为美洲型MAb M蛋白1∶100倍稀释,二抗为1∶1000稀释FITC标记的羊抗鼠抗体,同时设正常的细胞作空白对照。
2 结果
2.1 A1a、A1b、A1c上下游片段的扩增、融合及测序结果 以质粒pJET-CMV-A1为模板,采用上述6对引物分别对A1a、A1b、A1c基因片段的上下游进行PCR扩增,分别得到目的片段长度分别约为 :A1a, 2800bp、 720bp、 3500bp(图 2A);A1b 2800bp、1000bp、3800bp(图 2B);A1c,3100bp、720bp、3900bp(图2C),均与预期大小相符,测序结果显示与设计缺失位点一致。
2.2 pOK-Aa、pOK-Ab、pOK-Ac重组质粒的构建 将重组质粒pJET-A1a、pJET-A1b、pJET-A1c分别用NotⅠ-HFTM、XhoⅠ进行双酶切后得到大约为2800bp的pJET1.2/blunt载体片段和约3500bp的A1a片段、约3800bp的A1b和A1c片段,与预期大小相符,将pJET-A2进行XhoⅠ/AflⅡ双酶切,得到约为2800bp的pJET 1.2/blunt载体片段和3100bp的A2目的片段,与预期大小相符,鉴定为阳性的菌液由上海英潍捷基生物技术有限公司进行测序,测序正确的重组质粒分别命名为pOK-Aa、pOK-Ab、pOK-Ac。
2.3 Nsp2部分缺失全长cDNA质粒的构建 将重组质粒pOK-BCD用NotⅠ-HFTM、AflⅡ进行双酶切,得到约为11kb的BCD片段,与预期大小相符(图3a)。将重组质粒pOK-Ab用NotⅠ-HFTM、AflⅡ进行双酶切,获得约为7000bp的Ab与大约1800bp的pOK载体片段,与预期大小相符(图3b)。将二者连接转化后抽提质粒,通过NotⅠ-HFTM进行单酶切,得到约为18kb的目的片段,与预期大小相符(图3c)。同时,鉴定为阳性的菌液由上海英潍捷基生物技术有限公司进行测序,测序正确的重组质粒分别命名为pOK-AaBCD、pOK-AbBCD和pOKAcBCD。

2.4 转染细胞上清接种Marc-145细胞的病变结果将构建的PRRSV XH-GD株Nsp2部分缺失的全长cDNA质粒克隆pOK-AbBCD转染BHK-21细胞3d后收取细胞上清,离心后分别接种Marc-145细胞。其中,pOK-AbBCD的转染细胞上清接种Marc-145细胞72h后开始出现细胞病变(CPE)。而pOKAaBCD、pOK-AcBCD及正常细胞对照组均无CPE,亲本病毒株出现明显的CPE,将该拯救病毒命名为XH-GD-Δ105。
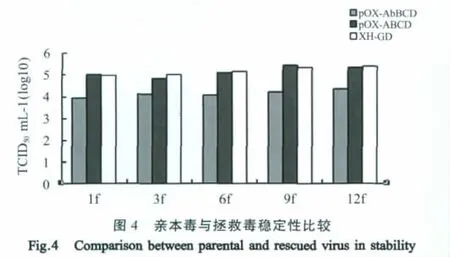
2.5 XH-GD-Δ105的稳定性及与亲本毒TCID50比较 取XH-GD-Δ105和未缺失拯救病毒及亲本毒接种Marc-145细胞进行体外传代,对1代、3代、6代、9代、12代细胞病毒液进行TCID50测定,亲本病毒、未缺失拯救毒和XH-GD-Δ105病毒滴度比较情况如图4,XH-GD-Δ105病毒滴度明显低于亲本毒及未缺失拯救毒,而后两者几乎保持一致。
2.7 拯救病毒的IFA鉴定 亲本病毒和拯救病毒分别接种Marc-145细胞进行IFA检测。结果显示,接种XH-GD-Δ105第一代及亲本毒PRRSV XH-GD的细胞可被M蛋白MAb所识别,有特异性的荧光产生,而对照组细胞未见荧光(图6)。

2.6 拯救病毒的RT-PCR鉴定 利用鉴别引物对在Marc-145细胞中3代、6代、9代、12代的拯救病毒进行鉴定,并设亲本病毒株XH-GD做阳性对照。拯救病毒及亲本病毒扩增片段分别约为750bp,与预期大小相符。与亲本病毒XH-GD相比,拯救病毒的3代、6代、9代、12代在510位核苷酸位点突变与沉默突变设计相符,该位点突变后引入酶切位点FseⅠ(GGCCGGCC),与预期结果一致。利用限制性内切酶FseⅠ对拯救病毒的第12代进行酶切鉴定(图5),可见约540bp和200bp的目的片段,与预期结果一致。

3 讨 论
Nsp2是PRRSV中变异性最高并且最具有免疫原性的多结构域蛋白[9],目前已鉴定Nsp2至少具有4个功能区[10]。Nsp2中间的高变区具有耐受插入、缺失、突变的能力。同时,Nsp2具有多个抗原表位[11]。本研究PRRSV Nsp2缺失位置为320位~530位,该位置包括自然缺失的第481及29个氨基酸自然缺失前的部分区域,并且包括了385D~D394,452P~S466,467P~S477等3处抗原表位,为了解PRRSV在自然缺失后能否在缺失前位置发生进一步的缺失,以及在缺失多个抗原表位后其生长特性及免疫原性的变化,进行了该区域的缺失研究。
由于本实验所构建的PRRSV XH-GD株Nsp2部分缺失的感染性克隆能够在体外Marc-145细胞中复制,拯救毒XH-GD-Δ105在Marc-145细胞中能够稳定传代,表明了Nsp2的320位~424位氨基酸处存在缺失对于PRRSV XH-GD的复制是非必需的,不会影响其体外的增殖。同时其病毒滴度明显低于亲本株,表明该缺失区域对于病毒的毒力可能存在一定影响,然而Nsp2编码区这105个氨基酸的缺失是否会对亲本株毒力造成影响,还需要后续进行动物实验进行进一步研究。由于本实验设计的pOKAaBCD是在Nsp2的321位~530位氨基酸处存在缺失,覆盖了pOK-AbBCD的Nsp2编码区缺失的320位~424位氨基酸位点及pOK-AcBCD的Nsp2编码区缺失的435位~530位氨基酸位点,而实验中pOK-AaBCD及pOK-AcBCD这两个全长重组质粒没有拯救出来,与Han等针对VR2332株Nsp2进行不同部位的缺失,发现在324位~523位,324位~726位等处缺失能够拯救出病毒的结果不一致[12],这可能是由于存在病毒株特异性。另外,本研究中缺失位点从320位开始,相比VR2332缺失来说本研究缺失位置更接近保守区序列,因此可能与所设计的pOK-AcBCD的Nsp2编码区缺失的435位~530位氨基酸位点和高变区前保守序列共同影响有关,该缺失区域及前列保守区是否含有与病毒复制相关的必需因子还有待于进一步研究。
本研究构建基于亲本病毒株PRRSV XH-GD的3个Nsp2部分缺失的全长cDNA质粒,分别命名为pOK-AaBCD、pOK-AbBCD和 pOK-AcBCD,由于XH-GD-Δ105在Nsp2编码区的320位~424位氨基酸存在缺失,但这一缺失区域并没有影响到病毒的复制,表明这一区域对病毒的复制是非必需的。
[1]Oleksiewicz M B,Botner A,Toft P,et al.Epitope mapping porcine reproductive and respiratory syndrome virus by phage display:the Nsp2fragment of the replicase polyprotein contains a cluster of B-cell epitopes[J].J Virol,2001,75(7):3277-3290.
[2]Fang Ying,Snijder E J.The PRRSV replicase:exploring the multifunctionality of an intriguing set of nonstructural proteins[J].Virus Res,2010,154(1-2):61-76.
[3]Tong Guang-zhi,Zhou Yan-jun,Hao Xiao-fang,et al.Highly pathogenic porcine reproductive and respiratory syndrome,China[J].Emerg Infect Dis,2007,13(9):1434-1436.
[4]Zhou Lei,Zhang Jia-long,Zeng Jing-wen,et al.The 30-am inoacid deletion in the Nsp2of highly pathogenic porcine reproductive and respiratory syndrome virus emerging in China is not related to its virulence[J].JVirol,2009,83(10):5156-5167.
[5]Chen Zhen-hai,Zhou Xiao-xin,Lunney JK,et al.Immunodominant epitopes in Nsp2of porcine reproductive and respiratory syndrome virus are dispensable for replication,but play an important role in modulation of the host immune response[J].J Gen Virol,2010,91(4):1047-1057.
[6]Li Hong-xia,Zheng Zhen-hua,Zhou Peng,et al.The cysteine protease domain of porcine reproductive and respiratory syndrome virus non-structural protein 2antagonizes interferon regulatory factor 3activation[J].JGen Virol,2010,91(12):2947-2958.
[7]吴欣伟,熊永忠,秦宏阳,等.猪繁殖与呼吸综合征病毒XH株感染性克隆的构建[J].中国预防兽医学报,2011(2):97-100.
[8]Nia Y Y,Huanga Y W,Caoa D J,et al.Establishment of a DNA-launched infectious clone for a highly pneumovirulent strain of type 2porcine reproductive and respiratory syndrome virus:Identification and in vitro and in vivo characterization of a large spontaneous deletion in the Nsp2region[J].Virus Res,2011,160(1-2):264-273.
[9]Oleksiewicz M B,Botner A,Toft P,Normann P,et al.Epitopemap-ping porcine reproductive and respiratory syndrome virus by phage display:the Nsp2fragment of the replicase polyprotein contains a cluster of B-cell epitopes[J].J Virol,2001,75:3277-3290.
[10]Music N,Gagnon C A.The role of porcine reproductive and respiratory syndrome(PRRS)virus structural and non-structural proteins in virus pathogenesis[J].Anim Health Res Rev,2010,11(2):135-163.
[11]Yan Yu-lin,Guo Xin,Ge Xin-na,et al.Monoclonal antibody and porcine antisera recognized B-cell epitopes of Nsp2protein of a Chinese strain of porcine reproductive and respiratory syndrome virus[J].Virus Res,2007,126(1-2):207-215.
[12]Han Jun,Liu Gong-ping,Wang Yue,et al.Identification of nonessential regions of the Nsp2replicase protein of porcine reproductive and respiratory syndrome virus strain VR-2332for replication in cell culture[J].JVirol,2007,81(18):9878-9890.

