抑制牛乳房炎嗜酸乳杆菌的筛选和抑菌物质的研究
肖 蒙,孟昭旭,杨晓春,杜 鹏,霍贵成
(东北农业大学,乳品科学教育部重点实验室,黑龙江哈尔滨150030)
乳房炎主要是指一种由致病菌通过乳房导管进入乳房内不断繁殖而导致的炎症[1-2]。当奶牛分泌的牛奶中体细胞数超过200,000个/mL时,就可以诊断此牛患有乳房炎[3]。据世界奶牛协会统计,全世界约有2.2亿头奶牛,乳房炎的发病率在50%左右,其中牛临床型乳房炎患病率为2%,隐性乳房炎高达50%[4-5],每年由乳房炎造成的直接经济损失约为350亿美元[6]。奶牛发生乳房炎不仅可造成产奶量下降10%~15%[7]、乳汁pH升高、奶中营养成分显著降低,而且还严重影响奶及奶制品的食品安全,因为奶牛患乳房炎后所产的乳汁中含有大量的炎症因子、致病菌和毒素[8]。致病菌是导致乳房炎的主要因素,国内外很多学者就导致牛乳房炎的致病菌种类进行了研究,结果发现:引起乳房炎的病原微生物多达150多种,但最常见的约有20多种,其中主要以无乳链球菌为主,其次是停乳链球菌、乳房链球菌、金黄色葡萄球菌和大肠杆菌等[9]。现在治疗乳房炎一般均采用抗菌药特别是抗生素乳房内灌注方法,抗生素不仅能引起病原微生物产生耐药性[10],使通过抗生素治疗乳房炎的难度越来越大,更重要的是造成了抗生素在牛奶中大量残留,从而引起食用者产生过敏反应、皮疹、哮喘、休克甚至死亡[11]。近年来,国外有很多学者对乳酸菌治疗乳房炎进行了研究,乳酸菌是益生菌的重要组成部分,它不仅能在人体肠道等重要部位发挥益生功能[12-13],而且不会让致病菌产生耐药性,安全性高,这主要是因为乳酸菌产生的H2O2[14],有机酸,如乙酸、丙酸、乳酸等[15]和抗生素或细菌素类物质具有较强的杀菌作用[16-18]。所以本文以乳酸菌的抑菌作用为理论基础,研究6株嗜酸乳杆菌及其代谢产物中的抑菌成分:细菌素、H2O2、有机酸分别对导致牛乳房炎的4株主要致病菌:无乳链球菌、乳房链球菌、大肠杆菌和金黄色葡萄球菌的抑制效果,从而得出6株乳酸菌的各种代谢产物对各致病菌的抑菌活力,以及各乳酸菌产生的细菌素和H2O2在何种环境下才能更好的发挥抑菌作用,为将来用乳酸菌的抑菌代谢产物治疗牛乳房炎,乃至适当取代抗生素和治疗更多由致病菌引起的疾病奠定理论基础。
1 材料与方法
1.1 材料与仪器
菌种 嗜酸乳杆菌KLDS L2、KLDS L6、KLDS AD1、KLDS AD2、KLDS AD3和NCFM;无乳链球菌ATCC 13813、乳房链球菌、大肠杆菌ATCC 25922、金黄色葡萄球菌ATCC 25923 乳品科学教育部重点实验室乳品工业微生物菌种保藏中心(KLDSDICC);THB培养基 青岛高科园海博生物技术有限公司,牛肉粉10g/L、胰蛋白胨20g/L、葡萄糖2g/L、碳酸氢钠2g/L、氯化钠2g/L、磷酸氢二钾0.4g/L;MRS肉汤培养基 广东环凯微生物科技有限公司,酪蛋白酶消化物10g/L、牛肉膏粉10g/L、酵母膏粉4g/L、柠檬酸三铵2g/L、乙酸钠5g/L、硫酸镁0.2g/L、硫酸锰0.05g/L、磷酸氢二钾2g/L、葡萄糖20g/L、吐温-80 1.08g/L;LB培养基 胰蛋白胨10g/L、酵母提取物5g/L、氯化钠10g/L;固体培养基 添加2%琼脂;细菌基因组DNA提取试剂盒 天根生化科技有限公司。
UV-2401PC紫外分光光度计 日本岛津。
1.2 实验方法
1.2.1 16S rDNA菌种的鉴定和致病菌的生长曲线的制备 对无乳链球菌ATCC 13813(编号M1,下同)、乳房链球菌(M2)、大肠杆菌ATCC 25922(M3)、金黄色葡萄球菌ATCC 25923(M4)4株菌种进行16SrDNA鉴定,防止菌种出现误差。
将M1、M2分别接种在THB液体培养基中,37℃条件下培养,每隔1h取样,将M3、M4分别接种在LB液体培养基中,37℃条件下培养,每隔3h取样,都在600nm下测OD值,然后以OD值为纵坐标,时间为横坐标做出各个致病菌的生长曲线图。最后根据生长曲线,取稳定期的菌株进行稀释平板计数。
1.2.2 乳酸菌酸度曲线的描绘 将6株乳酸菌按照2%接种量分别接种在MRS液体培养基中,每4h取样滴定酸度,测发酵液的pH,最后以时间为横坐标,pH为纵坐标描绘乳酸菌的酸度曲线图。
1.2.3 乳酸菌无细胞上清液的制备和各上清液抑菌能力的研究 将6株嗜酸乳杆菌KLDS L2、KLDS L6、KLDS AD1、KLDS AD2、KLDS AD3和NCFM分别编号为H2、H3、H4、H5、H6、H7,分别接种到MRS液体培养基中,37℃培养48h,10000g,4℃条件下离心20min,再用0.22μm的滤膜过滤得到乳酸菌无细胞上清液[19]。
将500μL的105CFU/mL致病菌的稀释液涂布在各自最适固体培养基上,水平放置在4℃冰箱中12h,使培养基完全吸收掉稀释液,然后进行牛津杯抑菌实验,在牛津杯中注入200μL的乳酸菌无细胞发酵上清液,每组3个平行,最后将其放在37℃培养箱培养8h,观察此牛津杯琼脂扩散抑菌实验是否产生抑菌圈[20],并用游标卡尺测量抑菌圈的直径(减去牛津杯直径),得到数据,做出柱状图,由此判断各乳酸菌对各致病菌的抑菌性强弱。
1.2.4 温度对乳酸菌无细胞上清液的影响 将乳酸菌无细胞上清液在80℃条件下水浴15min,然后用牛津杯法进行抑菌实验(方法同1.2.3)。并将实验数据与1.2.3各菌株原上清液的抑菌数据比较,做出柱状图,确定温度对上清液中抑菌活性物质的影响。
1.2.5 H2O2酶对乳酸菌无细胞上清液抑菌性的影响向上清液中加入H2O2酶,使其终浓度达到1mg/mL,在37℃条件下温浴2h,用此上清液做抑菌实验(方法同1.2.3),并将实验数据与1.2.3各菌株原上清液的抑菌数据比较,做出柱状图,确定上清液中H2O2的抑菌效果。
1.2.6 胃蛋白酶、胰蛋白酶、蛋白酶K对乳酸菌无细胞上清液的影响 在乳酸菌无细胞上清液中依次加入胃蛋白酶、胰蛋白酶、蛋白酶K干粉,使各蛋白酶的终浓度达到1mg/mL,然后在37℃条件下温浴2h,做抑菌实验(方法同1.2.3),并将实验数据与1.2.3各菌株原上清液的抑菌数据比较,确定上清液中细菌素类物质的抑菌效果。
1.2.7 不同pH条件对乳酸菌无细胞上清液中抑菌活性物质的影响 用高浓度的乳酸和NaOH溶液将各上清液的pH调节为2.0、3.0、4.0、5.0、6.0、7.0,最后用牛津法进行抑菌实验(方法同1.2.3),确定不同pH对上清液中抑菌活性物质的影响。
2 结果与讨论
2.1 16S rDNA菌种鉴定结果和致病菌生长曲线
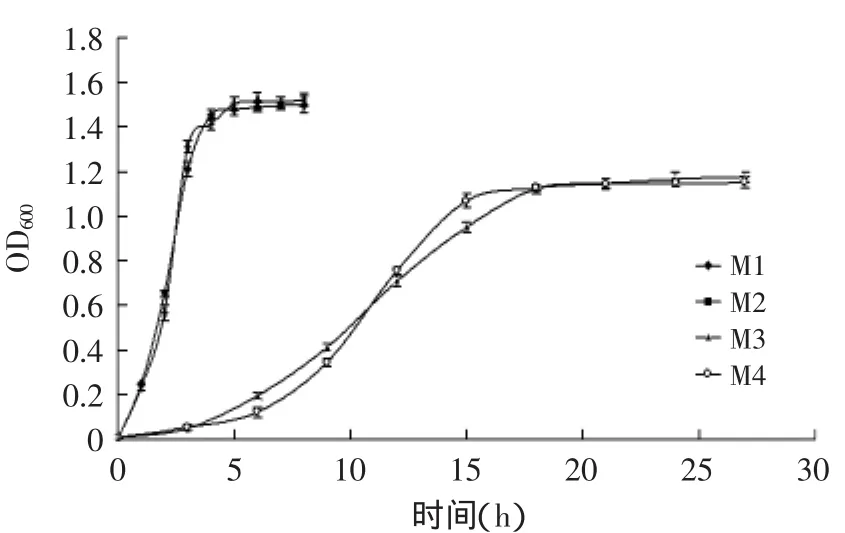
图1 4株致病菌生长曲线Fig.1 The growth curve of 4 strains of pathogenic bacteria
16S rDNA菌种鉴定结果表明,各菌株为编号所对应的菌株,菌种无差错。如图1所示为M1、M2、M3、M4这4株致病菌的生长曲线图,可见,M1、M2开始生长迅速,但由于培养基中营养物质的消耗,代谢产物的积累等负面因素的影响,最终在5h左右时达到最大OD值1.50左右,到达稳定期,同理,M3、M4在18h左右达到最大OD值1.10左右,到达稳定期,所以分别在此时间点取样进行稀释涂布计数,结果表明,M1、M2能达到3.0×108CFU/mL,M3、M4达到2.1×107CFU/mL。
2.2 乳酸菌酸度曲线描绘
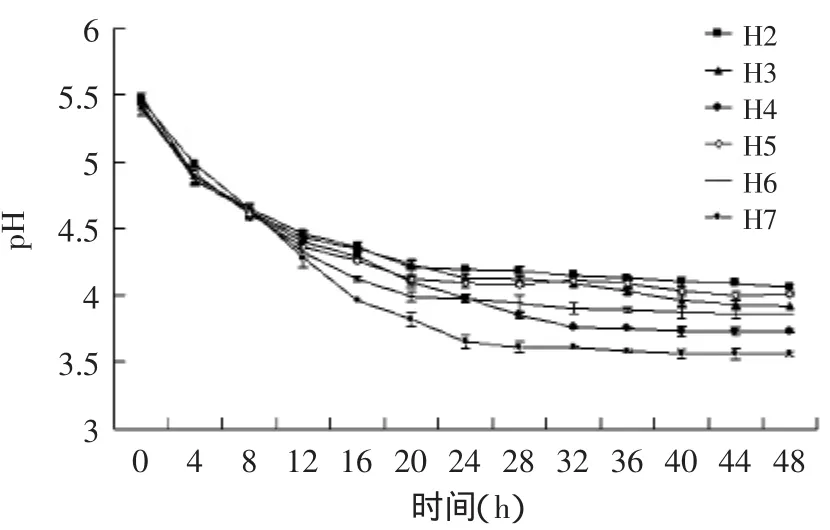
图2 6株乳酸菌的酸度曲线图Fig.2 The acidity curve of 6 strains of lactic acid bacteria
6株嗜酸乳杆菌的酸度曲线图如图2所示,可见6株菌基本随着发酵的不断进行,培养基中的糖被乳酸菌分解成为有机酸,从而使pH不断降低,基本都在24h后达到最低pH,但H6、H4、H7最终pH较低,其中H7最低,达到了3.50。
2.3 各乳酸菌上清液抑菌能力
如图3(a)所示,各乳酸菌上清液对M1抑菌活性大小:H7>H3>H6>H4>H5>H2;同理,图3(b)表明,在抑制M2方面,抑菌活性大小:H7>H4>H6>H3>H2>H5;图3(c)表明,在抑制M3方面,抑菌活性大小:H7>H3>H6>H5>H4>H2;图3(d)表明,在抑制M4方面,抑菌活性大小:H7>H2>H6>H5>H4>H3。影响上清液抑菌活性的物质主要是有机酸、细菌素和H2O2,所以以上上清液的抑菌活性是三种抑菌物质共同作用的结果,综合而言,H7对4株致病菌的抑菌效果最好,抑菌圈直径都达到a、b、c、d的最大值,特别是对M3和M4效果最显著,数值分别达到14.13mm和12.76mm,H6对4株致病菌的抑制效果良好,结合实验1.2.2,这可能与H7、H6较强的产酸能力有关,同时,6株乳酸菌普遍都对M4的抑制效果显著,抑菌圈直径都基本超过9.00mm。
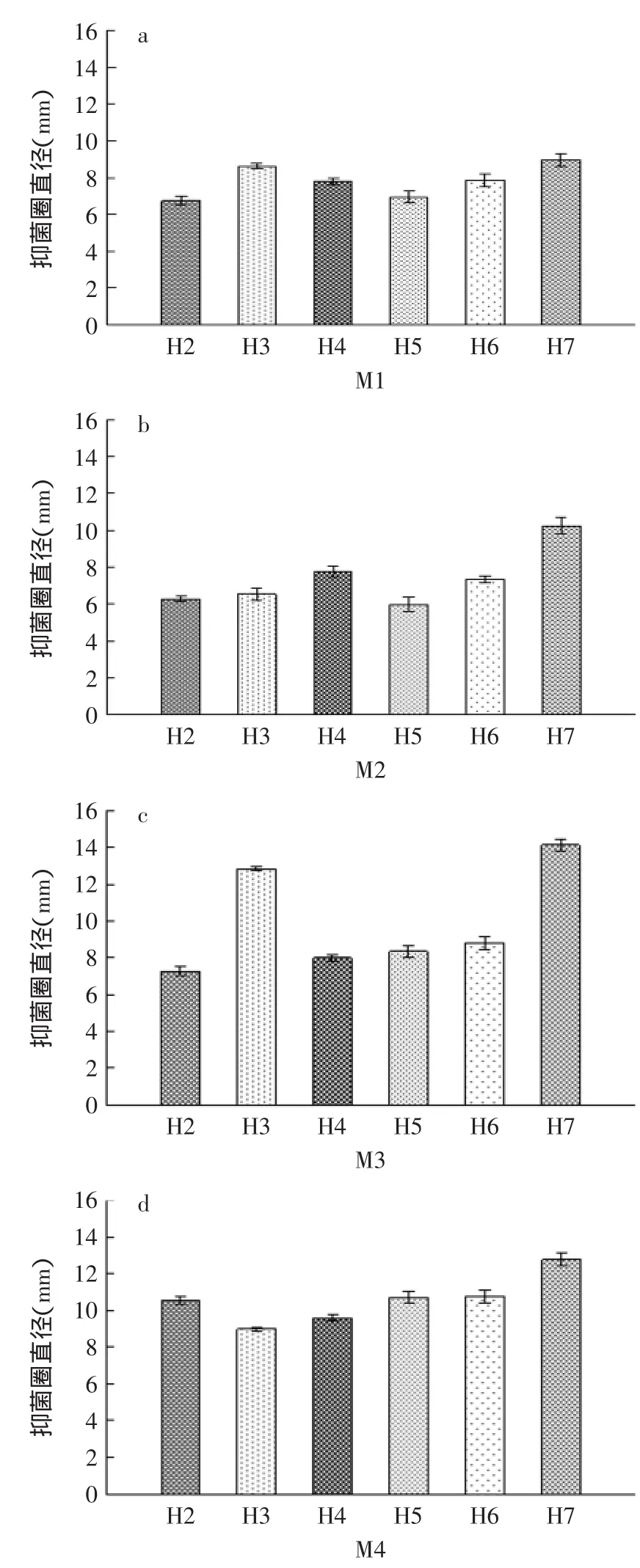
图3 6株乳酸菌上清液对4株致病菌抑菌效果Fig.3 The inhibitory effect of 6 strains of lactic acid bacteria supernatant fluid on 4 strains of pathogenic bacteria
2.4 温度对乳酸菌上清液抑菌能力影响
经高温处理之后的上清液对各致病菌的抑菌效果如图4中的h2~h7(编号为:H2~H7的嗜酸乳杆菌经处理后在图中标示为:h2~h7以方便区分,图4~图6同)所示,将这些柱状图与图3进行对比,得到图4。
图4(a)表明,高温处理对各乳酸菌上清液抑菌活性(M1)影响大小:H5>H6>H4>H3>H7>H2;同理,图4(b)表明,高温处理对各乳酸菌上清液抑菌活性(M2)影响大小:H4>H2>H5>H7>H3>H6;图4(c)表明高温处理对各乳酸菌上清液抑菌活性(M3)影响大小:H5>H7>H4>H2>H3=H6;图4(d)表明,高温处理对各乳酸菌上清液抑菌活性(M4)影响大小:H5>H4>H6>H3>H2>H7。综上所述,高温对H5上清液的抑菌活性影响最大,处理后的H5的抑菌圈直径缩小值在a、c、d中都达到最大,在b中也达到0.50mm,但处理后的H3在a、b、c中对各致病菌抑菌圈直径影响较小,分别为0.19、0.20、0.26mm,这可能主要是由于H5、H3抑菌活性产物分别热敏性较高和耐热力较强的缘故。
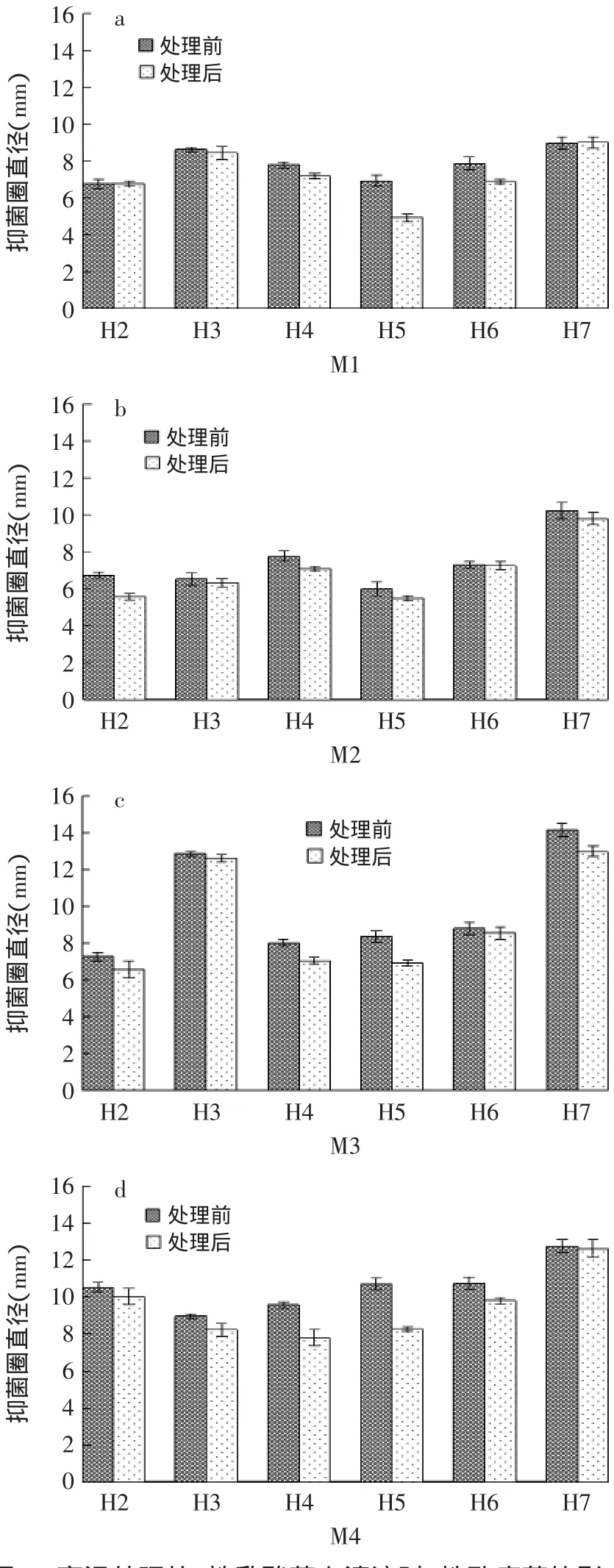
图4 高温处理的6株乳酸菌上清液对4株致病菌的影响Fig.4 The effect of 6 strains of lactic acid bacteria supernatant fluid processed by high-temperature on 4 strains of pathogenic bacteria
2.5 H2O2酶对乳酸菌上清液抑菌性影响
经H2O2酶处理之后的上清液对各致病菌的抑菌效果如图5中的h2~h7所示,将这些柱状图与图3进行对比,得到图5。
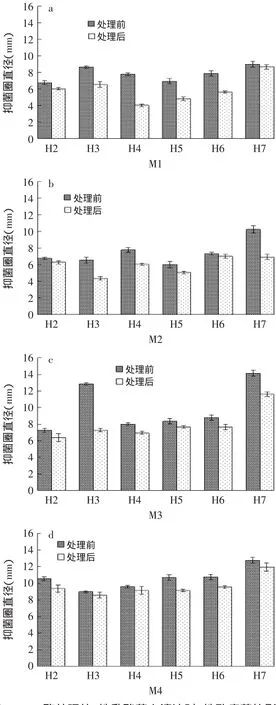
图5 H2O2酶处理的6株乳酸菌上清液对4株致病菌的影响Fig.5 The effect of 6 strains of lactic acid bacteria supernatant fluid processed by H2O2enzyme on 4 strains of pathogenic bacteria
如图5(a)所示,H2O2酶处理对各乳酸菌上清液抑菌活性(M1)影响大小:H4>H6>H5>H3>H2>H7;同理,图5(b)表明,H2O2酶处理对各乳酸菌上清液抑菌活性(M2)影响大小:H7>H3>H4>H5>H6>H2;图5(c)表明,H2O2酶处理对各乳酸菌上清液抑菌活性(M3)影响大小:H3>H7>H5>H6>H4>H2;图5(d)表明,H2O2酶处理对各乳酸菌上清液抑菌活性(M4)影响大小:H6>H3>H2>H4>H7>H5。由图5可见,6株乳酸菌经过H2O2酶处理之后,抑菌活性都降低了,这是由于乳酸菌产生的具有抑菌作用的代谢产物H2O2被H2O2酶分解的缘故,可以通过此方法鉴定各乳酸菌产H2O2能力,以及H2O2对不同致病菌的杀菌能力,上述结果表明:处理后的H3对M2、M3、M4抑菌圈直径分别降低了2.20、6.47、1.46mm,在b、c、d中抑菌活性降低程度很大,但其他乳酸菌产生的H2O2对4株致病菌的抑菌活力差异性较大,这可能是由于不同乳酸菌产生的H2O2量不同,同时H2O2对不同致病菌具有不同抑制性的缘故。
2.6 胃蛋白酶、胰蛋白酶、蛋白酶K对乳酸菌上清液影响
经各种蛋白酶处理之后的上清液对各致病菌的抑菌效果如图6中的h2~h7所示,将这些柱状图与图3进行对比,得到图6。
如图6(a)表明,蛋白酶处理对各乳酸菌上清液抑菌活性(M1)影响大小:H6>H4>H2>H3>H5>H7;同理,图6(b)表明,蛋白酶处理对各乳酸菌上清液抑菌活性(M2)影响大小:H3>H5>H4>H7>H6>H2;图6(c)表明,蛋白酶处理对各乳酸菌上清液抑菌活性(M3)影响大小:H3>H7>H5>H6>H2>H4;图6(d)表明,蛋白酶处理对各乳酸菌上清液抑菌活性(M4)影响大小:H5>H6>H2>H7>H3>H4。经过各种蛋白酶处理的上清液的抑菌活性都明显降低,这是由于乳酸菌产生的蛋白质类细菌素代谢产物被蛋白酶分解的缘故,所以,可以通过此方法鉴定乳酸菌产细菌素量。综合而言,处理后的H3对M2、M3的抑菌圈直径缩小值分别为1.62、3.47mm,在b、c中都为最大值;处理后的H5对M2、M4的抑菌圈直径缩小值分别为1.33、1.58mm,在b、d中抑菌活性降低程度很大,图6也充分说明同一株乳酸菌产生的细菌素对不同的致病菌抑菌性有明显的差异,可见在利用细菌素治疗乳房炎之前对其致病菌进行鉴定,然后进行有针对性的治疗。
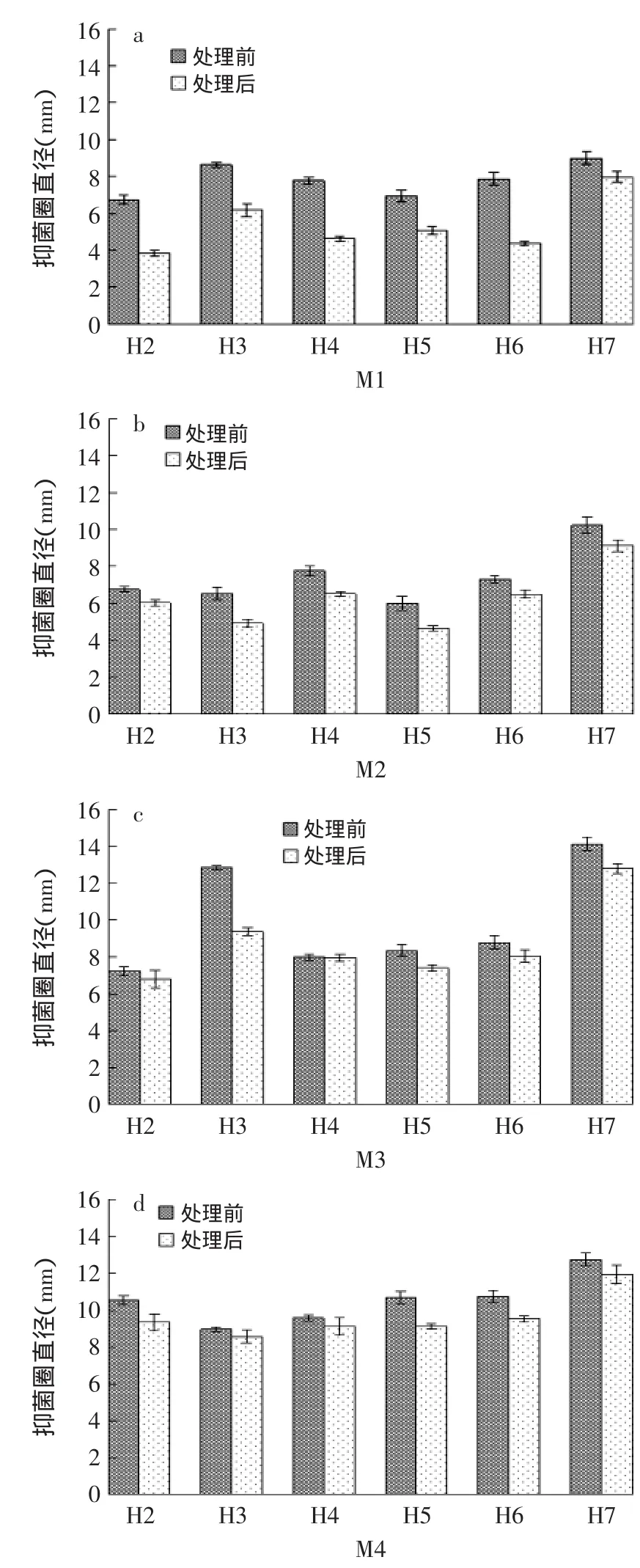
图6 蛋白酶处理的6株乳酸菌上清液对4株致病菌的影响Fig.6 The effect of 6 strains of lactic acid bacteria supernatant fluid processed by protease on 4 strains of pathogenic bacteria
2.7 不同pH条件对乳酸菌上清液中抑菌活性物质的影响
H2~H7的上清液经在不同pH条件下对4种致病菌的抑菌效果图7~图10所示:随着pH不断降低,上清液的抑菌能力不断增强,特别是当pH≤3.5左右时,随着pH降低,各乳酸菌上清液抑菌能力增幅较大,可见pH对上清液的抑菌能力影响很大;但当pH≥5时,H2和H4的上清液对部分致病菌已无抑菌性。同时只有H3、H5、H6、H7在pH=6.0、7.0时,还具有一定的抑菌能力,这说明各菌产生的细菌素和H2O2在酸性环境下才能更好的发挥抑菌作用。
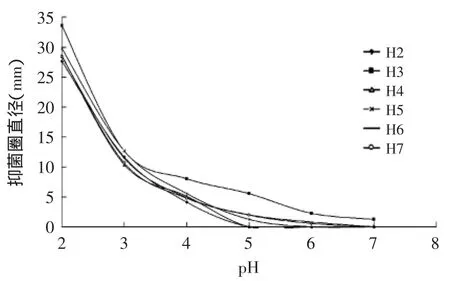
图7 不同pH条件下6株乳酸菌上清液对M1抑制效果Fig.7 The inhibitory effect of 6 strains of lactic acid bacteria supernatant fluid on M1 in different pH conditions
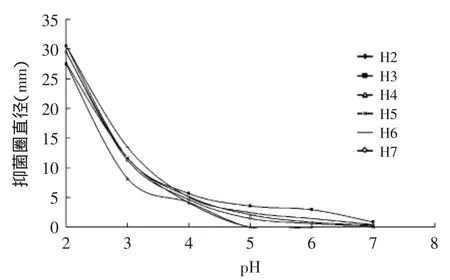
图8 不同pH条件下6株乳酸菌上清液对M2抑制效果Fig.8 The inhibitory effect of 6 strains of lactic acid bacteria supernatant fluid on M2 in different pH conditions
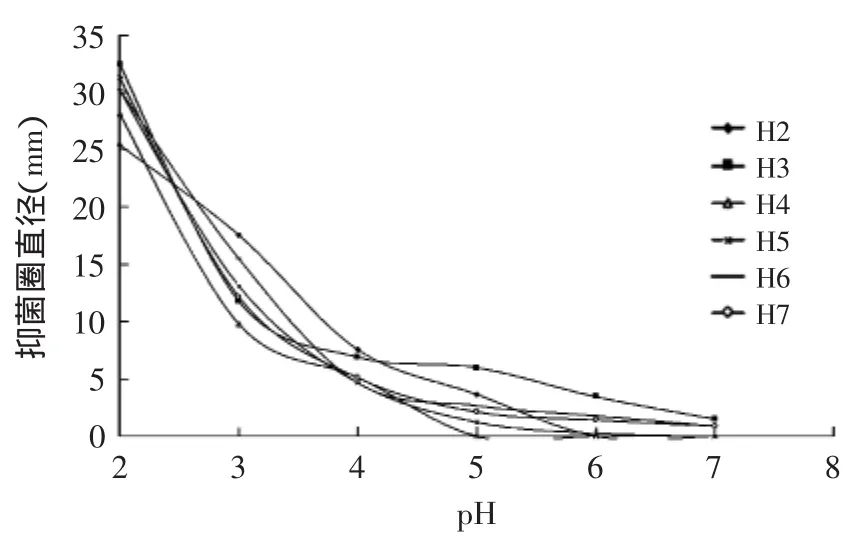
图9 不同pH条件下6株乳酸菌上清液对M3抑制效果Fig.9 The inhibitory effect of 6 strains of lactic acid bacteria supernatant fluid on M3 in different pH conditions
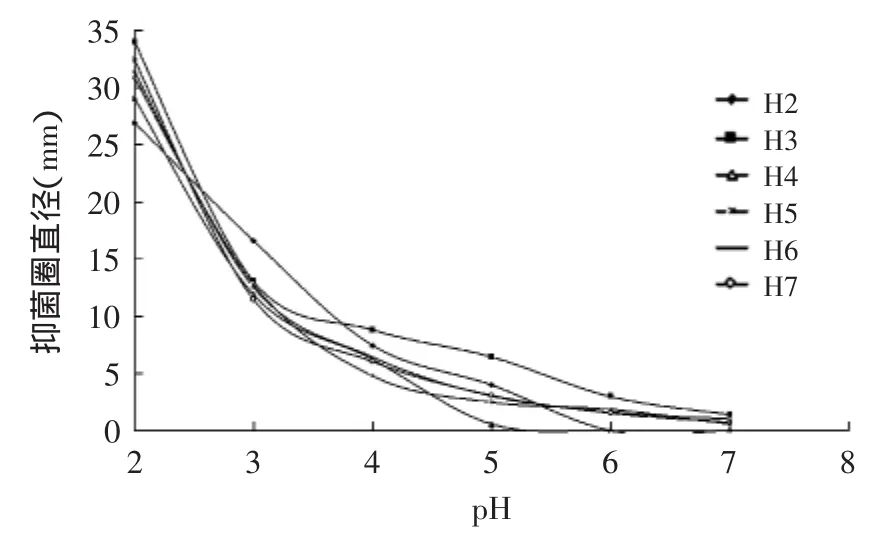
图10 不同pH条件下6株乳酸菌上清液对M4抑制效果Fig.10 The inhibitory effect of 6 strains of lactic acid bacteria supernatant fluid on M4 in different pH conditions
3 结论
3.1 由于造成乳房炎的致病菌以及不同乳酸菌分泌的抑菌物质对同一株致病菌抑制作用都存在差异,所以以各株致病菌为标准,分析不同上清液对同一株致病菌的影响。结果表明,6株嗜酸乳杆菌都能对4株导致牛乳房炎的致病菌特别是金黄色葡萄球菌起到明显的抑制效果,其中NCFM(H7)对4株致病菌抑制效果最好,KLDS AD3(H6)良好,又由于这两株菌产生的细菌素和H2O2抑菌活力一般,结合酸度曲线图,所以这与二者具有较强的产酸能力有重要关系。
3.2 KLDS AD3(H6)细菌素对M1无乳链球菌抑菌效果最好;KLDS AD2(H5)细菌素对M4金黄色葡萄球菌抑制效果最好,同时,KLDS AD2(H5)的抑菌代谢产物热敏性最高;KLDS L6(H3)细菌素类物质对M2乳房链球菌、M3大肠杆菌抑菌效果最好,且其抑菌活性物质耐热能力较强,保持适当的酸性环境有利于提高抑菌活性物质的抑菌能力。
3.3 由于不同地区,不同环境,造成牛乳房炎的致病菌种类存在差异性,所以治疗之前鉴定出主要的致病菌,然后筛选出对特定致病菌抑制效果较好的乳酸菌上清液或单一的抑菌活性物质进行治疗,将会使治疗更加具有针对性,从而达到更好的治疗效果。
[1]Dego OK,Van Dijk JE,Nederbragt H.Factors involved in the early pathogenesis of bovine Staphylococcus aureus mastitis with emphasis on bacterial adhesion and invasion[J].Vet Quart,2002,24:181-198.
[2]Bannerman DD,Paape MJ,Lee JW,et al.Escherichia coli and Staphylococcus aureus elicit differential innate immune responses following intramammary infection[J].Clin Diagn Lab Immunol,2004,11:463-472.
[3]Harmon RJ.Physiology of mastitis and factors affecting somatic cell counts[J].J Dairy Sci,1994,77:2103-2112.
[4]Heringstad B,Klemetsdal G,Ruane J.Clinical Mastitis in Norwegian Cattle:Frequency,Variance Components,and Genetic Correlation with Protein Yield[J].J Dairy Sci,1999,82:1325-1330.
[5]Gill R,Howard WH,Leslie KE,et al.Economics of mastitis control[J].J Dairy Sci,1990,73:3340-3348.
[6]Giraudo JA,Calzolari A,Horacio R,et al.Field trials of a vaccine against bovine mastitis.1.evaluation in heifers[J].J Dariy Sci,1997,80:845-853.
[7]胡士明.对奶牛乳房炎发病机制的新认识及临床处理对策的探讨[J].中国奶牛,1998(4):40-41.
[8]陈家璞.奶牛疾病学[M].北京:农业出版社,1992:283.
[9]伍义行,黄利权.奶牛乳房炎防治的免疫学和药理学机制[J].中国兽医杂志,2003,39(3):40-44.
[10]Duarte RS,Bellei BC,Miranda OP,et al.Distribution of antimicrobial resistance and virulence-related genes among Brazilian group B streptococci recovered from bovine and human sources[J].Antimicrob Agents Ch,2005,49:97-103.
[11]吴国娟,沈红,周德刚,等.市售消毒纯牛奶中抗菌药物残留的检测[J].北京农学院学报,2002,17(2):33-37.
[12]Rodriguez-Palacios A,Staempfli HR,Duffield T,et al.Isolation ofbovine intestinalLactobacillusplantarum and Pediococcus acidilactici with inhibitory activity against Escherichia coli O157 and F5[J].J Appl Microbiol,2009,106:393-401.
[13]Sun P,Wang JQ,Zhang HT.Effects of Bacillus subtilis natto on performance and immune function of preweaning calves[J].J Dairy Sci,2010,93:5851-5855.
[14]Juven BJ,Weisslowicz H,Harel S.Detectition of hydrogen peroxide produced by meat lactic starter cultures[J].J Appl Bacteriol,1988,65:357-360.
[15]Sorrells KM,Speck ML.Inhibition of Salmonella gallinarum by culture filtrates of Leuconostoc citrovorum[J].J Dairy Sci,1970,53:239-241.
[16]Fuller R.Probiotics in man and animal[J].J Appl Bacteriol,1989,66:365-378.
[17]Reid G,McGroarty JA,Angotti R,et al.Lactobacillus inhibitor production against Escherichia coli and coaggregation ability with uropathogens[J].Can J Microbiol,1988,34:344-351.
[18]Juven BJ,Meinersmann RJ,Stern NJ.A REVIEW:Antagonistic effect of Lactobacilli and Pediococci to control intestinal colonization by human enteropathogens in live poultry[J].J Appl Microbiol,1991,70:95-103.
[19]Zhang YC,Zhang LW,Du M,et al.Antimicrobial activity against Shigella sonnei and probiotic properties of wild lactobacilli from fermented food[J].Microbiol Res,2011:167:27-31.
[20]Rammelsberg M,Radler F.Antibacterial polypeptides of Lactobacillus species[J].J Appl Microbiol,1990,69:177-184.

