β-1,3-1,4-葡聚糖酶在毕赤酵母中的克隆与表达
陈龙军,陈济琛,陈亚兰,林戎斌,林新坚,*
(1.福建省农业科学院土壤肥料研究所,福建福州350000;2.厦门大学化学化工学院,福建厦门361005)
β-1,3-1,4-D-葡聚糖,是一种由D型β-葡萄糖苷通过β-1,3和β-1,4糖苷键连接而成的线性多糖;β-葡聚糖作为一种非结构性淀粉多糖,广泛存在于高等植物的细胞壁中,如谷物类的大麦、小麦、燕麦、水稻等[1]。它有可溶性与非可溶性之分,可溶性β-葡聚糖在液体中具有高黏性、高亲水性、高的吸水膨胀力和持水性、高吸附性;基于上述特性,给含有β-葡聚糖谷类作物的实际应用带来一些负面影响。如在制造麦芽汁过程中,由于大量高分子β-葡聚糖存在,致使麦芽汁粘度增大,过滤困难;在发酵过程中过量的β-葡聚糖还会与蛋白质结合,使酵母早期沉淀。饲料工业中发现,存在于饲料中的β-葡聚糖由于自身的种种限制因素(高粘性、高亲水性、高吸水活性及离子吸附性等)影响营养物质在动物体内的代谢,从而降低饲料的转化率[2-3]。因此,β-1,3-1,4-葡聚糖酶作为专一、高效降解β-1,3-1,4-D-葡聚糖的一类酶,对解决含葡聚糖的谷类作物的工农业应用遇到的问题,起到至关重要的作用。目前国内外已克隆和表达了多种不同来源β-1,3-1,4-葡聚糖酶基因[4-6],并且国外已经实现了工业化。而国内对β-葡聚糖酶的研究虽取得了相当的进步,但是在工业化工程中仍然存在一些问题,如酶产量、稳定性、及比活力等制约了其应用。本研究旨在构建筛选出β-1,3-1,4-D-葡聚糖酶毕赤酵母基因工程菌,提高酶活力及其热稳定性、酸碱稳定性,为葡聚糖酶的工业化应用奠定基础。
1 材料与方法
1.1 实验材料
大肠杆菌(Escherichia coli)JM109、含β-1,3-1,4-葡聚糖酶基因的质粒pLF3 均由厦门大学化学化工学院化工系卢英华老师课题组惠赠;Pichia pastoris X-33(毕赤酵母)、质粒pPICZαA Invitrogen公司;β-1,3-1,4-葡聚糖(地衣多糖) Sigma公司(St.louis,MO);PCR试剂、限制性内切酶、Taq DNA聚合酶、标准蛋白 TAKARA产品;质粒提取试剂盒、凝胶回收试剂盒 广州东盛生物科技有限公司;博来霉素 上海贝基生物科技有限公司;蛋白胨、酵母粉、YNB 上海生物工程技术服务有限公司;LB培养基 用于培养大肠杆菌;YPDS、BMGY/BMMY 用于培养诱导毕赤酵母;以上培养基具体配方 见Invitrogen公司的毕赤酵母操作手册[7]。
1.2 实验方法
1.2.1 β-1,3-1,4-葡聚糖酶基因扩增 以经密码子优化合成的全基因glucanase为模板,在该基因两端分别引入两个酶切位点,EcoR I、Not I,设计一对引物如下:
BGL1:5’-CG GAATTC ATGAAACGAGTGTTG CT-3’
BGL2:5’-AAA GCGGCCGC ATTGCTCGTATAT TTTA-3’
PCR反应体系(50μL):10×PCR缓冲液5μL,MgCl2(25mmol/L)3μL,dNTP(10mmol/L)1mL,两条引物各1μL,模板1μL,Taq酶(10000U/mL)1μL,ddH2O 37μL。PCR反应程序如下:a.95℃ 4min;b.94℃ 1min、55℃ 1min、72℃ 1min;c.重复步骤b 30次;d.72℃ 10min;e.4℃保存。PCR产物经过1.0%琼脂回收预期大小的片段。与pMD-T-18载体连接,转化入大肠杆菌JM109感受态细胞,涂布在含氨苄青霉素LB平板上,挑选阳性克隆,提质粒进行测序验证,得pMD18-T-bgl。
1.2.2 毕赤酵母重组表达质粒的构建 将获得的pMD18-T-bgl用EcoR I和Not I进行双酶切,回收目的片段,并与同样经过EcoR I和Not I双切的载体pPICZαA进行16℃过夜连接,连接产物转化感受态大肠杆菌JM109,涂布于含25μg/mL博来霉素的低盐LB平板,37℃过夜培养后。挑选阳性克隆子提取质粒进行测序,并用EcoR I和Not I进行双酶切验证。
1.2.3 毕赤酵母重组菌的构建及筛选 取构建好的重组表达载体pPICZαA-bgl 20μL,经限制性内切酶Sac I在37℃下酶切16h,然后将酶切产物用无水乙醇沉淀,溶于10μL无菌水,加入到80μL毕赤酵母GS115感受态细胞,冰浴5min,在1500V电压(25μF)条件下电击转化,迅速加入1mL 1mol/L的山梨醇,转移到15mL空的无菌离心管中于30℃摇床下静置培养2~3h,然后混匀分别适量涂布于含有100μg/mL博来霉素的YPDS抗性平板,30℃倒置培养2~4d,直至长出清晰菌落;随机挑取若干个单克隆,提取酵母基因组DNA进行PCR验证是否转化成功。
1.2.4 重组毕赤酵母X-33摇瓶诱导表达 将转化的毕赤酵母阳性克隆子,接种于25mL BMGY培养基中培养24h后,离心收集菌体,加入25mL BMMY培养基后于30℃、250r/min继续培养,每12h补加体积浓度为0.5%的甲醇,并取样,离心得上清,即为粗酶液;测定β-1,3-1,4-D-葡聚糖酶活力(DNS法[8])。酶的活力单位定义为:pH5.0,温度为50℃下,每分钟催化产生1μmol还原糖(葡萄糖)所需要的酶量,即为1U。
1.2.5 表达产物SDS-PAGE电泳 采用分离胶浓度12%,浓缩胶5%的SDS-PAGE,发酵液加入5×上样缓冲液,沸水浴10min后上样20μL进行电泳,参照文献[9]进行。
1.2.6 β-1,3-1,4-葡聚糖酶的最适反应温度测定在不同温度下条件下按照常规法测定酶活力,以测得的最高酶活力为100%,其余条件下测得的酶活力换算成相对酶活。
1.2.7 β-1,3-1,4-葡聚糖酶对温度的稳定性测定在酶液50、60、70、80℃分别保温30、60、90、120、150min,冷却至室温,按照常规法测定残余酶活力,以未保温酶液的酶活力为100%。
1.2.8 β-1,3-1,4-葡聚糖酶的最适反应pH测定 在不同pH缓冲液中按常规法测定酶活力,以测得的最高酶活力为100%,其余条件测得的酶活力换算成相对酶活。
1.2.9 β-1,3-1,4-葡聚糖酶对pH的稳定性测定 将酶液与不同pH得缓冲液50℃下保温1h,冷却至室温,测定酶活,以处理前测得的酶活力为100%。
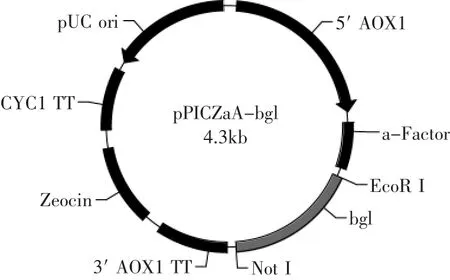
图1 重组质粒pPICZαA-bglFig.1 The constructed plasmid of pPICZαA-bgl
2 结果与分析
2.1 β-1,3-1,4-glucanase基因的获取
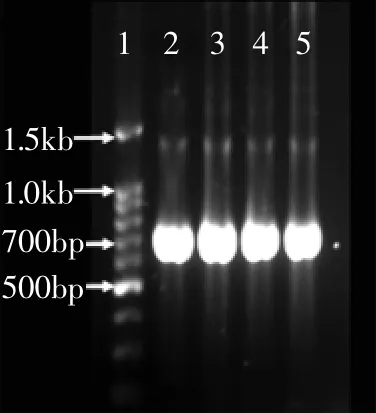
图2 β-1,3-1,4-glucanase基因扩增产物Fig.2 PCR product of β-1,3-1,4-glucanase gene
经过引物BGL1/BGL2扩增得到的阳性条带大小在700bp左右,如图2所示,与目的基因glucanase的大小(717bp,编码239个氨基酸)基本相符,测序验证,至此成功获得bgl基因。
2.2 重组表达载体的构建
将pMD18-T-bgl和载体pPICZαA分别经EcoR I和Not I双酶切,回收相应片段,连接产物转化大肠杆菌JM109,挑取转化子扩增并抽提质粒。将抽提的质粒经EcoR I和Not I双酶切,得到了700bp左右和3600bp左右的条带(见图3),证实bgl基因成功插入载体pPICZαA,将重组质粒命名为pPICZαA-bgl。
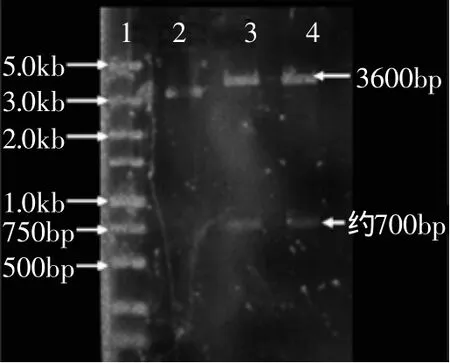
图3 双酶切验证重组质粒pPICZαA-bglFig.3 Identification of pPICZαA-bgl by digested with EcoR Iand Not I
2.3 毕赤酵母的转化和重组菌株的验证
利用重组质粒pPICZαA-bgl上的AOX序列与毕赤酵母基因组上的同源序列进行重组,进而把外源基因整合入酵母染色体上。先用内切酶Sac I对重组质粒进行线性化,然后通过电转化方法转化感受态毕赤酵母细胞X-33。涂布于含100μg/mL博来霉素的YPDS琼脂平板培养基进行初步筛选。随机挑取若干菌株,用液氮破碎法提取酵母基因组作为模板,分别以AOX基因的引物(5’AOX1/3’AOX1)和bgl的引物(BGL1/BGL2)进行PCR验证,如图4所示,3~6泳道分别是以转化子基因组为模板,泳道3引物AOX1/AOX2得两个片段,分别为1300bp和2200bp,泳道4BGL1/BGL2为750bp,泳道5AOX1/BGL2为1200bp,泳道6 BGL1/AOX2为800bp左右,而泳道2以原始菌株X-33基因组为模板,引物为AOX1/AOX2得片段2200bp,均与预期大小一致,至此重组毕赤酵母构建成功,命名为X-33/pPICZαA-bgl。
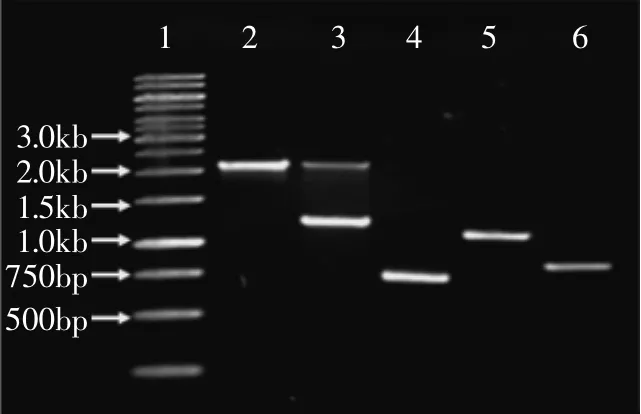
图4 PCR分析毕赤酵母阳性转化子Fig.4 PCR analysis of the positive transformants
2.4 重组毕赤酵母X-33摇瓶诱导表达
挑取表达菌株接种于25mL BMGY的培养基中,30℃振荡培养约24h,离心收集菌体,用含0.5%的甲醇的新鲜BMMY培养基重悬菌体,诱导表达。每隔12h取样,测定酶活力及湿重,其产酶曲线如图5所示。由图5可知,在摇瓶发酵中,经甲醇诱导96h酶活力达到308.5U/mL,湿重为89.5g/L;96h之后产酶速率趋于平缓。因此甲醇诱导96h为最佳诱导时间。
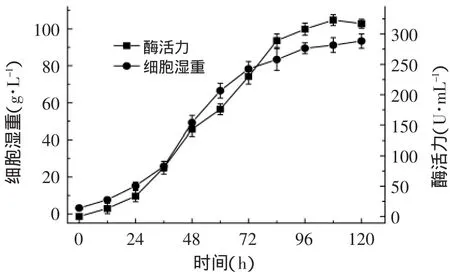
图5 β-1,3-1,4-葡聚糖酶的诱导表达Fig.5 Expression of β-1,3-1,4-glucanase
2.5 SDS-PAGE电泳检测表达产物
发酵液上清(用TCA法浓缩10倍)溶于5×上样缓冲液,SDS-PAGE检验,结果见图6。从图6中可见在约33ku有一条带,而阴性对照中没有相应条带。此条带与β-1,3-1,4-葡聚糖酶理论分子量(26.6ku)相比稍大,究其原因可能是蛋白表达过程中引起毕赤酵母的糖基化作用,导致目的蛋白比理论分子量偏大。
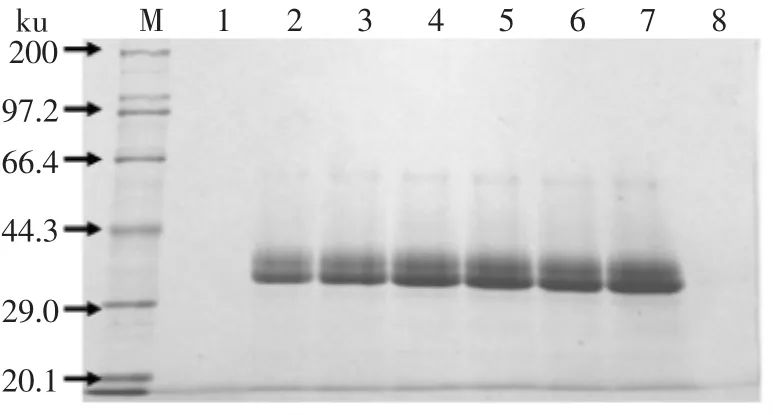
图6 重组X-33表达产物SDS-PAGE电泳结果Fig.6 SDS-PAGE analysis of recombinant P.pastoris X-33 culture supernatant
2.6 β-1,3-1,4-葡聚糖酶的稳定性
2.6.1 温度对β-1,3-1,4-葡聚糖酶的影响 从图7中可看出,在不同温度条件下,当低于50℃时,酶活力随着温度的增加而增加;当温度达到50℃时,相对酶活力达到最高;当温度大于50℃,酶活力逐渐下降;高于55℃时,酶活力下降显著。由此可知,该酶的最适反应温度为50℃,在40~55℃之间具有较高的酶活性。
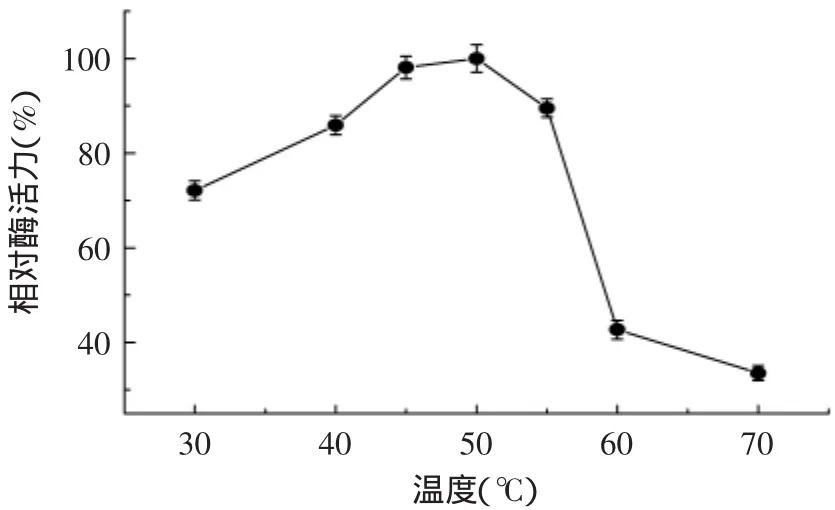
图7 温度对β-1,3-1,4-葡聚糖酶活性的影响Fig.7 Effect of temperature onβ-1,3-1,4-glucanase activity
2.6.2 葡聚糖酶的热稳定性 由图8可看出,葡聚糖酶在50~80℃范围内分别保温不同时间内的酶活力的变化趋势基本一致,均逐步下降;随着温度的增加和储存时间的延长,酶活力损失逐渐增大,然而在50℃下保温150min后,相对酶活仍达到95.4%,而70℃下保温30min酶活下降至38.5%,因此该酶在50℃下具有较好的热稳定性。
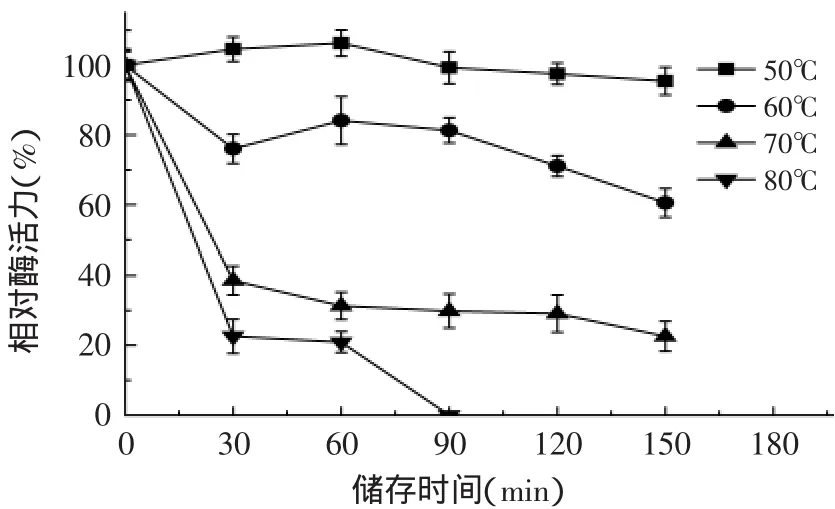
图8 温度对β-1,3-1,4-葡聚糖酶稳定性的影响Fig.8 Effect of temperature on β-1,3-1,4-glucanase stability
2.6.3 pH对β-1,3-1,4-葡聚糖酶的影响 pH对酶活的影响如图9所示,葡聚糖酶活力在pH5.0时达到最大值。在pH4.5~6.0范围内相对酶活力均高于65%;当pH大于6.0后,酶活力迅速下降;pH7时,酶活力只有31.1%,说明碱性条件下酶活性较低。
2.6.4 葡聚糖酶对不同pH的耐受性 β-1,3-1,4-葡聚糖酶经不同的酸碱处理1h后,结果如图10所示。在pH3~7之间酶活力均能保持在80%以上,由此可见,在不同的酸碱条件下酶均能保持较好的稳定性。
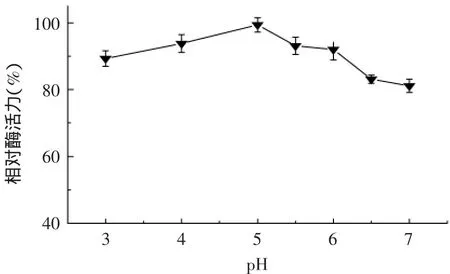
图10 温度对β-1,3-1,4-葡聚糖酶稳定性的影响Fig.10 Effect of temperature on β-1,3-1,4-glucanase stability
3 结论与讨论
β-葡聚糖酶作为一种重要的工业用酶,其应用已扩展到酿酒工业、饲料工业、医药纺织等各个领域中,具有广阔的应用前景。β-1,3-1,4-葡聚糖酶基因在原核大肠杆菌中已有表达研究的报道[10-11],本研究运用真核表达系统,对β-1,3-1,4-葡聚糖酶的进一步进行密码子偏好性优化,运用基因工程手段成功实现了其在毕赤酵母系统中的高效分泌表达,其初筛的摇瓶酶活力高达308.5U/mL,比优化密码子前活力提高了近3倍,诱导时间为96h;经SDS-PAGE电泳,实际蛋白分子量约为33ku,比理论分子量稍大,究其原因可能是该基因的四个糖基化位点(Asn56-Cys-Thr,Asn63-Val-Ser,Asn89-Arg-Ser,Asn210-Gly-Thr),引起毕赤酵母的糖基化作用,从而导致目的蛋白比理论分子量偏大。此外,对酶学性质进行了初步探讨,该酶最适反应温度为50℃,最适反应pH为5.0,在酸性条件下具有较好的稳定性。
毕赤酵母作为高效表达外源蛋白的表达系统,高密度发酵是其重要特点,而且其胞外分泌的杂蛋白少,有利于后期目的蛋白的分离纯化。今后将对该工程菌进行摇瓶及发酵罐放大优化,探索目的蛋白纯化工艺,为中试及后期应用奠定基础。此外,考虑到甲醇型毕赤酵母在生产上的安全性问题及其产品在食品应用方面的局限性,对酵母生产及产品分离纯化提出了更高要求;为消除甲醇影响、拓展葡聚糖酶应用、简化生产工艺及提高生产效率,后期将考虑以组成型毕赤酵母为实验菌,用甘油替代甲醇实现葡聚糖酶的生产。
[1]Shin T,Takahisa Y,Takuji T,et al.Functional characterization of barley betaglucanless mutants demonstrates a unique role for CslF6 in(1,3;1,4)-β-D-glucan biosynthesis[J].Journal of Experimental Botany,2012,63(1):381-392.
[2]N Mathlouthi,N Ballet,M Larbier,et al.Influence of Betaglucanase Supplementation on Growth Performances and Digestive Organs Weights of Broiler Chickens Fed Corn,Wheat and Barley-based Diet[J].International Journal of Poultry Science,2011,10(2):157-159.
[3]杨培龙,姚斌,范云六.饲料用非淀粉多糖水解酶转基因植物的研究进展[J].中国生物工程杂志,2005,25(9):29-34.
[4]Fatma C,Fatma B,Monia B S,et al.Potential application of two thermostable lichenases from a newly isolated Bacillus licheniformis UEB CF:Purification and characterization[J].Process Biochemistry,2012,47(3):509-516.
[5]Hiroyuki T,Tomoko S,Naoki S,et al.Sugar treatment inhibits IAA-induced expression of endo-1,3:1,4-β-glucanase EI transcripts in barley coleoptile segments[J].Physiologia Plantarum,2010,139(3):413-420.
[6]Tang YB,Yang SQ,Yan QJ,et al.Purification and Characterization of a Novel β-1,3-1,4-Glucanase(Lichenase)from ThermophilicRhizomucormieheiwith High Specific Activity and Its Gene Sequence[J].Agricultural and food chemistry,2012,60(9):2354-2361.
[7]陈苗,商汉桥.毕赤酵母表达操作手册[M].美国:Invitrogen出版社,2002.
[8]Borriss R,Buettner K,Maentsaelae P.Structure of the beta-1,3-1,4-glucanase gene ofBacillus macerans:homologies to other beta-glucanases[J].Mol Gen Genet,1990,222:278-283.
[9]Christian R,Ronald K,Veronika J,et al.SDS-PAGE of recombinantand endogenous erythropoietins:benefits and limitations of the method for application in doping control[J].Drug Testing and Analysis,2009,1(1):43-50.
[10]程志敬,邓旭,卢英华,等.重组大肠杆菌发酵生产β-1-3,1-4-葡聚糖酶培养基优化研究[J].工业微生物,2006(2):29-33.
[11]刘征,程志敬,何宁,等.重组大肠杆菌发酵生产β-葡聚糖酶工艺条件研究[J].厦门大学学报,2009(1):95-100.

