液化液代替液化糖生产林可霉素的研究
胡彪群,王筱兰*,钟益清,肖永梅
(1.江西师范大学生命科学学院,江西南昌330022;2.江西国药有限责任公司,江西南昌330052)
0 引言
林可霉素又称洁霉素,是林肯链霉菌发酵过程中产生的次级代谢产物,具有抗革兰氏阳性菌的能力,主要作用于敏感菌核糖体的50S亚基,达到阻止肽链延长的目的,从而抑制细菌细胞蛋白质合成[1-3].林可霉素与其他抗生素没有交叉耐药性,本身毒性较低,因此,林可霉素及其衍生物被广泛用于医疗卫生行业,是国内外制药企业重点生产的抗生素[4-6].
目前,林可霉素发酵多采用液化糖,液化糖主要由企业自己生产,通过α-淀粉酶和糖化酶水解淀粉所得[7],主要成分为还原糖.液化液是液化糖生产的中间产物,主要成分为糊精和低聚糖.淀粉要彻底糖化需多种水解酶、更多酶量、更长降解时间,因此,成本提高了.本文比较研究2种不同淀粉水解产物对林可霉素生产的影响,以期实现林可霉素生产成本降低和生产周期缩短的目标.
1 材料与方法
1.1 试剂与仪器
FUS-50L(A)自控发酵罐(上海国强生化工程装备有限公司);Eclipse E200光学显微镜(日本Nikon公司);WZZ-2S数字式自动旋光仪(上海精密科学仪器有限公司).
豆饼粉、液化液、液化糖等发酵原材料均由江西国药有限责任公司提供;其他化学试剂均为分析纯.
1.2 菌种
Streptomyces lincolnensis 13由江西国药有限责任公司提供.
1.3 培养基
斜面培养基(质量体积比):黄豆饼粉0.60%,可溶性淀粉1.50%,琼脂1.80%,MgSO4·7H2O 0.05%,NaCl 0.05%,KH2PO40.05%,KNO30.01%,pH值为7.0~7.5.
种子培养基(质量体积比):黄豆饼粉1.80%,可溶性淀粉1.50%,葡萄糖1.60%,玉米浆2.00%(体积比),CaCO30.50%,(NH4)2SO40.30%,pH 值为7.0~7.5.
摇瓶培养基(质量体积比):黄豆饼粉1.80%,可溶性淀粉1.50%,葡萄糖6.00%,玉米浆1.50%(体积比),NaNO30.70%,(NH4)2SO40.80%,NaCl 0.50%,KH2PO40.05%,CaCO30.50%,pH 值为7.0~7.5.
15 L发酵罐基础培养基(质量体积比):黄豆饼粉2.00%,可溶性淀粉1.50%,葡萄糖3.50%,玉米浆1.50%,NaCl 0.40%,(NH4)2SO40.80%,KH2PO40.10%,CaCO30.50%,泡敌 0.03%~0.04%(体积比),豆油0.02%~0.03%(体积比),pH值为7.0~7.5.
50 L实验发酵罐基础培养基(质量体积比):黄豆饼粉2.00%,液化液6.00%,玉米浆1.50%(体积比),NaCl 0.50%,(NH4)2SO40.20%,KH2PO40.02%,CaCO30.80%,泡敌0.03%~0.04%(体积比),豆油0.02%~0.03%(体积比),pH值为7.0~7.5.
50 L对照发酵罐基础培养基(质量体积比):黄豆饼粉2.00%,液化糖6.00%,玉米浆1.50%(体积比),NaCl 0.50%,(NH4)2SO40.20%,KH2PO40.02%,CaCO30.80%,泡敌0.03%~0.04%(体积比),豆油0.02%~0.03%(体积比),pH值为7.0~7.5.
1.4 培养方法
斜面孢子培养:将菌种从沙土管中接到斜面培养基于30℃恒温培养7 d.
发酵种子培养:将斜面孢子悬浮液接种到装有30mL种子培养基的250mL摇瓶中,于220 r·min-1、30 ℃恒温培养2 d.
摇瓶发酵:将10%接种量接种于装有50mL发酵培养基的250mL 摇瓶中,于220 r·min-1、30 ℃恒温培养7 d.
15 L发酵罐上发酵:将10%摇瓶接种量接种于15 L发酵罐中,进行二级扩大培养,30℃恒温培养2 d,罐压为0.03~0.05 MPa,转速为350 r·min-1.
50 L发酵罐上发酵:将15 L罐的种子按15%的接种量接种至50 L发酵罐中,30℃恒温发酵8 d,罐压为 0.03~0.05 MPa,转速为 350 r·min-1.
1.5 分析方法
用旋光法测定生物效价[8-9]、斐林试剂法测定总糖与还原糖[10]、甲醛氧化法测定氨基氮[11].采用美兰染色法检查菌丝形态.取l0mL发酵液于3000 r·min-1、离心 10min,倒出上清液,计算湿菌体浓度[12].
2 结果与分析
2.1 在基础培养基中以液化液代替液化糖发酵
在基础培养基中进行林可霉素的发酵,实验罐用液化液,对照罐用液化糖,其他成分、培养条件、接种量及菌种批次都相同.接种8 h后每隔8 h取样,进行总糖、还原糖、氨基氮、湿菌体浓度的测定及菌丝形态检查.根据检测到的还原糖和氨基氮含量进行碳源和氮源的补充,还原糖浓度控制在3.2~8.0 g·L-1,氨基氮浓度控制在0.462~0.700 g·L-1.
如图1(数据为3批实验平均值)所示,在基础料中液化液的湿菌体浓度在前期比液化糖的低,但在中后期始终比液化糖的高.如图2所示,24 h时实验罐的菌丝少,对照罐的菌丝多,但96 h时实验罐的菌丝比对照罐的菌丝多且菌丝舒展,168 h时实验罐及对照罐的菌丝都开始自溶,林可霉素生产能力下降.由此可知,基础料中液化液在前期菌丝生长不如液化糖的快,但在中后期却比液化糖的快.
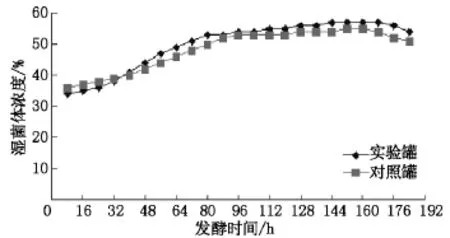
图1 实验罐和对照罐发酵过程中湿菌体浓度变化
接种40 h后每隔24 h进行效价测定,发酵效价变化情况如图3所示(3批实验数据),发酵前期实验罐的发酵效价低于对照罐,但发酵中后期实验罐的效价高于对照罐.实验罐的最终放罐效价分别为6517、6398 和6300 μg·mL-1,平均值为 6405 μg·mL-1,对照罐的最终放罐效价分别为6018、5896和5777 μg·mL-1,平均值为5897 μg·mL-1,实验罐的平均发酵效价比对照罐的提高了8.6%.
2.2 基础培养基及补糖中均用液化液代替液化糖发酵
实验方法如本文2.1节所述,只是在进行碳源补充时,实验罐用液化液,对照罐用液化糖.湿菌体浓度变化如图4(数据为3批实验平均值)所示,结果和2.1节类似,此时实验罐中后期的湿菌体浓度略高于2.1节中的实验罐.如图5所示,48、96和144 h时实验罐的菌丝均比对照罐的菌丝长得更好,菌丝更多、更舒展.
接种40 h后每隔24 h进行效价测定,发酵效价变化情况如图6(3批实验)所示,前期实验罐的发酵效价低于对照罐,但中后期实验罐高于对照罐.实验罐最终放罐效价分别为6789、6614和6511 μg·mL-1,平均值为 6638 μg·mL-1,对照罐最终放罐效价分别为6054、5875 和5789 μg·mL-1,平均值为5906 μg·mL-1,实验罐平均发酵效价比对照罐的提高了12.4%.

图2 实验罐和对照罐菌丝形态

图3 实验罐和对照罐3个批次的发酵效价

图4 实验罐和对照罐发酵过程中湿菌体浓度变化
3 讨论
在基础培养基或基础培养基和补糖中都用液化液代替液化糖生产林可霉素,通过湿菌体浓度检测及菌丝形态显微观察,结果表明,40 h之前菌体长势均没有使用液化糖的好,这是因为液化液还原糖很少,即远低于液化糖中的还原糖,而还原糖是林可霉素发酵中的速效碳源,在中后期使用液化液的发酵罐却比使用液化糖的长势更好,因为林肯链霉菌可能存在利用短链淀粉的酶系,而液化液的主要成分是糊精和低聚糖,液化液中的速效碳源和持续碳源的比例相对于液化糖来说,可能更利于林肯链霉菌在发酵过程中的生长以及林可霉素的释放.

图5 实验罐和对照罐菌丝形态
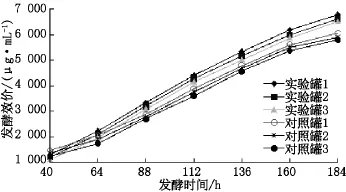
图6 实验罐和对照罐3个批次的发酵效价
通过在基础培养基及补糖中用液化液代替液化糖进行林可霉素发酵的实验,发现在基础培养基中用液化液代替液化糖进行发酵,最终放罐平均发酵效价提高了8.6%;在基础培养基及补糖中均用液化液代替液化糖进行发酵,最终放罐平均发酵效价提高了12.4%.因此,使用液化液代替液化糖进行林可霉素的发酵,可降低生产林可霉素的成本,提高效率及产能,今后将在生产上对该工艺进行验证及完善.
[1] Rajeswaran M,Srikrishnan T.Crystal andmolecular structure and absolute configuration of lincomycin hydrochloridemonohydrate [J].Carbohydr Res,2004,339(12):2111-2115.
[2]Olsovska J,Jelinkova M,Man P.High-through put quantification of lincomycin traces in fermentation broth of geneticallymodified streptomyces spp.comparison of ultra performance liquid chromatography and high-performance liquid chromatography withUV detection[J].Journal of ChromatographyA,2007,1139:214-220.
[3]Spizek J,Rezanka T.Lincomycin,cultivation of producing strains and biosynthesis[J].Applied Microbiology and Biotechnology,2004,63(5):510-519.
[4]Gerasimova S,Berezina E.Cytomorphological study of lincomycin toxicity[J].Antibiotiki,1977,22(6):539.
[5]王忠,王立琦.林可霉素在兽医临床上的应用进展[J].兽医导刊,2010(2):42-44.
[6]董明,邵琼芳.林可霉素发酵液絮凝过滤研究[J].江西师范大学学报:自然科学版,2002,26(4):372-374.
[7]何家骏,樊世从.液化糖代替葡萄糖在林可霉素发酵中的应用[J].中国医药工艺杂志,1992,23(7):296.
[8]叶万荣.旋光法测定发酵液中林可霉素的含量[J].医药工业,1987,18(2):76-77.
[9]李瑸.多元萃取体系提取林可霉素的热力学研究[D].河北:河北工业大学,2004:10-11.
[10]北京大学生物系生化教研室.生物化学实验指导[M].北京:高等教育出版社,1986:92-96.
[11]孙婉菊,王筱兰.废弃菌体水解液作氮源发酵产腈水合酶的研究[J].江西师范大学学报:自然科学版,2013,37(5):530-534.
[12]李啸,储炬,张嗣良,等.玉米浆对林可链霉菌的代谢特性及形态的动态影像[J].工业微生物,2009,39(6):16-19.

