乌墨根部提取物对α-葡萄糖苷酶抑制活性的研究
张富东李玲牛艳芬高丽辉林华刘旭
(1乐山职业技术学院,四川 乐山 614000;2乐山老年病专科医院;3昆明医科大学生物医学工程研究中心,云南 昆明 650500)
乌墨根部提取物对α-葡萄糖苷酶抑制活性的研究
张富东1,2李玲3牛艳芬3高丽辉3林华3刘旭3
(1乐山职业技术学院,四川 乐山 614000;2乐山老年病专科医院;3昆明医科大学生物医学工程研究中心,云南 昆明 650500)
目的:探讨乌墨根部提取物对α-葡萄糖苷酶的抑制活性。方法:通过建立体外α-葡萄糖苷酶抑制模型,对乌墨根部提取物进行活性筛选,并对化合物浓度与抑制活性关系进行研究。结果:粗提物12,17,21在体外对α-葡萄糖苷酶均有一定的抑制活性,其中粗提物21的抑制活性(IC50=94.89 μg/mL),远高于阳性对照阿卡波糖的抑制活性(IC50=1 095.65 μg/mL)。结论:乌墨根部提取物对α-葡萄糖苷酶有抑制活性,具有一定的潜在开发价值。
乌墨;提取物;α-葡萄糖苷酶;抑制活性
乌墨(Syzygiumcumini,Eugeniajambolana,Syzynium jambolana)又名乌楣、野冬青果,系桃金娘科(Myrtaceae)蒲桃属植物。为高大乔木,高 6~20 m,小枝圆柱形或稍压扁,叶片革质,宽椭圆形至长圆状椭圆形,长 5~ 12 cm,宽 3~ 7 cm;叶柄长1.5~ 2 cm,圆锥花序通常生于落叶的腋内,偶有顶生,长8~ 11 cm,多花;花梗短;花白色,芳香,常3~ 5朵生于花序小枝顶端;花蕾倒卵形,长约5 mm,萼管倒锥形,长约5 mm;果实卵形或壶形,长1~ 2 cm,宽0.5~ 1 cm;种子1颗;花期4~ 5月,果期 6~ 8月。生长于海拔 500~ 1 800 m的山坡次生林内,在云南南部、广东、广西、海南、福建、台湾、中南半岛、喜马拉雅山区诸国(尼泊尔等)、印度、印度尼西亚、澳大利亚均有分布。果实、茎皮、叶药用,具有润肺、止咳、平喘的功效,我国民间主要用于治疗肺结核、寒性哮喘和过敏性哮喘[1]。而在印度民间,乌墨则很早就被发现有治疗糖尿病的功效[2]。
20世纪 60年代,法国科学家首次报道了乌墨种子的乙醇提取物具有降低四氧嘧啶性糖尿病大鼠血糖的作用。目前,国内外学者对乌墨的种子、果实、树皮和树叶的化学成分及抗糖尿病的作用也进行了相关研究[3-6],但具体降糖机制还不是太清楚。而且大部分的活性研究仅停留在乌墨种子、果实和树皮的粗提物上,缺乏对于活性单体的研究,此外,对乌墨根部提取物的研究也较少。
结合国内外学者对乌墨降糖机制的研究报道,笔者利用体外α-葡萄糖苷酶抑制高通量筛选模型对乌墨根部提取物进行活性筛选,以期为乌墨根部提取物降糖机制研究和开发利用提供理论依据。
1 实验材料
1.1 仪器
Multiskan MK3酶标仪(美国Thermo Electron公司);LRH-150恒温培养箱(上海-恒科技有限公司);DELTA 320型 pH计(梅特勒-托利多仪器有限公司);电子天平(梅特勒-托利多仪器有限公司);LR4000型旋转蒸发仪(德国 Heidolph公司);超声波清洗器(昆山市超声仪器有限公司);CS-H1型混合器(北京博励阳科技公司);96微孔板;各种移液器及枪头等。
1.2 试剂
α-葡萄糖苷酶(α-glucosidase,EC3.2.1.20)、4-硝基苯-α-D-吡喃葡萄糖苷(4-N-trophenyl-α-D-glucopyranoside,PNPG,026K1516)、阿卡波糖(Acarbose,Lot 16869,纯度≥95%)和二甲亚砜(DMSO)均购自Sigma公司;乌墨根部提取物样品(共7个单体化合物,17个粗提物)是由昆明医科大学生物医学研究中心提供,见表1。

表 1 乌墨根部提取物的化学式及分子量
2 方法
2.1 α-葡萄糖苷酶活力的测定[7]
40 μL磷酸钾缓冲液(pH 7.4),加入0.025 U/mL的α-葡萄糖苷酶20 μL、37℃恒温10 min后加入1.25 mmol/L的PNPG 20 μL,37℃恒温反应15 min。再加入0.2 mol/L的Na2CO3溶液80 μL,于400 nm波长下测光密度值(OD)。
2.2 乌墨根部提取物对α-葡萄糖苷酶抑制活性的测定
本检测在96孔板上进行,反应体系参照李婷等[7]的方法,探索最佳α-葡萄糖苷酶和PNPG的浓度,最佳反应时间以及最适缓冲液,实验条件优化后为:磷酸钾缓冲液(pH 7.4)20 μL,加入0.025 U/mL的 α-葡萄糖苷酶 20 μL,样品溶液20 μL,37℃恒温 10 min,加入 1.25 mmol/L的PNPG 20 μL,37℃恒温反应15 min,再加入80 μL 0.2 mol/L的 Na2CO3溶液,于 400 nm波长下测OD值。
实验共设5个组,每组3孔,分别为:a对照组(缓冲液+酶液+底物);b空白组对照组(缓冲液);c样品测定组(样品+酶液+底物);d样品对照组(样品+缓冲液);e阳性对照组(Acarbose+酶液+底物)。
按下面方法计算抑制率,并用GreatBasic软件求出相应IC50值:
I%=[1-(c-d)/(a-b)]×100%。
3 结果
3.1 各提取物的抑制活性
乌墨根部各提取物在质量浓度为 200 μg/mL时粗提物 12(13.56%),17(9.87%),21(87.58%)对α-葡萄糖苷酶均表现出一定的抑制活性,特别是化合物 21的抑制率(87.58%)远高于阿卡波糖(17.68%),表明乌墨根部提取物对α-葡萄糖苷酶有一定的抑制活性。为进一步研究抑制活性的高低,对化合物21的初筛终浓度依次对半稀释计算IC50值,算出 IC50为 94.89 μg/mL,远远高于阳性对照Acarbose的IC50(1 095.65 μg/mL)。结果表明,乌墨根部提取物具有一定的抑制活性,远大于阿卡波糖的抑制活性。乌墨根部提取物对α-葡萄糖苷酶的抑制活性见表2。
3.2 提取物浓度对α-葡萄糖苷酶抑制活性的影响
粗提物12,17,21对α-葡萄糖苷酶的抑制活性均呈剂量依赖性,其中粗提物 21在质量浓度< 500 μg/mL时,抑制率达到了最大值100%,此后再增加提取物浓度抑制率也不再变化,粗提物12和17在质量浓度< 1 000 μg/mL时,抑制率已分别达到了最大值41.81%和31.89%,此后再增加提取物浓度抑制率也无任何变化,出现“平台期”,其余提取化合物无论浓度高低对α-葡萄糖苷酶均未表现出抑制活性。阿卡波糖在质量浓度范围内,抑制率随质量浓度的增加而增大。说明乌墨根部提取物对α-葡萄糖苷酶具有一定的抑制活性。乌墨根部提取物不同浓度对α-葡萄糖苷酶活性的影响见图1。
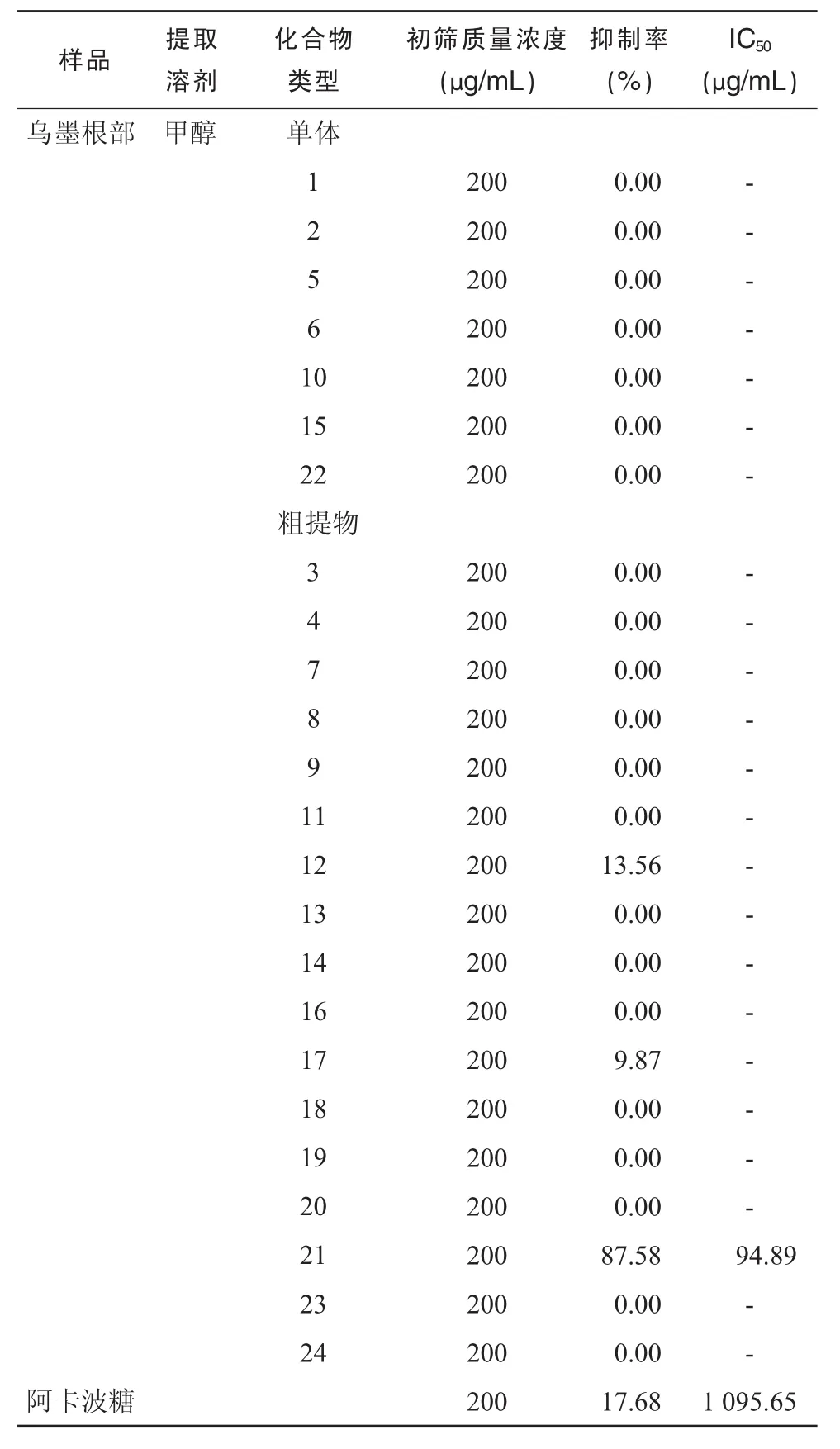
表2 乌墨根部提取物对α-葡萄糖苷酶的抑制活性
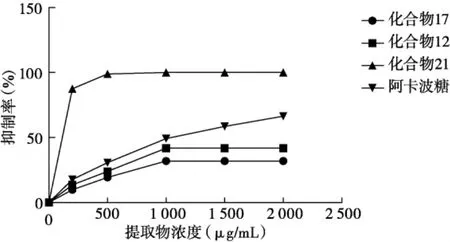
图1 不同浓度乌墨根部提取物对α-葡萄糖苷酶活性的影响
4 讨论
α-葡萄糖苷酶抑制剂是一种有效的口服降糖药,对糖尿病及糖尿病并发症的预防和治疗有很好的效果,此外,α-葡萄糖苷酶抑制剂还能抑制蛋白及脂类糖基化[8],具有抗癌、抗 HIV、抗动脉粥样硬化等作用[9]。目前临床上广泛应用的 α-葡萄糖苷酶抑制剂如阿卡波糖、伏格列波糖等都有较好的疗效,但也有不尽如人意之处。研究[10-11]表明植物中存在许多具有抑制α-葡萄糖苷酶活性的成分,如杜仲[12]、穇子[13]、印度鱼藤[14]、大豆[15]、虎杖[16]、知母[17]等均有良好的抑制 α-葡萄糖苷酶活性。由于药用天然产物大多数结构确定,作用温和、缓慢与持久[18],因而,从药用植物中筛选天然的α-葡萄糖苷酶抑制剂成为国内外学者关注的热点。
研究结果表明,乌墨根部提取物具有一定的α-葡萄糖苷酶抑制活性,各提取物的抑制活性均与浓度呈正相关性,说明其抑制活性具有剂量依赖性。进一步的酶抑制作用的研究结果表明,粗提物 21的抑制活性最好,优于阿卡波糖的抑制活性,说明可以对该提取物进行活性成分追踪,作进一步研究,为乌墨根部提取物的降糖机制研究和开发利用提供实验依据。
[1] 云南省药材公司.云南中药资源名录[M].北京:科学出版社,1993.
[2] Helmstadter A.Syzygium cumini(L.)SKEELS(Myrtaceae)against diabetes-125 years of research[J].Pharmazie,2008,63(2):91-101.
[3] Mahapatra PK,Pal M,Chaudhari AKN,et al.Preliminary studies on glycemic effect of Syzyginium Cumini seeks[J].IRCS Medical Science Biochemistry,1985(13):129-133.
[4] Teixeira CC,Pinto LP,Kessler FH,et al.The effect of Syzygium cumini(L.)Skeels on post-prandial blood glucose levels in non-diabetic rats and rats with streptozotocin-induced diabetes mellitus[J].J Ethanopharmacol,1997,56(3):209-213.
[5] Prince PS,Menon VP,Pari L.Hypoglycemic activity of Syzigium cumini seeds:effect on lipid peroxidation in alloxan diabetic rats [J].J Ethnopharmacol,1998,61(1):1-7.
[6] Sharma SB,Nasir A,Prabhu KM,et al.Hypoglycaemic and hypolipidemic effect of ethanolic extract of seeds of Eugenia jambolana in alloxan-induced diabetic rabbits[J].J Ethnopharmacol,2003,85(2-3):201-206
[7] Li T,Zhang XD,Song YW,et al.A microplate-based screening method for alpha-glucosidase inhibitors[J].Chin J Clin Pharmacol Ther,2005,10(10):1129.
[8] Bertozzi CR,Kiessling LL.Chemical glycobiology[J].Science,2001,291(5512):2357-2364.
[9] Baron AD.Postprandial hyperglycaemia and alpha-glucosidase inhibitors[J].Diabetes Res Clin Pract,1998,40(S):51-55.
[10] 季芳,肖国春,董莉,等.药用植物来源的α-葡萄糖苷酶抑制剂研究进展[J].中国中药杂志,2010,30(12):1633-1640.
[11] 焦晶晶,张英.黄酮类化合物在防治糖尿病及其并发症方面的最新研究进展[J].中国药学杂志,2006,41(7):481-484.
[12] Shobana S,Sreerama YN,Malleshi NG.Composition and enzyme inhibitory properties of finger millet (Eleusine coracana L.)seed coat phenolics:Mode of inhibition of α-glucosidase and pancreatic amylase[J].Food Chemistry,2009,115(4):1268-1273.
[13] Nakahara K,Kawabata S,Ono H,et al.Inhibitory effect of oolong teapolyphenols on glycosyltransferases of mutans Streptococci[J].Appl Environ Microbiol,1993,59(4):968-973.
[14] Rao SA,Srinivas PV,Tiwari AK,et al.Isolation,characterization and chemobiological quantification of alpha-glucosidase enzyme inhibitory and free radical scavenging constituents from Derris scandens Benth[J].Journal of Chromatography B:Analytical Technologies in the Biomedical and Life Sciences,2007,855(2):166-172.
[15] Lee DS,Lee SH.Genistein,a soy isoflavone,is a potent alpha-glucosidase Inhibitor[J].FEBS Lett,2001,501(1):84-86.
[16] 杨秀芳,吴明鑫.虎杖中α-葡萄糖苷酶抑制剂的初步研究[J].中成药,2008,30(1):10005-10007.
[17] Hiroyuki I,Osami T,Iwao S,et al.Inhibitory effects of compounds from Anemarrhenae Rhizoma on a-glucosidase and aldose reductase and its contents by drying conditions[J].Journal of Natural Medicines,2007,61(2):146-153.
[18] 覃志成,柴可夫.中药治疗糖尿病机制的研究进展[J].浙江中医学院学报,2004,28(1):81-82.
Study on Inhibition Effect of Syzygium cumini Extracts on the Activity of α-glucosidase
Zhang Fudong1,2,Li Ling3,Niu Yanfen3,Gao Lihui3,Lin Hua3,Liu Xu3(1 Leshan Vocational&Technical College,Sichuan Leshan 614000,China;2 Leshan Specialized Hospital of Geriatric Disease;3 Biomedical Engineering
Research Center of Kunming Medical University,Yunnan Kunming 650500)
Objective:To investigate the inhibition effect of the extracts from the root of Syzygium cumini on the activity of α-glucosidase.Methods:By establishing α-glucosidase screen inhibitory model,the activity of extracts from the root of Syzygium cumini was screened.The relationship between the inhibitory ratio and the extract concentration was also studied.Results:Compounds 12,17,21 showed a good inhibitory effect on the activity of α-glucosidase,and the inhibitory effect of compound 21(IC50=94.89 μg/mL)was much higher than that of the positive control of acarbose (IC50=1 095.65 μg/mL).Conclusion:The extracts from the root of Syzygium cumini have inhibition effects on the activity of α-glucosidase,and presented a certain potential value in the development and utilization.
Syzygium cumini;Extract;α-glucosidase;Inhibitory Activity
10.3969/j.issn.1672-5433.2014.12.007
2014-08-21)
乐山职业技术学院科学研究计划项目(No KY2014019)
张富东,男,硕士,助教。研究方向:内分泌代谢药理。E-mail:441445988@qq.com

