尼龙酸二甲酯反应动力学研究
张晓娟,邢春会,徐宏达,任 君,李卫华
(1、沈阳工业大学,辽宁 辽阳 111003;2、辽阳石油化纤公司亿方工业公司金兴化工厂,辽宁 辽阳 111003)
尼龙酸二甲酯反应动力学研究
张晓娟1,邢春会2,徐宏达2,任 君2,李卫华2
(1、沈阳工业大学,辽宁 辽阳 111003;2、辽阳石油化纤公司亿方工业公司金兴化工厂,辽宁 辽阳 111003)
以尼龙酸、甲醇为原料、对甲苯磺酸为催化剂,通过酯化反应合成尼龙酸二甲酯。根据反应过程中反应混合物酸值的变化跟踪反应,研究反应规律,建立了不分水条件下该反应体系的酯化反应动力学模型。计算结果表明,在55~65℃条件下合成尼龙酸二甲酯合成的正、逆反应对各组分均为1.3级反应,正、逆反应的表观活化能分别为6.291×104J·mol-1、4.768×104J·mol-1,指前因子分别为5.73×106、1.26×104。正、逆反应的速率常数均与催化剂浓度(用量)成0.3的指数关系。模型值与实验值相符,显示了该模型的正确性。
尼龙酸二甲酯;动力学;酯化反应;对甲苯磺酸
以己二酸二甲酯、戊二酸二甲酯、丁二酸二甲酯为主要成分的尼龙酸二甲酯,是高沸点无色清澈透明液体,易溶于醇醚类,不溶于水,是非常重要的精细化工产品和化工原料,具有无毒、低味、溶解能力强、含水量低,可生物降解等特点,是安全的环保溶剂,广泛用于日用化学工业和食品工业[1],因此,许多学者对其催化技术和反应动力学进行研究。目前报道的酯化反应动力学是在分出酯化反应过程生成水的情况下进行的[2]。考虑到甲酯化合成用原料甲醇沸点低(64.8℃)、与水互溶,不宜采用通常的带水剂(苯、甲苯、环己烷等)分水,因此有文献采用加入脱水剂如硫酸镁进行脱水[3],但该方法在工业化生产中意义不大。为此,本文研究以对甲苯磺酸为催化剂,不分出反应体系中生成的水,催化合成尼龙酸二甲酯的动力学规律。
1 实验部分
1.1原料及试剂
尼龙酸(工业级),甲醇、乙醇、氢氧化钾、对甲苯磺酸(均为分析纯)。
1.2实验操作步骤
将安装有搅拌器、冷凝器、温度计和取样器的四口烧瓶中加入定量的尼龙酸放入调好温度的超级恒温水浴(温差<±1℃)中预热,将预热后的定量甲醇和催化剂混合物加到反应瓶中,剧烈搅拌并开始计时。待尼龙酸全部溶解后开始取样分析系统的酸值,以羧基的消耗量计算转化率。酸值的测定采用GB 1886-1995方法。转化率由式(1)计算。

式中反应液初始酸值按式(2)计算。在实验准备过程中,预先测量出了尼龙酸和对甲苯磺酸的平行酸值,综合取其平均值得到尼龙酸的酸值是786.197mgKOH·g-1, 对甲苯磺酸的酸值是285.82 mgKOH·g-1。由于甲醇的酸值同BI酸、对甲苯磺酸的酸值比较起来相当小,所以在计算过程中甲醇的酸值可以忽略不计。

1.3实验安排
为了减小各因素所带来的误差,本实验在较低的温度下进行,采用L9(33)正交表安排试验。具体实验因子及水平见表1。
目前EDA教学中存在模块设置单一固定,学生学习积极性差,课堂参与度低、学生满足于只完成实训教材规定内容,自学能力不足,探索性差等问题。最终结束整门课程后,有学生不明白为什么要学该课程?本课程有什么用?本课程内容可以用到什么地方?
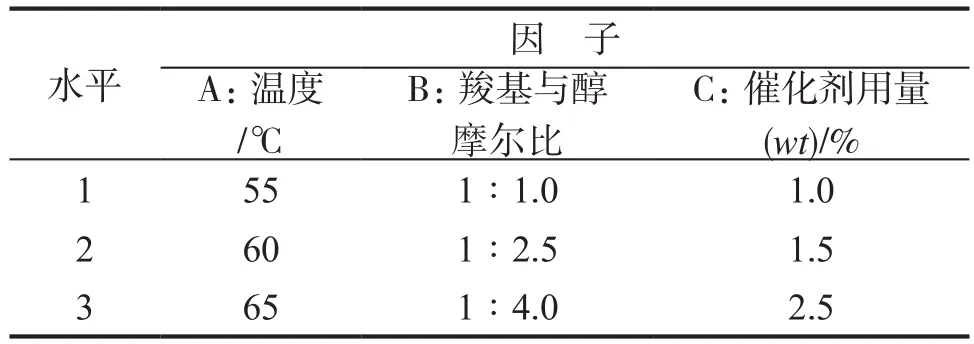
表1 实验因子与水平
1.4体系组分浓度的确定
为了表征反应体系各组分的浓度,需要测定反应体系的体积。本研究采用测定不同温度下反应混合物密度的方法确定体系的膨胀系数,进而确定反应实际体积。根据投料量和转化率计算各组分浓度。
2 实验结果与讨论
2.1速率模型的假设
尼龙酸与甲醇的反应为:
HOOC(CH2)nCOOH+2CH3OH→CH3OOC(CH2)nCOOCH3+2H2O
根据反应机理分析其是一个连串-平行反应,反应过程中不分水,则还具有可逆性。为了简化反应模型,考虑到二羧酸分子中2个羧基被亚甲基相隔,以及实验检测的准确性,将反应方程式简化为:

考虑到正反应和逆反应的反应机理是一样的,故酸、醇、酯和水对反应的影响程度一致,即它们的反应级数一致,均设为a。催化剂在一组实验中是常量,催化剂对正、逆反应影响程度也是一样的。初步确定动力学模型为式(4):

所谓的化学平衡是指在一定条件下体系内发生化学反应的各物质的组成将不随时间改变的现象。平衡时的条件就是反应速率为零,即rA=0。根据平衡常数的定义[4],尼龙酸与甲醇的反应平衡常数表示为式(5)。
根据实验数据进行拟合,求出各组分的平衡浓度,进而由式(5)可求出不同温度下该酯化反应的平衡常数。拟合结果见表2。
由于同一温度下的反应平衡常数是不随投料比变化的,所以,取表2中的平均值作为本实验中的反应平衡常数。


表2 9组实验的平衡常数KC值
2.3反应级数的确定
本文采用试差法确定各物质的反应级数a和b的值。因为现今研究酯化反应的相关文献[5-7]中介绍酸、醇、酯、水的反应级数大多是1左右,所以a从0.8~1.4左右开始代值,又根据经验值,一个反应总反应级数一般不大于3,即a+a+b不大于3,所以b的范围一般在0.2~1.4。将每一次试差的数值代入模型中,经过几次试差和验证后最终后确定反应级数a=1.3,b=0.3。
2.4正、逆反应速率常数的确定
将反应平衡常数K带入动力学模型公式(3)中,由酯化反应简单的示意公式(3),整理得到:

将式(5)整理后进行积分,得到积分式(7):


将9组实验的t~CA数据带入式(8),即可求得y值,将求得的y值与相应的反应时间作y~t图。该图呈线性关系,则该直线的斜率的负数即为k+。不同温度下y与t按线性拟合,相关性较高,其相关系数及由此确定的该反应不同温度下的正反应速率常数分别见表3。

表3 正反应速率常数一览表

表4 逆反应速率常数一览表
2.5正、逆反应活化能的确定
由阿伦尼乌斯方程对数形式lnk=lnA-Ea/(R×T)可知,lnk+(lnk-)与1/T呈线性关系,由lnk+(lnk-)与1/T线性方程的斜率和截距可求得正逆反应的活化能和指前因子。分别将表3中的lnk+和表4中的lnk-数据对1/T作图,进行拟合。分别取同一投料比,不同反应温度的3组实验数据为1组求活化能,即实验共有3组活化能值,最后求取平均值作为正反应的活化能。拟合计算得到正反应活化能是6.291×104J·mol-1,其指前因子是5.73×106;拟合计算得到的逆反应活化能是4.768×104J·mol-1,其指前因子是1.26×104。
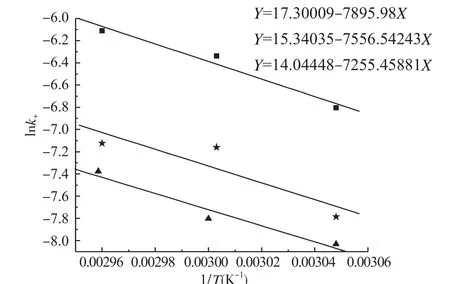
图1 lnk+与1/T关系图

图2 lnk-与1/T关系图
2.6反应速率方程模型的验证
为了考察上述模型建立的正确性,根据9组实验数据得到的反应速率(称作实验值)与由该模型计算得到的模型值进行比较。速率定义rA=-dCA/dt可知,由原始数据作出的一定温度下的氢离子浓度CA与反应时间t的曲线图上,作某一浓度时曲线的切线,此切线的斜率即为dCA/dt,取其负值即为该对应时刻的反应速率rA。CA~t关系曲线图所得出的方程,对方程中的时间求导数,得出一个方程,将一系列的反应时间代入这个方程中,得到的数值的负数就是相应的氢离子反应速率。此值与模型值相符,偏差均在2%以下。
3 结论
综合实验结果,以对甲苯磺酸为催化剂,反应过程中不分水,55~65℃催化合成尼龙酸二甲酯的反应动力学方程为:
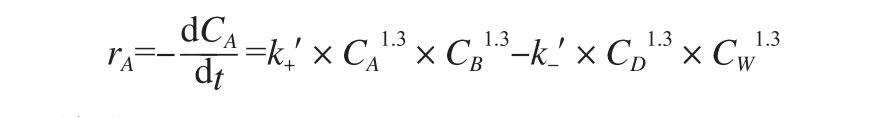
其中:

[1] 刘国际,王艳军,鲁丰乐,等.固载磷钨酸催化合成混合二元酸二甲酯的研究[J].河南化工,2005,22(7):15-16.
[2] 张保国,何静,段雪,等.非等温液-固相酯化反应动力学研究[J].化学学报,1995(53):397-401.
[3] 吴书侠,朱建华.树脂催化合成混合二元酸二甲酯[J].合成技术及应用,2004,19(4):14-16.
[4] 李吕辉,吴翔.物理化学[M].北京:高等教育出版社,1984.
[5] 林进,王昭煜,王红.对甲苯磺酸催化合成己二酸二甲酯的研究[J].中国化工,1998(10):46-47.
[6] 韩瑞生,胡进勇,高东颖.对甲苯磺酸催化合成丁二酸二甲酯的研究[J].化学工程师,2000,81(6):3-4.
[7] 林进,王兰芝,王昭煜.对甲苯磺酸催化合成丁二酸二乙酯[J].河北师范大学学报:自然科学版,1999,23(4):523-525.
Study on Synthesis Kinetics of Nylon Sour Dimethyl Ester
ZHANG Xiao-juan1, XING Chun-hui2, XU Hong-da2, REN Jun2, LI Wei-hua2
(1.Petrochemical College of Shenyang University of Technology, Liaoning 111003, China; 2.Liaoyang Petrochemical Company Yifang Industry Company Jinxing Chemical plant, PetroChina, Liaoyang 111003, China)
The dimethyl adipate was synthesized through esterification reaction with nylon sour and methano using toluene-psulfonic acid as catalyst. Based on the acid value change of reaction mixture, the reaction was traced and the reaction rule was studied, and the kinetics model was established with the water no diversion. By kinetic calculation, it was obtained that the overall order of positive reaction and side reaction was 1.3 on 55~65℃, the apparent activation energy to positive reaction and side reaction was 62910J/mol and 47680J/mol, the frequency factor to positive reaction and side reaction was 5.73×106、1.26×104, the positive rate constant and side rate constant varied with the level of catalyst,they were both accord with exponential relationship of 0.3. The model values consistent with the experimental value, showed the correctness of the model.
nylon sour dimethyl ester;kinetics;esterifcation reaction;toluene-p-sulfonic acid;
O 623.624
A
1671-9905(2014)02-0013-03
辽宁省教育厅A类项目 (20060618)
张晓娟(1965-),女,辽宁省辽阳市,教授,硕士,主要从事精细化学品的合成研究
2013-11-21

