补肾活血方对血管性认知障碍模型大鼠神经递质及其受体的影响1)
范 雯,曾建伟,黄露芬,高丽萍,蔡 晶
血管性认知障碍(vascular cognitive impairment,VCI)是各种可能影响脑功能的心脑血管疾病导致认知功能下降的综合征,其含义包括了血管性痴呆(VaD),有乙酰胆碱等神经递质的降低[1,2]。目前认为,VCI与兴奋性氨基酸(EAA)毒性、兴奋性氨基酸与抑制性氨基酸(IAA)失衡等有关[2,3]。本文从血管性认知障碍模型大鼠大脑海马组织内兴奋性氨基酸、抑制性氨基酸以及与学习记忆有关神经递质的含量及其受体表达的变化,探讨补肾活血方对血管性认知障碍模型大鼠神经递质及其受体的影响。
1 材料与方法
1.1 实验动物 Wistar大鼠3月龄的大鼠(福建中医药大学动物实验中心提供),体重(245±26)g,大鼠按体重随机分组,正常饲养,维持室温20 ℃~22 ℃,自由摄食与饮水。
1.2 药品及试剂 补肾活血方购自福建省第二人民医院中药房,由肉苁蓉、淫羊藿、制黄精、丹参煎煮而成,混悬液为0.371g成药/mL,相当于人常用剂量。阳性中成药银杏叶分散片由沈阳格林制药有限公司生产(国药准字Z20060440,每片0.5g),用蒸馏水配制,混悬液浓度为0.01g成药/mL,相当于人常用剂量。乙酰胆碱(ACh)、5-羟色胺(5-HT)、多巴胺(DA)、谷氨酸(Glu)、γ-氨基丁酸(GABA)、甘氨酸(Gly)抗体均由北京博奥森生物技术有限公司提供。兔超敏二步法免疫组化检测试剂、浓缩型DAB 试剂盒由北京中杉金桥生物技术有限公司提供。Gly、ACh、GABA、Glu、5-HT、DA 标准品(Sigma公司,美国),含3-巯基丙酸的邻苯二甲醛试剂(批号:5061-3335,Fluka公司),0.4N 硼酸缓冲液(批号:5061-3339,Fluka公司),乙腈(色谱纯,德国Merck公司),水为超纯水,其余试剂均为分析纯。
1.3 实验仪器 1200高效液相色谱仪,包括G1311A 四元泵,G1316A 柱温箱,G1329A 自动进样器,G1329A 荧光检测器和化学工作站(美国Agilent公司)。CP225D 电子天平(德国Sartorius公司),Milli-Q 超纯水机(法国Millipore公司),100μL 圆头注射器。台式低温高速冷冻离心机(德国Hettich公司),超声波细胞破碎仪(美国Sonics公司)。
1.4 分组及造模方法 Wistar大鼠40只,按体重随机分成4组:假手术组、模型组、银杏叶组、补肾活血方组,每组10只,雌雄各半。各组采用双颈总动脉永久结扎法(2-VO)造模,参照Eklof方法改良。具体步骤如下:大鼠造模前禁食(不禁水)1h。以盐酸氯胺酮注射液0.3 mL/100g体重剂量腹腔注射麻醉。将大鼠仰卧并固定在手术台上,颈部皮肤常规消毒。颈正中切口,仔细分离肌肉,分出双侧颈总动脉。埋线,用丝线结扎双侧颈总动脉。分层缝合肌肉及皮肤,硫酸庆大霉素注射液涂于皮肤切口以防感染。假手术组施行相同手术,但不结扎丝线。整个手术过程保持安静,室温控制在25.0 ℃±0.5 ℃。
1.5 给药方法 按动物体表面积比率换算大鼠灌胃量,补肾活血方、银杏叶组分别灌胃补肾活血方煎剂、银杏叶片水溶剂10 mL/kg。假手术组和模型组每天分别给予等体积的蒸馏水,连续灌胃15d,2次/日。
1.6 组织标本采集 末次给药后大鼠禁食不禁水12h,以10%水合氯醛(300mg/kg)腹腔麻醉。各组取4只大鼠,反正反射消失后,暴露心脏,用灌注针灌注生理盐水(4 ℃),至右心房流出的液体变清亮时,灌注多聚甲醛溶液(pH7.4)250mL 进行固定,以肝脏变白为灌注成功,快速断头取脑,迅速于冰盘上取大脑海马为主的脑组织,置于4%多聚甲醛中继续固定30h(4℃)。另4只大鼠迅速断头取脑,于冰盘上取大脑海马为主的脑组织,冰生理盐水冲洗除去血液,滤纸吸干,称质量。在冰浴下按1∶9(即1g组织加生理盐水9mL)加入冰冷的生理盐水,用超声细胞破碎仪破碎成10%的匀浆,3 000g 4 ℃低温离心10 min。取上清分装置-80 ℃冰箱保存备用。
1.7 高效液相色谱法测定海马组织内神经递质含量 色谱条件:色谱柱:200mm×2.1mm AA 柱和保护柱。流动相:A=20 mmol NaAc+0.018%TEA,用1%~2%醋酸调pH 至7.2,B=20%的20mmol NaAc,用1%~2%醋酸调pH 至7.2+40%乙腈+40%甲醇。流速:0.45 mL/min。梯度:100%A,17min时60%B,18min时100%B,18.1min时流速0.45mL/min,18.5 min时流速0.8mL/min,23.9min时流速0.8mL/min,24min时100%B,流速0.45 mL/min,25 min 0%B。柱温:40 ℃。荧光检测:λex=340nm,λem =450nm。
1.8 免疫组化染色 取出标本依次进行脱水、二甲苯透明、浸蜡及包埋处理,行5μm 厚的连续切片,粘于载玻片上。石蜡切片常规二甲苯脱蜡、梯度乙醇脱水,微波抗原修复20min,自然冷却。3%H2O2溶液室温下孵育10min,阻断内源性过氧化物酶的活性,PBS洗3min×3次。羊正常血清室温封闭20min,滴加一抗,4℃孵育过夜,PBS洗3min×3次。滴加生物素标记二抗,室温静置30min,PBS冲洗3min×3次。滴加三抗,室温静置30min,PBS洗3min×3次。DAB溶液显色,镜下控制反应时间,自来水冲洗10min,终止显色。苏木精复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。光镜下随机选择5个不重复高倍镜视野(10×40)观察,细胞核中有棕黄色颗粒者为阳性细胞。
1.9 统计学处理 所有数据采用SPSS 18.0统计软件进行分析,计量资料使用单因素方差分析。分类资料使用Kruskal-Wallis H 检验,两两对比使用Mann-Whitney U 检验分析。两两比较时检验水准α调整为α’=0.008 3,P<0.05为差异有统计学意义。
2 结 果
2.1 补肾活血方对血管性认知障碍大鼠海马组织中神经递质含量的影响 与假手术组相比,模型组大鼠海马组织中ACh、5-HT、DA 含量减少(P<0.05)。模型组大鼠海马内Glu、Gly含量较假手术组明显增多(P<0.01),GABA 含量较假手术组减少(P<0.05)。与模型组相比,补肾活血方组大鼠海马组织内ACh、5-HT、DA 含量均有明显增高(P<0.01),同银杏叶组相比差异无统计学意义(P>0.05)。大鼠海马组织内Glu、Gly含量较模型组降低(P<0.05),GABA 含量较模型组增高明显(P<0.01),同银杏叶组相比差异无统计学意义(P>0.05)。详见表1。
表1 补肾活血方对大鼠海马组织神经递质含量的影响

表1 补肾活血方对大鼠海马组织神经递质含量的影响
与假手术组比较,1)P<0.05,2)P<0.01;与模型组比较,3)P<0.05,4)P<0.01
组别 ACh(mmol/L) 5-HT(pmol/L) DA(pmol/L) Glu(μmol/mL) Gly(μmol/mL) GABA(μmol/mL)假手术组 81.17±11.97 38.71±5.30 20.57±3.31 810.79±122.50 198.23±54.47 15.83±4.56模型组 58.74±11.501) 19.49±8.231) 13.46±2.021) 1191.81±116.372) 374.59±112.232) 8.12±2.111)银杏叶组 74.37±14.16 30.87±7.41 18.40±3.62 973.14±123.51 232.33±99.43 12.32±2.44补肾活血方组 73.63±10.0844) 31.64±8.974) 18.47±2.024) 964.67±164.303) 226.83±94.633) 13.85±3.784)
2.2 补肾活血方对血管性认知障碍大鼠海马组织中神经递质受体表达的影响 模型组大鼠海马组织内ACh、5-HT、DA 受体表达较假手术组明显减少(P<0.05 或P<0.01),Glu、Gly受体表达较假手术组明显增多(P<0.05或P<0.01),GABA受体表达较假手术组明显减少(P<0.01)。补肾活血方组与模型组相比,大鼠海马组织中ACh、5-HT、DA 受体表达均有明显增加(P<0.01),同银杏叶组相比差异无统计学意义(P>0.05)。补肾活血方组海马组织Glu、Gly受体表达与模型组相比减少(P<0.05),GABA 受体表达较模型组增加(P<0.05),与银杏叶组相比差异无统计学意义(P>0.05)。详见表2。
表2 补肾活血方对大鼠海马组织各神经递质受体表达的影响阳性细胞数
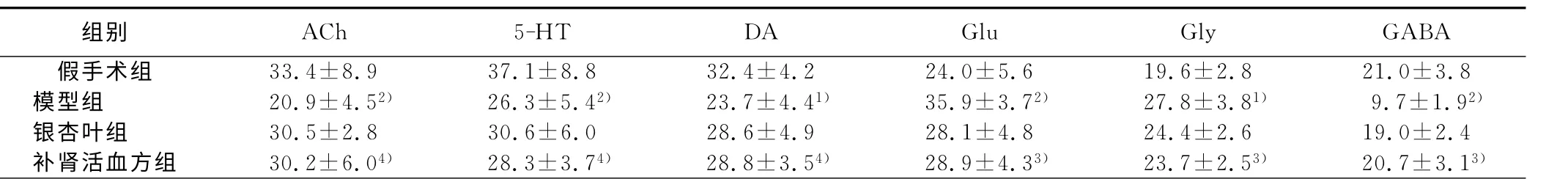
表2 补肾活血方对大鼠海马组织各神经递质受体表达的影响阳性细胞数
与假手术组比较,1)P<0.05,2)P<0.01;与模型组比较,3)P<0.05,4)P<0.01
组别 ACh 5-HT DA Glu GlyGABA假手术组 33.4±8.9 37.1±8.8 32.4±4.2 24.0±5.6 19.6±2.8 21.0±3.8模型组 20.9±4.52) 26.3±5.42) 23.7±4.41) 35.9±3.72) 27.8±3.81) 9.7±1.92)银杏叶组 30.5±2.8 30.6±6.0 28.6±4.9 28.1±4.8 24.4±2.6 19.0±2.4补肾活血方组 30.2±6.04) 28.3±3.74) 28.8±3.54) 28.9±4.33) 23.7±2.53) 20.7±3.13)
3 讨 论
血管性痴呆是各类脑血管病所致的痴呆综合征。VaD 缺乏公认统一的诊断标准,很多VaD 患者在就诊时已失去了最佳的预防和治疗时机。为此,越来越多的研究关注了VCI。VCI是指由脑血管病危险因素(如糖尿病、高血压和高血脂等)、明显(如脑出血和脑梗死等)或不明显(如慢性脑缺血和白质疏松)脑血管病引起的从早期轻度的认知损害发展到痴呆的一类综合征。VCI的分类包括:VaD、非痴呆血管性认知功能障碍(vascular cognitive impairment no dementia,VCIND)以及混合性痴呆。调查发现,65岁或以上老年人VCI的患病率约5%,并随年龄的增大而增高[4]。在中枢神经系统(CNS)中,神经递质是传递信息的物质,神经递质受体存在于细胞膜上或胞质内的大分子蛋白质,神经递质由突触前膜释放,在突触间隙扩散,与受体特异性结合,产生突触后膜去极化电位或超极化电位,引发生物效应。目前认为,大脑的学习认知障碍与脑内ACh不足及单胺类神经递质减少密切相关。多数研究发现[5,6],缺血时脑组织中ACh含量明显降低,ACh 含量的降低影响脑学习认知功能,ACh对神经元的兴奋、皮质可塑和学习记忆过程均起到调节作用。单胺类神经递质是CNS中调节神经生理功能的重要物质,包括肾上腺素、5-HT、DA 等,对脑内所有回路系统均有调节作用[7]。研究表明[8,9],在脑组织缺血缺氧过程中,大脑的神经递质,尤其是单胺类神经递质,有明显减少,脑内单胺类神经递质的减少可导致学习记忆能力下降。
脑内存在作为神经递质的游离氨基酸,可分为EAA 和IAA。EAA 以Glu为代表,IAA 以GABA、Gly为代表。适量的EAA 浓度是维持包括学习、认知、记忆、运动和发育等正常脑功能所必需的,但当其浓度过高时,可引起兴奋性毒性,导致神经元肿胀和空泡变性,甚至死亡。研究表明[10,11],脑缺血时神经元可释放大量Glu,同时对Glu的摄取能力下降,导致突触间隙中Glu浓度持续升高,引起EAA 和IAA 比例失衡。Glu含量升高后,可引起去极化,产生Na+、Cl-以及水分的细胞内流,导致细胞肿胀,同时Glu可激活NMDA 受体,调控开放钙通道,导致细胞外Ca2+大量内流,引起神经细胞的损伤或死亡。有研究表明[12,13],脑缺血时,Gly含量的减少可以减轻脑损伤,Gly可通过激动NMDA 受体上Gly结合位点,影响离子通道,致Ca2+内流增加,扩大脑缺血损害,故Gly虽为IAA,但仍被认为与Glu具有协同毒性作用。GABA 是脑内重要的IAA,主要由Glu脱羧而成,可拮抗Glu的兴奋性毒性。研究发现[14,15],缺血过程中,GABA 释放增加,其幅度远远高于Glu和Asp释放增加的幅度。在脑缺血时,GABA 通过突触后及突触前抑制作用,拮抗Glu的毒性,减轻细胞的损伤[16]。目前多数学者认为,Glu/GABA 失衡是导致神经元损伤的原因,从而影响大脑的学习、记忆、认知功能[17,18]。本研究中,模型组大鼠海马组织中ACh、5-HT、DA 含量及其对应受体表达明显减少,Glu含量及其受体表达增多,GABA 含量及其受体表达减少。而补肾活血方组大鼠海马组织内ACh、5-HT、DA 含量及其受体表达增加,Glu含量及其受体表达较模型组减少,GABA 含量及其受体表达增加。可推测,模型组大鼠海马组织内ACh、5-HT、DA 含量及其受体表达的减少可能与脑内EAA/IAA 比值失衡导致的神经元损伤有关。
补肾活血方具有补肾益髓、活血通脉之功,方中“沙漠人参”肉苁蓉大补元阳,填精益髓,为君药;臣以淫羊藿温肾壮阳,制黄精滋阴益肾;佐以丹参活血通脉。诸药配合,补中有通,标本兼治,共奏补肾益智健脑、活血通脉之功。已有药理研究表明,方中数药可以改善模型动物大脑的学习认知能力,并对脑内游离氨基酸有作用,可降低缺血缺氧损伤后脑组织中兴奋性氨基酸含量,调节脑组织中兴奋性氨基酸与抑制性氨基酸活性两类递质的平衡[19-22]。基于本实验研究结果提示,推断补肾活血方可减轻神经元损伤导致的脑内ACh、5-HT、DA 含量的减少,保护大脑学习记忆能力,以达到治疗VCI的目的;其机制可能与其调节脑内EAA 与IAA 含量及其受体表达,改善EAA/IAA 失衡状态,降低EAA 兴奋性神经毒性作用有关。但补肾活血方改善EAA/IAA 失衡,提高血管性认知障碍大鼠认知能力的作用机制尚需更深入的研究探讨。
[1] 张丽香,蔺心敬,李吕力,等.血管性痴呆大鼠海马神经元凋亡与乙酰胆碱含量变化[J].中国老年学杂志,2009,29(24):3222-3224.
[2] 马桂贤,王丽娟.血管性认知障碍的分子机制和遗传学[J].国际脑血管病杂志,2006,14(11):819-822.
[3] 董晓华,张丹参,孟宪勇,等.Glu/GABA 水平相关性对学习记忆的影响[J].中国老年学杂志,2006,26(2):283-285.
[4] Rockwood K,Wentzel C,Hachinski V,et al.Prevalence and outcomes of vascular cognitive impairment[J].Neurology,2000,54(2):447.
[5] Guzik TJ,Marvar PJ,Gzesnikiewicz-Guzik M,et al.Perivascular adipose tissue as a messenger of the brain-vessel axis:Role in vascular inflammation and dysfunction[J].J Physiol Pharmacol,2007,58(4):591-610.
[6] 刘永惠,李少为,郑清莲.补肾健脑方对血管性痴呆大鼠乙酰胆碱和海马区ERK1和ERK2表达的影响[J].中国中西医结合杂志,2012,32(4):504-509.
[7] 阮迪云.神经生物学[M].合肥:中国科技大学出版社,2008:151.
[8] 余恩欣,王芳,常永志.脑复康软胶囊对血管性痴呆大鼠学习记忆功能的影响[J].中国新药杂志,2008;17(1):33-35.
[9] 曲娴,李春颖,苏畅,等.bFGF对拟血管性痴呆小鼠学习记忆及海马5-HT和DA 的影响[J].中国老年学杂志,2010,30(6):815-817.
[10] Zhao ZQ,Nakamura M,Wang NP,et al.Administration of adenosine during reperfusion reduces injury of vascular endothelium and death of myocytes[J].Coron Aretry Dis,1999,10(8):617-628.
[11] Zhang Y,Bendahan A,Zarbiv R,et al.Molecular determinant of ion selectivity of a(Na+-K+)-coupled rat brain glutamate transporter[J].Proc Natl Acad Sci USA,1998,95:741-755.
[12] Ohtani K,Tanaka H,Yasuda H,et al.Blocking the glycine-binding site of NMDA receptors prevents the progression of ischemic pathology induced by bilateral carotid artery occlusion in spontaneously hypertensive rats[J].Brain Res,2000,871:311-318.
[13] Saransaari P,Oja SS.Characteristics of hippocampal glycine release in cell-damaging conditions in the adult and developing mouse[J].Neurochemical Res,2001,26:845-852.
[14] Hutchinson PJ,O’Connell MT,Al-Rawi PG,et al.Increase in GABA concentrations during cerebral ischaemia:A microdialysis study of extracellular amino acids[J].Neurol Neurosurg Psychiatry,2002,72:99-105.
[15] 封银曼,郑攀,任小巧.补肾醒脑方对实验性血管性痴呆大鼠脑组织中谷氨酸、γ-氨基丁酸含量的影响[J].中医研究,2004,17(2):22-24.
[16] Gilby KL,Sydeserff SG,Robertsona HA.Differential neuroprotective effects for three GABA-potentiating compounds in model of hypoxia-ischemia[J].Brain Res,2005,103(5):196-205.
[17] 张士善,张力,张丹参.脑内Glu/GABA 学习记忆调节系统[J].药学学报,1997,32(8):638-640.
[18] 李花,刘旺华,刘建新.丹龙醒脑片对沙土鼠脑缺血再灌注保护作用的实验研究[J].中国中医药信息杂志,2003,10(5):29-31.
[19] 朱组成.肉苁蓉总苷对大鼠脑缺血再灌注后脑组织兴奋性氨基酸的作用[J].安徽医药,2010,14(12):1393-1394.
[20] 周伟勤.淫羊藿苷对快速老化小鼠SAMP8学习记忆的影响及作用机理研究[D].北京:北京协和医学院,中国医学科学院,北京协和医学院,清华大学医学部,中国医学科学院,2009.
[21] 赵小贞,王玮,康仲涵,等.黄精口服液对血管性痴呆大鼠学习记忆与海马突触可塑性的影响[J].神经解剖学杂志,2005,21(2):147-153.
[22] 曹建淳,徐丹令,陈斐.脑缺血大鼠海马组织间液EAA 的变化及丹参对其的影响[J].同济大学学报(医学版),2002,23(1):11-13.

