大针手法针刺督脉对癫痫大鼠海马神经细胞核转录因子-κB表达的影响
倪文杰,赵立新,段淑琴,贾希瑞,李新华,赵婷婷
癫痫(Epilepsy)是由多种原因引起的脑部兴奋性过高以致某些神经元突然过度异常放电,导致脑部功能短暂异常,临床表现为阵发性意识改变或丧失,同时可有阵发性抽搐、感觉异常、特殊感觉现象或行为障碍的一种慢性临床综合征。持续而频繁的癫痫发作可导致大脑神经元细胞的凋亡,本病长期反复发作,不仅使患者躯体遭受痛苦,而且在一定程度上导致精神及社会心理障碍,在智能及人格方面均受到损害。
许多实验研究发现,在癫痫发病中,核转录因子-κB(nuclear factor-kappaB,NF-κB)作为转录因子参与了急性炎症过程,作为细胞因子参与了神经兴奋和/或神经胶质瘢痕的形成。因此,本实验研究NF-κB在癫痫大鼠海马中的表达,进而研究大针手法对癫痫大鼠神经NF-κB表达的调节作用,对针刺治疗癫痫的作用机制进行研究,为针灸临床治疗癫痫提供新的理论依据。
1 材料与方法
1.1 实验动物 Wistar大鼠30只,体重200g~250g,雌雄各半,由山西省中医药研究院中心实验室提供,实验动物生产许可证号:SCXK(晋)2010-0002,实验动物使用许可证号:SYXK(晋)2010-0002,实验动物合格证号:0000014,室温22℃~26℃室内,湿度70%,分笼喂养。
1.2 试剂与仪器 氯化锂(Lithium chloride,美国Sigma 公司),毛果芸香碱(匹鲁卡品,Pilocarpine hydrochloride,美国Sigma公司),水合氯醛(Chloral hydrate,天津市科密欧化学试剂有限公司),多聚甲醛(Paraformaldehyde,天津市化学试剂研究所),兔抗NF-κB多克隆抗体(sc-372,美国Santa Cruz公司),山羊抗兔IgG(sp-9001,北京中杉金桥),DAB 显色试剂盒(ZLI-9032,北京中杉金桥公司),切片机(德国莱卡RM2015),离心机(北京离心机厂LDZ5-2型),电子天平(瑞士METTER AE100型),移液器(德国EPPENDORF),干燥箱(日本三洋MIR-153型),低温冰箱(日本三洋MDF-382E 型),恒温水浴箱(江苏太仓医用仪器厂DSHZ-300型),医用微波炉(浙江临安爱迪仪器厂YWY781B型),显微镜(日本OLYMPUS公司BX51T-PHDJ11),计算机图像处理系统CMOS(日本OLYMPUS公司),多功能真彩色细胞图像分析管理系统(美国Media Cybernetics公司Image-Pro Plus)。
1.3 实验方法
1.3.1 动物分组及模型制作 30只大鼠随机分为3组:空白对照组(Α 组)、癫痫模型组(Β 组)、大针手法组(C 组),每组10只,雌雄各半。Α 组:腹腔注射同等容量的生理盐水代替氯化锂和匹鲁卡品;Β组:腹腔注射氯化锂3 mmol/kg,24h后腹腔注射匹鲁卡品30mg/kg,分3次注射,每次间隔10min,直至出现无间歇的癫痫持续状态;C组:腹腔注射氯化锂3mmol/kg,24h后腹腔注射匹鲁卡品30mg/kg,分3次注射,每次间隔10min,直至出现无间歇的癫痫持续状态。
参考Racine分级标准(0级~V 级):0 级,正常;Ⅰ级,湿狗样颤动,面肌痉挛,如眨眼、动须、节律性咀嚼等;Ⅱ级,节律性点头;Ⅲ级,前肢阵挛;Ⅳ级,站立伴双侧前肢阵挛;Ⅴ级,跌倒失平衡,四肢抽动。B组、C组大鼠诱导出Ⅳ级~Ⅴ级癫痫持续状态(SE)且SE发作持续1h视为造模成功,SE发作持续1h后,予大鼠腹腔注射10%水合氯醛(300 mg/kg)终止发作,若注射水合氯醛30min后未终止发作,予150mg/kg重复注射,直至终止发作(以3次为最高限)。记录大鼠行为学变化。
1.3.2 治疗方法 Α 组、Β 组不做任何治疗;C 组用1寸不锈钢针,针刺大鼠督脉穴:风府、大椎、陶道、无名(2~3胸椎棘突之间)、身柱(取穴参照《实验针灸学》中大鼠的穴位),每日1次,每次20min,中间行针1次,平补平泻,治疗14d。
1.3.3 海马取材 针刺14d后,第15天时对大鼠脑组织进行取材。各组大鼠用10%水合氯醛腹腔注射,每只1mL,过度麻醉,迅速剪开胸腹腔,暴露心脏肝脏,先经左心室快速灌注4 ℃生理盐水300mL(灌注针由左心室进针穿入主动脉,止血钳固定,剪破右心耳,快速灌注生理盐水300 mL),后接含4%多聚甲醛的磷酸盐缓冲生理盐水(PBS,0.1 mol/L,pH=7.4)300 mL,先快后慢,灌注固定,大鼠迅速出现四肢颤动,颈部变硬,尾部变硬伸直,待大鼠全身僵硬后,迅速断头开颅取脑,将修整后的脑组织置于4%多聚甲醛中,4 ℃冰箱保存。24h后,将大鼠脑组织移入含20%蔗糖的0.1molPB溶液(磷酸盐缓冲液,pH=7.4,4 ℃)中至沉底。待脑组织下沉后,每个大脑半球于背侧海马最大断面处,切取3 mm 厚的组织,制成石蜡包块,再做冠状切片,厚度为4μm(冰冻切片机切取),每只大鼠切取4张切片,贴于经明胶处理过的载玻片上。
1.3.4 HE染色 石蜡切片经常规脱蜡入水后,在苏木素溶液浸染10min,1%盐酸酒精分色3s~5s(当深蓝紫色变为淡粉色则中止);氨水反蓝5min(由淡粉红色变为淡蓝色),自来水冲洗,终止反应,镜下观察,细胞核清晰染色呈蓝紫色,细胞浆及其他背景基本无色即可。伊红溶液染色5min,自来水冲洗,镜下观察,细胞浆呈红色,细胞核蓝色即可。随后经梯度乙醇脱水(从低浓度到高浓度,70%乙醇,80%乙醇,90%乙醇,100%乙醇,每级5min),每次2min,二甲苯透明2次,每次10min,最后用中性树胶封片。光镜下观察大鼠海马神经元形态学改变。
1.3.5 免疫组化染色 切片常规脱蜡至水,3%双氧水室温下作用10min后,以蒸馏水冲洗3 次,每次30s,滴加复合消化液,室温下作用10min,以蒸馏水冲洗3次,每次30s,滴加正常山羊血清封闭液室温20min,甩去多余液体,吸水纸吸取多余水分,滴加兔抗鼠NF-κB多克隆抗体(1∶50),4 ℃过夜;取出后自然复温30 min,PBS(pH7.4)冲 洗3 次,每 次5 min;滴加生物素标记山羊抗兔IgG(1∶100),37℃孵育20min,PBS(pH 7.4)冲洗3次,每次3min;滴加辣根酶标记链霉卵白素工作液(1∶100),37 ℃孵育20 min,PBS(pH7.4)冲洗3 次,每次3 min;DAB显色:使用DAB显色试剂盒内AB试剂各一滴,混合后加至切片。室温下显色,镜下控制反应时间,约5 min~20 min。然后用蒸馏水充分冲洗。苏木素复染。乙醇梯度脱水(70%乙醇,80%乙醇,90%乙醇,100%乙醇,每级5min)。二甲苯透明5min,中性树胶封片,晾干即可。每张切片测5个视野,以人机交互方式,由计算机计算出每个视野的NF-κB P65阳性细胞数及平均光密度,取其平均值。计算机图像处理系统由CMOS及多功能真彩色细胞图像分析管理系统组成。
1.3.6 主要观察指标 各组大鼠造模过程中行为学变化;各组大鼠海马神经细胞病理改变;各组大鼠海马神经NF-κB P65表达的变化。
1.4 统计学处理 采用SPSS17.0 统计软件对NF-κB P65阳性细胞数进行统计学分析。实验数据以均数±标准差表示,采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠行为学观察 A 组大鼠腹腔注射生理盐水后,行为活动无异常,无死亡。B 组和C 组大鼠腹腔注射氯化锂(3 mmol/kg)后,所有大鼠行为活动均无异常,24h后,腹腔注射匹鲁卡品(30mg/kg,分3 次 注 射,每 次 间 隔10 min)2 次 或3 次后,2min~15min内,大鼠逐渐出现外周胆碱能反应:立毛、流涎、颤抖、流血泪,同时或先后出现刻板行为:凝视不动、咀嚼、吸鼻或探索行为、湿狗样震颤、反复头颈上仰,随后出现眨眼、面肌痉挛、点头,口吐白沫,嘴唇、四肢皮肤发绀,甚至大小便失禁,最后出现反复双侧前肢阵挛伴直立、跌倒或翻转,部分动物出现四肢强直-阵挛发作。开始发作尚不频繁,随着时间延长,发作频率增高,全部达到Ⅳ级~Ⅴ级癫痫持续状态。SE 状态1h后,B组和C组大鼠腹腔注射10%水合氯醛(300mg/kg)终止发作。终止发作后,B组死亡1只,存活率90%,C组死亡1只,存活率90%,A 组存活率100%。B组与A 组存活率比较,差异无统计学意义;C组与A 组存活率比较,差异无统计学意义(P>0.05)。详见表1。

表1 各组大鼠存活率比较
2.2 各组大鼠海马神经细胞的病理改变 经HE染色后,光镜下观察海马组织病理改变:A 组海马CA1区神经元结构正常,排列整齐,形态完整,细胞核圆或椭圆形,规则,核膜清楚完整,染色质分布均匀,胞质内可见尼氏小体,核仁清晰可见。B组海马CA1区神经元排列不整齐,正常神经元数量显著减少,细胞间隙增大,部分神经元形态不完整,核膜结构不清楚,细胞核开始出现固缩,核仁不明显,胞浆浓缩深染,呈空泡样变,大部分细胞尼氏体消失,还可见变性坏死的神经细胞。C 组海马CA1区神经元排列较整齐,接近正常,正常结构的神经元较多,大部分神经元细胞核、核膜结构清楚,少部分细胞尼氏体消失或胞浆浓缩深染,变性或坏死的细胞较少,损伤程度较癫痫模型组轻。
2.3 各组大鼠海马NF-κB P65阳性细胞数的表达 免疫组化结果:A 组大鼠海马CA1区,棕黄色的NF-κB P65阳性反应物在胞浆、胞核染色非常弱,且几乎都分布于胞浆中,胞核中的阳性物质很少甚至没有。B组大鼠海马CA1区可见很多NF-κB P65阳性细胞表达,神经元细胞核、胞浆内棕黄色的NF-κB P65 的阳性反应物染色较正常组明显加深,多呈团块状分布,且胞核内染色较胞浆深。C组大鼠海马CA1区可见较少NF-κB P65阳性表达细胞,NF-κB P65阳性反应物在胞核、胞浆棕黄色染色非常浅,在胞核内的棕黄色染色较癫痫模型组染色浅,接近空白对照组,未见棕黄色染色团块状分布。详见表2。
表2 各组大鼠海马神经元NF-κB P65阳性细胞数表达
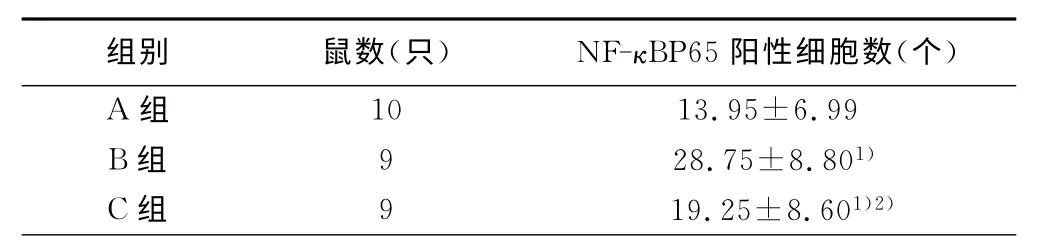
表2 各组大鼠海马神经元NF-κB P65阳性细胞数表达
与A 组比较,1)P<0.05;与B组比较,2)P<0.05
组别 鼠数(只) NF-κBP65阳性细胞数(个)A 组10 13.95±6.99 B组 9 28.75±8.801)C组 9 19.25±8.601)2)
3 讨 论
目前,对癫痫的发病机制尚未完全明了,在治疗癫痫方面,所有的抗癫痫化学药物都有不良反应。因此,探寻防治癫痫的新途径、新方法具有重要的意义。针灸治疗癫痫早在《内经》中就有记载,也是现在临床上较为有效的办法。针灸治疗癫痫选穴多样,但总的是以任、督穴位为多。彭光超[1]取穴鸠尾、筋缩、腰奇、间使、丰隆,痰热较盛加太渊;肝热加太冲;体弱加足三里,痊愈34例,显效10例,好转4例,无效6例。张智龙[2]用意气行针法治疗癫痫35 例,取丝竹空、三阴交、太冲、阴陵泉、阳陵泉、丰隆、内关(均双侧)、鸠尾、关元,从头到足依次取穴,针丝竹空得气后密切注意守气勿失,拇指向前捻转180°,紧捏针柄不动,意守针尖,以意聚气,待针下有跳动感时,以意行气,余穴用平补平泻法,痊愈25例,显效7例,好转2例,无效1例,总有效率97.14%。翟文生等[3]用醒脑开窍针法治疗60 例,治愈9例,显效18例,好转30例,无效3例。许永迅[4]采用芒针治疗102例,大椎透灵台,至阳透筋缩,脊中透命门,腰奇透长强,神庭透囟会,百会透后顶,璇玑透膻中,鸠尾透中院、内关(双)、丰隆、太冲、双侧顶颞前斜线,显效54例,有效25例,效差10例,无效13例。
已有研究表明,针刺可对癫痫动物中枢神经的脑电活动、神经递质、环核苷酸等产生影响[5],张颖[6]研究了针刺对电刺激癫痫大鼠模型的作用,发现针刺可显著降低癫痫大鼠的放电平均波幅、放电最高波幅及放电频率,提高其脑电基本频率,说明针刺可显著抑制痫性放电、控制癫痫发作。杨帆等[7]发现大鼠癫痫模型组脑内兴奋性氨基酸天门冬氨酸、谷氨酸升高明显,而抑制性氨基酸γ-氨基丁酸明显降低,经电针百会、风池后γ-氨基丁酸、丙氨酸明显升高,而谷氨酸降低明显。杨帆等[8]用戊四唑(PTZ)制作的点燃型癫痫大鼠模型海马结构内环磷腺苷(cAMP)、环磷鸟苷(cGMP)含量均有增加,其中cGMP 增加非常明显,经电针百会、风池、风府后cAMP、cGMP含量均明显降低,电针对PTZ 点燃型癫痫大鼠海马结构内cAMP、cGMP 含量的改变有一定的调节作用,对cAMP的调节迅速但持续时间短,而对cGMP的调节缓慢而持久。
NF-κB在癫痫发病机制中的作用也是目前研究热点之一,NF-κB是一种重要的核转录因子,参与真核细胞多种基因的表达调控,影响细胞的许多生物学功能[9],其活化形式通常是P50和P65,当细胞处于静息状态时,NF-κB 和其抑制因子IB 结合存在于细胞质中,当细胞受到各种刺激后,许多实验研究发现,在癫痫发病中,NF-κB作为转录因子参与了急性炎症过程,作为细胞因子参与了神经兴奋和/或神经胶质瘢痕的形成。Blondeau研究发现,海人藻酸可快速增加NF-κB与DNA 的连接活动度,使其亚单位产生核移位,认为NF-κB 活化作为癫痫发病机制的基础信号转导通路的一个关键步骤[10]。Matsuoka等[11]利用大鼠海人藻酸点燃模型发现痫性发作后4h~16h内海马神经元NF-κB活化明显增加,并伴胶质细胞NF-κB 持续活化。Crespel利用合并海马硬化的颞叶癫痫患者术后病理切片进行免疫组化分析发现,胶质细胞和大脑锥体细胞NF-κB/P65过度表达,并推测癫痫形成过程是由NF-κB 介导的炎症反应过程,其过程是一个被痫样发作反复、短折激活的慢性过程[12]。
用大针手法治疗癫痫是我院针灸专家冯尚武和郭耀康老师在长期的临床工作中,发现的一种治疗癫痫的针刺方法,疗效确切,已得到临床验证。此法是用21号、长3寸~4.5寸的不锈钢针,针刺督脉穴的风府、大椎、陶道、无名(胸椎2~3之间)、身柱。操作时,先用捻转法进针,当针尖到达两椎骨棘突之间时,改用缓慢推进法(不捻转慢慢向前推进),约当针尖达脊髓腔时,其方向为:若针风府穴,须使针和耳垂成水平线,缓慢推进;若针大椎、陶道、无名、身柱,均按45°~60°角向斜上方缓慢推进(注意:不可用力过猛,更不可行捻转捣刺术)。针到适应处时,患者常尖叫一声,全身抽动一次,此时立即停止针刺,患者意识不清的可能稍转清醒,有的可出现胸部灼憋闷,全身发麻发软,颜面苍白,瞳孔散大,全身肌肉松弛,出冷汗等症状,属正常反应,可留针15min~30 min。若在针刺狂躁厉害或体格强壮的患者时,未出现上述诸症之一者,可再行抽刺,抽刺时一般采用扇形往两侧抽刺,每抽刺一下,患者的腿随即跳动一下,抽刺后有的患者可出现双下肢的暂时性瘫软,一般在1h~2h 后即可恢复,必要时可架扶慢慢行走或适当休息。另外,如患者体质比较虚弱,可选用26~28号针进行针刺,以减少刺激。
本实验通过大针手法治疗癫痫大鼠,研究大针针刺督脉对癫痫大鼠神经NF-κB 表达的影响。证实癫痫大鼠的海马神经发生病理改变,大针手法针刺督脉穴位可以改善海马神经的病理改变,癫痫大鼠的海马神经NF-κB P65阳性细胞数的表达增多,减少海马神经NF-κB P65阳性细胞数的表达。针灸治疗癫痫可能是通过抑制海马神经细胞NF-κB 的表达,从而减轻了NF-κB作为转录因子参与的急性炎症过程,减少了NF-κB作为细胞因子参与的神经兴奋和/或神经胶质瘢痕的形成,从而减少正常海马神经细胞的凋亡,达到治疗癫痫、减轻癫痫症状的目的。
[1] 彭光超.针灸治疗癫痫54例的疗效观察[J].江西中医药,1990,21(3):40.
[2] 张智龙.意气行针发治疗癫痫35例临床观察[J].天津中医,1990,(1):30-31.
[3] 翟文生,王建明.醒脑开窍法治疗癫痫60 例[J].浙江中医杂志,1992,27(10):445.
[4] 许永迅.长针和头针为主治疗运动性癫痫[J].上海针灸杂志,1991,10(3):16-17.
[5] 李梦.针刺治疗癫痫的临床及实验研究进展[J].中国中医急症,2005,14(5):469-470.
[6] 张颖.针刺对电刺激致痫动物模型影响的实验研究[J].河南医药信息,1999,7(7):10-12.
[7] 杨帆,徐国龙,王频,等.电针对戊四唑点燃型癫痫大鼠脑内氨基酸含量的影响[J].针刺研究,2002,27(3):174.
[8] 杨帆,徐国龙,王频,等.电针对癫痫大鼠海马内cAMP,cGMP 含量的影响[J].中国中医药科技,2002,9(4):199-200.
[9] Rauch BH,Weber A,Braun M,et al.PDGF induced akt phosph orylation does not activate NF-κB in human vascular smooth mascle cells and fibroblasts[J].FEBs Letters(S0014-5793),2000,481(1):3-7.
[10] Erner Natoli M,Montpied P,Rousset MC,et al.Sequential expression of surfacean tigens and transcription factor NF-kappa B by hippocampal cells in excitotoxicity and experimental epilepsy[J].Epileps Res,2004,41(2):141-154.
[11] Matsuoka K,Kitamura Y,Okazaki AV,et al.Kainic acid-induced activation of nuclear factor-kappa B in rat hippocampus[J].Exp Brain Res,1999,124(2):215-222.
[12] Savaskan NE,Brauer AU,Kuhbacber M,et al.Selenuum deficiency increase susceptibility to glutamate induced excito toxicity[J].FASEB,2003,17(1):112-114.

