激肽释放酶对氧糖剥夺皮层神经元线粒体运动调节蛋白的影响1)
崔 梅,陈方哲,陈淑芬,陆征宇,董 强
组织激肽释放酶(tissu kallikrein,TK)是激肽释放酶-激肽系统(kallikrein-kinin system,KKS)的重要组成部分,主要通过其底物的酶解产物激肽,间接激活缓激肽B1 受体(B1R)和B2 受体(B2R)而参与体内许多生理和病理过程[1]。近年大量研究已经证实TK 或TK 基因对缺血再灌注损伤具有明确的保护作用,但对其机制却不甚了解。
神经元线粒体运动调节蛋白(Mitochondrial movement protein)的主要功能是调节线粒体在神经元中的移动,保证线粒体的正确分布以应对病理损伤[2]。在脑缺血过程中,线粒体的正常分布和运动对神经元功能的实现具有重要意义。激肽释放酶能否影响线粒体运动调节蛋白未见报道。因此,本研究旨在观察激肽释放酶对糖氧剥夺神经元线粒体运动调节蛋白的影响。
1 材料与方法
1.1 材料 新生SD 大鼠由上海斯莱克公司提供;D-Hanks液、DMEM 高糖培养液、Neurobasal A 培养液、B27supp lement、谷氨酰胺、胎牛血清、青霉素和链霉素等购自Gibco 公司;神经元特异性烯醇化酶(NSE),Miro1、Miro2、Milton 抗体购自Calbiochem 公司;抗大鼠微管相关蛋白(MAP2)多克隆抗体购自Abcam 公司;活细胞计数试剂盒(Cell Counting Kit-8,CCK-8)购于日本同仁公司;蛋白浓度测定试剂盒(BCA法)购于上海申能博彩生物试剂公司;组织激肽释放酶由广州天普公司提供。
1.2 皮层神经元原代培养 按文献报道[3]进行原代皮层神经元培养,主要步骤如下:断头取出生24h内SD 大鼠的脑组织,在预冷的D-Hanks液中用血管镊仔细去除脑膜和血管,分离出大脑皮层并经0.125%EDTA2胰蛋白酶37 ℃酶解10min,用吸口圆润的玻璃吸管吹打至细胞分散,细胞悬液于4℃1 000r/min 离心5min,弃上清,沉淀用神经元种植液(含90%DMEM高糖培养基和10%胎牛血清)重悬。根据实验需要,将细胞以2.5×105/mL~1.0×106/mL的密度种植于L-多聚赖氨酸(0.1mg/mL)包被的相应培养容器中,置持续通入混合气体(含95%O2和5%CO2)的37 ℃恒温培养箱内过夜。次日将培养液全部更换为神经元基本培养液(NeurobasalA 培养液含2%B27 supplement、0.5mmol/L谷氨酰胺、1%青霉素和1%链霉素),培养48h后在培养液中加入5-氟2′-脱氧尿苷(终浓度20μg/mL)以抑制胶质细胞生长,之后每隔3d~4d更换培养液,培养7d~10d。
1.3 神经元纯度鉴定 从培养7d~10d的神经元中任取一份,经MAP2免疫染色和Hoechst33342染色鉴定,用4%多聚甲醛室温固定30min,30%H2O2室温封闭,滴加1∶100 稀释的MAP2一抗,37 ℃1h,滴加荧光二抗,37 ℃1h 后,Ho echst 3 3 3 4 2染色。甘油封片。阴性对照用PBS液代替一抗,Olympus荧光显微镜400倍视野下,随机选取6个区域,计数神经元结构蛋白MAP2 阳性细胞和视野中所有hoechst阳性细胞,用总MAP2阳性细胞数占hoechst阳性细胞数的百分率表示神经元纯度。
1.4 神经元氧糖剥夺模型(OGD)的建立 神经元OGD 再恢复损伤模型:取培养7d~10d的皮层神经元(吸出培养液置无菌管中待用)用正常细胞液洗涤神经元3次,加入预先用无氧混合气体(含5%CO2、10%H2和85%N2)饱和的无糖细胞液后置厌氧培养箱内,持续通入无氧混合气体(含5%CO2、10%H2和85%N2)使箱内氧浓度低于1%,90min后从厌氧培养箱取出细胞,用正常细胞液洗涤3次,加入吸出待用的培养液,置常氧培养箱内培养4h。
1.5 实验分组及处置 皮层神经元培养至第7天,随机分为正常培养组(C 组)、正常培养+TK 干预组(C+TK 组)、氧糖剥夺组(OGD 组)、氧糖剥夺+TK 干预组(OGD+TK 组)。C 组按正常培养方法培养;C+TK 组在正常培养的神经元培养液中加入血TK 使其终浓度为100nmol/L 后按正常培养24h;OGD组神经元进行缺糖、缺氧后复糖、复氧处理;OGD+TK 组神经元用100nmol/L TK 处理24h 后进行缺糖、缺氧后复糖、复氧处理。
1.6 神经元活力检测 按活细胞计数试剂盒说明书操作检测神经元存活率。将培养至7d的96孔板内皮层神经元按上述1.5方法进行干预。干预结束时,弃去上述各组神经元培养液,用正常细胞液洗涤3 次,每孔加入神经元活力检测液100μL(含10%CCK-8液和90%NeurobasalA 液),37 ℃培养箱孵育
2 结 果
2.1 神经元纯度 培养7d 的神经元用神经元特异性的MAP2进行检验后,结果表明按上述方法培养的神经元纯度至少为90%。
2.2 TK 对OGD 后神经元存活率影响 C+TK 组神经元存活率与C 组比较差异无统计学意义(P>0.05);与C 组比较OGD 组神经元存活率显著下降(P<0.01);与OGD 组比较,OGD+TK 组神经元存活率升高(P<0.01)。详见表1。1h~3h。以仅有检测液的孔为空白对照,在450nm 为测定波长,630nm 为参比波长条件下,测定各样品的吸光度(OD 值)。每组取4个复孔,分别进行3次独立实验。按公式:神经元存活率(%)=实验组OD 值/对照组OD 值×100%计算神经元存活率。
1.7 Caspase-3活性检测 将接种于直径10cm 培养皿内的皮层神经元培养至第7 天,各组神经元处理方法同上述1.5。干预结束后,收集各组细胞,加入RIPA 蛋白质提取液,4 ℃静置1 h(期间吹打数次使细胞充分裂解)后,4 ℃18 000g 离心20 min,取上清液,按BCA 法蛋白浓度测定试剂盒说明书测定上清液的蛋白浓度。Caspase-3活性测定:按Caspase-3 活性检测试剂盒(R&D 公司)说明书操作。简言之,按100μg蛋白的量提取的蛋白上清液,与等体积反应缓冲液混合后用试剂盒内的蛋白稀释液将各组混合液体积调节至200μL,分别加入96孔板内,每孔再加5μL Caspase-3荧光底物,混匀后置37 ℃孵育2 h。以双蒸水替代蛋白上清液、反应缓冲液及底物组成的等体积混合液为对照1(C1),以不含反应底物的混合液为对照2(C2),以505nm 为测定波长,650nm 为参比波长,测定各孔的吸光度(OD 值)。每次实验取3 个复孔,分别进行3 次独立实验。按公式:Caspase-3相对活性=实验组OD 值-(C1+C2)OD 值/对照组OD 值-(C1+C2)OD 值计算各组Caspase-3的相对活性。
1.8 Miro1、Miro2、Milton蛋白表达的检测 用Western blot法,内参照为GAPDH。RIPA 提取细胞总蛋白,按BCA 法蛋白浓度测定试剂盒说明书测定蛋白浓度。行SDS-PAGE 不连续凝胶电泳,蛋白上样量50μg。湿式转模(150 mA,1.5h)后,5%脱脂牛奶封闭2h。分别加兔抗大鼠Miro1、Miro2、Milton单克隆抗体,分别按1∶200,1∶200,1∶250稀释,室温孵育2 h,将膜与二抗稀释液中的辣根过氧化物酶标记的羊抗兔二抗(1∶3 000)室温封闭1h,酶法显色。图像分析系统测各条带平均吸光度(A)值和条带的面积,每一条带的蛋白含量用此条带的吸光度值乘以条带的面积与同一样本的GAPDH 条带的吸光度值乘以条带的面积的比值表示。
表1 TK 对OGD损伤神经元存活率的影响

表1 TK 对OGD损伤神经元存活率的影响
与C组比较,1)P<0.01;与OGD组比较,2)P<0.01
组别 神经元存活率(%)C组100 C OG+DTK组 组 6973..21±±02..6 11)OGD+TK 组 82.4±0.61)2)
2.3 TK 对OGD 后神经元Caspase-3活性的影响 与C 组比较,单纯OGD 可显著诱导Caspase-3的活化(P<0.01);TK 能拮抗OGD 所诱导的Caspase-3活性增加。详见表2。
表2 TK 对OGD损伤神经元Caspase-3相对活性的影响

表2 TK 对OGD损伤神经元Caspase-3相对活性的影响
与C组比较,1)P<0.01;与OGD组比较,2)P<0.01
组别 Caspase-3相对活性C组1.02±0.05 C+TK 组 1.01±0.04 OGD组 1.84±0.031)OGD+TK 组 1.41±0.091)2)
2.4 TK 对OGD 后神经元Miro1,Miro2和Milton蛋白的影响
C+TK 组神经元Miro1,Miro2 和Milton表达量较C组高(P<0.01);OGD 组与C组相比,Miro1、Miro2、Milton表达量均明显下降(P<0.01);而TK 干预可显著逆转OGD 所导致的神经元线粒体运动蛋白Miro1,MMiro2,Milton的表达变化(P<0.01)。详见表3。
表3 TK 对OGD后神经元Miro1,Miro2和Milton蛋白的影响
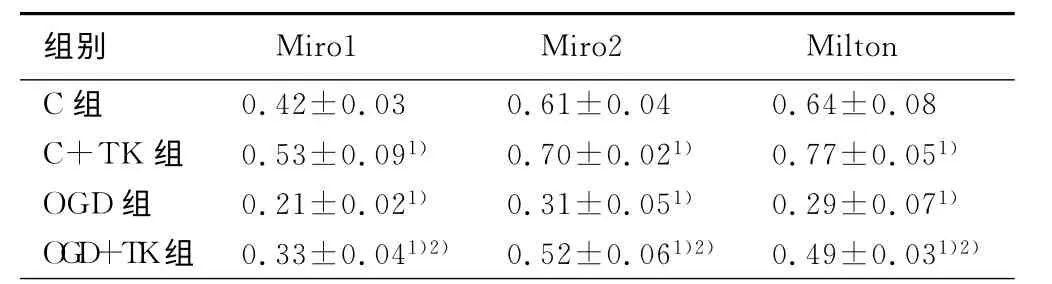
表3 TK 对OGD后神经元Miro1,Miro2和Milton蛋白的影响
与C组比较,1)P<0.01;与OGD组比较,2)P<0.01
组别 Miro1 Miro2Milton C组0.42±0.03 0.61±0.04 0.64±0.08 C+TK 组 0.53±0.091) 0.70±0.021) 0.77±0.051)OGD组 0.21±0.021) 0.31±0.051) 0.29±0.071)OGD+TK组 0.33±0.041)2) 0.52±0.061)2) 0.49±0.031)2)
3 讨 论
脑组织是能量要求极高的器官,在缺血后由于氧气及葡萄糖供应缺乏,神经元出现了严重的细胞能量代谢障碍。而与之伴随的是细胞兴奋性氨基酸释放增多,钙离子调节障碍及细胞凋亡,线粒体是神经细胞中非常重要的细胞器,它们给神经细胞提供能量,支持神经细胞活动,线粒体能够产生三磷酸腺苷(ATP)维持神经细胞的正常运转。
由于神经细胞具有非常特殊的形状,具有很多长而突出的树突和轴突,线粒体由于其大小和功能的局限性,往往需要从细胞内较远的地方迁移到另一个位置来完成某些功能,因此需要完善的调节机制来保证。近年来,众多学者提出了线粒体动力调节蛋白的概念[4-6]。即在神经元轴突末梢释放递质时,需要大量能量供应,此时细胞将线粒体迅速转运到能量要求高的部位。线粒体动力调节蛋白的主要功能是保证细胞内线粒体的正确分布,以应对病理损伤。如果细胞缺失这种蛋白,那么神经元中大量的线粒体就离开它们正常的位置而回到胞体周围,只留下一些空洞和没有线粒体支持的树突和轴突[7]。目前研究认为Miro蛋白(Miro1 和Miro2)和Milton 蛋白是主要的线粒体动力调节蛋白。
有关TK 在缺血性脑损伤中的作用,Xia等[8]应用TK 转基因鼠进行研究,提示TK 在脑梗死中有明确的神经保护作用,可减少脑梗死体积、减少梗死后的细胞凋亡、减弱脑内的氧化应激反应、增加胶质细胞的存活和迁移。同样在体外细胞培养[9]中也发现TK 干预能够剂量依赖地抑制神经细胞的凋亡。邵渊等[10,11]发现,TK 和带有蛋白质转导域的激肽释放酶(PTD-kallikrein)均可通过缓激肽受体的介导而明显减轻OGD 后再恢复正常所诱导的神经元损伤以及MCAO 大鼠的再灌注损伤。这些研究结果提示缺血后TK 发挥了神经保护作用。而关于TK在脑缺血后发挥神经保护作用的具体机制目前还不明确。
本研究结果显示,TK 在OGD 诱导的皮层神经元损伤中具有明确的保护作用,TK 能够显著增加OGD 后皮层神经元的存活率。并能抑制Caspase-3激活,减少神经元凋亡。表明TK 对OGD 后皮层神经元具有神经保护作用。
而对于TK 对OGD 后神经元内线粒体动力调节蛋白的影响,目前尚未见有文献报道。本研究发现,OGD 可显著降低线粒体动力蛋白Miro1、Miro2 和Milton 蛋白的表达,提示在OGD 损伤后神经元内存在线粒体动力调节障碍。这可能与OGD 后细胞能量代谢障碍过程密切相关。而TK 干预可以显著逆转OGD 所导致的Miro1、Miro2 和Milton 蛋白表达变化。提示TK 对OGD 后神经元的保护作用可能与诱导线粒体运动调节蛋白表达有关。
综上所述,皮层神经元在TK 干预后,可以显著上调神经元线粒体运动调节蛋白Miro1、Miro2 和Milton的表达,保护了神经元。但其机制有待进一步的研究。
[1] Campbell DJ.The kallikrein-kinin system in humans[J].Clin Exp Pharmacol Physiol,2001,28:1060-1065.
[2] Chan DC.Mitochondria:Dynamic organelles in disease,aging,and development[J].Cell,2006,125:1241-1252.
[3] Xiong ZG,Zhu XM,Chu XP,et al.Neurop rotection in ischemia:Blocking calcium permeable acid sensing ion channels[J].Cell,2004,118:687-698.
[4] Detmer SA,Chan DC.Functions and dysfunctions of mitochondrial dynamics[J].Nat Rev Mol Cell Biol,2007,8:870-879.
[5] Otera H,Mihara K.Mitochondrial dynamics:Functional link with apoptosis[J].Int J Cell Biol,2012,2012:821676.
[6] Chang CR,Blackstone C.Dynamic regulation of mitochondrial fission through modification of the dynamin-related protein Drp1[J].Ann N Y Acad Sci,2012,1201:34-39.
[7] Benard G,Karbowski M.Mitochondrial fusion and division:Regulation and role in cell viability[J].Semin Cell Dev Biol,2009,20:365-374.
[8] Xia CF,Smith RS,Shen B,et al.Postischemic brain injury is exacerbated in mice lacking the kinin B2receptor[J].Hypertension,2006,47:752-761.
[9] Liu L,Liu H,Yang F,et al.Tissue kallikrein protects cortical neurons against hypoxia/reoxygenation injury via the ERK1/2pathway[J].Biochem Biophys Res Commun,2011,407:283-287.
[10] 邵渊,任惠民,董强.PTD kallikrein对大鼠MCAO 模型缺血再灌注损伤的保护作用[J].神经损伤与功能重建,2007,2:152-156.
[11] 邵渊,唐敏,任惠民,等.蛋白质转导域2激肽释放酶对缺糖、缺氧后再恢复的神经元的保护作用[J].中国临床神经科学,2007,15:337-347.

