黄芪甲苷、人参皂苷Rg1、Rb1和三七皂苷R1抗小鼠脑缺血再灌注氧化应激损伤和促进能量代谢的配伍研究
黄小平,王 蓓,邱咏园,曾 嵘,邓常清,唐映红*
(湖南中医药大学分子病理实验室,湖南省中西医结合心脑血管疾病重点实验室,细胞生物学与分子技术湖南省高校重点实验室,湖南 长沙 410208)
黄芪甲苷、人参皂苷Rg1、Rb1和三七皂苷R1抗小鼠脑缺血再灌注氧化应激损伤和促进能量代谢的配伍研究
黄小平,王 蓓,邱咏园,曾 嵘,邓常清,唐映红*
(湖南中医药大学分子病理实验室,湖南省中西医结合心脑血管疾病重点实验室,细胞生物学与分子技术湖南省高校重点实验室,湖南 长沙 410208)
目的 从氧化应激和能量代谢研究黄芪甲苷、人参皂苷Rg1、Rb1和三七皂苷R1抗小鼠脑缺血再灌注损伤的配伍关系,明确其有效的配伍剂量。方法 采用L9(34)正交试验法,将C57BL/6小鼠随机分组,连续给药3 d后结扎双侧颈总动脉造成脑缺血20 min,再灌注30 min,测定脑组织三磷酸腺苷(ATP)、还原型谷胱甘肽(Glutathione,GSH)含量、丙二醛(Malonaldehyde,MDA)的含量及超氧化物歧化酶(Superoxide Dismutase,SOD)的活性。结果 黄芪甲苷、人参皂苷Rb1、Rg1和三七皂苷R1能增加脑组织中ATP、GSH含量和SOD活性,降低MDA的含量,对脑缺血再灌注后的氧化应激损伤具有抑制作用,改善脑组织能量代谢。4种有效成分配伍具有增强抗脑缺血再灌注损伤的作用。结论 4种有效成分抗小鼠脑缺血再灌注后氧化应激损伤和改善能量代谢的有效配伍剂量为黄芪甲苷40 mg/kg,人参皂苷Rg150 mg/kg,人参皂苷Rb140 mg/kg,三七皂苷R110 mg/kg。
黄芪甲苷;人参皂苷Rg1;人参皂苷Rb1;三七皂苷R1;配伍;脑缺血再灌注;氧化应激;能量代谢
缺血性脑损伤的病理过程极为复杂,其发病机制与脑组织能量代谢障碍、兴奋毒性、氧化应激、炎症反应等有关[1]。中医药理论认为,缺血性脑损伤的基本病理机制多为气虚血滞、脉络瘀阻,因此,常采用益气活血法治疗[2]。研究表明,黄芪和三七具有抗脑缺血的作用,二者配伍可增强其抗缺血性脑损伤的作用。黄芪中的主要有效成分是黄芪总皂苷(Astragalosides,AST),主要含黄芪甲苷等活性成分;三七中的主要有效成分是三七总皂苷(Panax notoginseng saponins,PNS),主要含人参皂苷Rg1、Rb1和三七皂苷R1等活性成分。我们以往的研究表明,AST和PNS配伍具有增强其抗脑缺血的作用[3-5]。因此,我们认为,中药有效组分配伍协同增效的作用是其有效成分合理配伍作用的结果[6],AST和PNS配伍增强抗脑缺血作用是其有效成分配伍所致。为进一步明确黄芪和三七配伍增强抗脑缺血作用的机制,本研究对其主要的有效成分进行了配伍关系的研究。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级C57BL/6雄性小鼠,体质量为22~28 g,由湖南中医药大学实验动物中心提供,许可证号:SCXK(湘)2009-0004。饲养于室温25℃,湿度55%的环境。
1.1.2 药物 黄芪甲苷 (批号:MUST-09102301)、人参皂苷Rg1(批号:MUST-11041201)、人参皂苷Rb1(批号:MUST-11042801)、三七皂苷R1(批号MUST-11041201),纯度均≥98%,均由成都曼思特生物科技有限公司提供,用时溶于5%羧甲基纤维素钠溶液中。
1.1.3 试剂与仪器 脂质过氧化物丙二醛(MDA)含量测定试剂盒(批号:20120222)、谷胱甘肽(GSH)含量测定试剂盒(批号:20120220)、超氧化物歧化酶(SOD)活性测定试剂盒(批号:20120218)、考马斯亮蓝化学比色法总蛋白含量测定试剂盒 (批号:20111212),均购于南京建成生物工程研究所。ATP标准品为Sigma公司产品,其他试剂为国产分析纯。液相色谱仪(Agilent 1200 series),液相色谱柱(Hypersil,ODS2,5μm,250 mm×4.6 mm)。
1.2 方法
1.2.1 分组和给药方法 前期实验表明[3],PNS和AST抗脑缺血的有效配伍剂量为AST 110 mg/kg+ PNS 115 mg/kg。换算成各有效成分的剂量为:黄芪甲苷41.8 mg/kg,人参皂苷Rg158 mg/kg,人参皂苷Rb135.5 mg/kg,三七皂苷R114.4 mg/kg。以本剂量为依据,分别设立高、中、低剂量水平,采用L9(34)正交试验,共组成9个配伍组合(见表1)。另设假手术对照组(即试验组0,予0.5%的羧甲基纤维素钠溶液),共10组,按0.1 mL/10 g灌胃给药,每日1次,连续给药3 d,于末次给药1 h后造模,术前禁食12 h。按文献方法制备脑缺血再灌注模型[7]。将小鼠以无水乙醚吸入麻醉后仰卧位固定,在颈部正中做1 cm垂直切口,分离颈总动脉及伴行的迷走神经,夹闭双侧颈总动脉,造成脑缺血,20 min后恢复血流,再灌注30 min后断头取脑,去除小脑和脑干,做相应指标检测。假手术组也进行同样手术,但不行脑缺血再灌注,其他操作与以上各组相同。
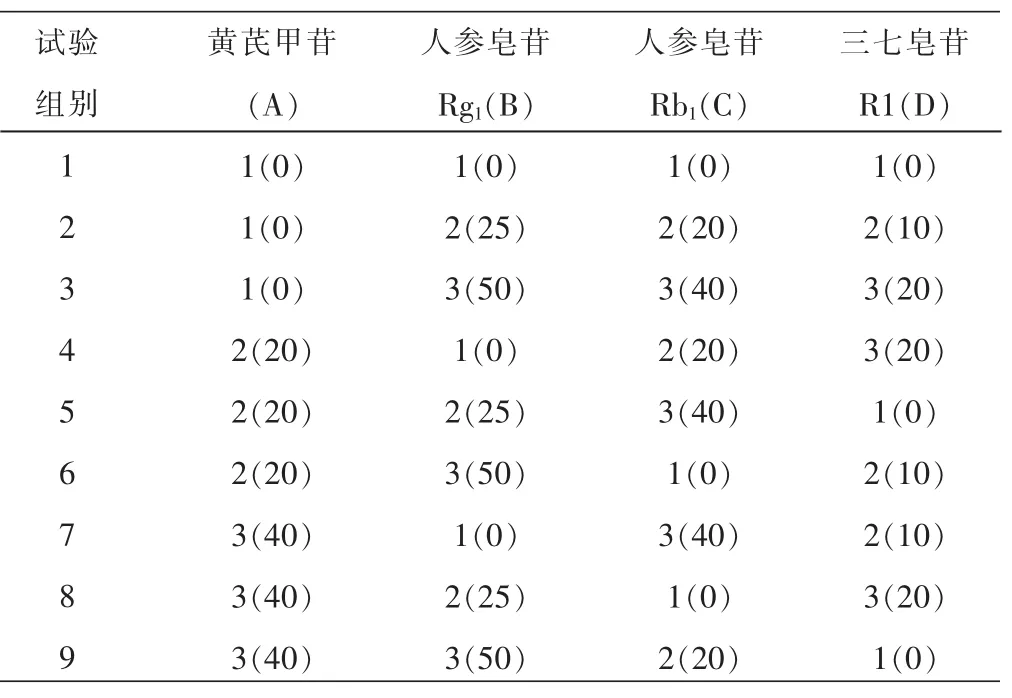
表1 L9(34)筛选4种有效成分配伍给药剂量表(mg/kg,n=4)
1.2.2 氧化应激指标的测定 取左脑皮质约120 mg,按质量/体积1∶9以0.01 mol、pH 7.4的磷酸盐缓冲液制成10%组织匀浆液,4℃离心5 min(2 500 r/min),取上清液按试剂盒说明测定MDA、 GSH、SOD。
1.2.3 脑组织 ATP的测定 取右脑皮质约120 mg,按质量/体积1∶9以5%的冷高氯酸制成10%组织匀浆液,4℃离心15 min(15 000 r/min),取上清液约0.8 mL,加入 3 mol/L的 K2CO3约0.12 mL,调pH至中性,4℃离心5 min(3 000 r/min),取上清液以高效液相色谱(HPLC)测定ATP含量。HPLC测定条件:ODS-18液相色谱柱;流动相为 K2HPO4(A)-KH2PO4(B),梯度洗脱:0~12 min,86.8%B,12~22 min,85.5%B,22~38 min,86.8%B;柱温25℃;检测波长:254 nm;流速:0.7 mL/min;进样量:10 μL。
1.3 统计学分析
2 结果
2.1 各组氧化应激指标和ATP的比较
与假手术组比较,模型组脑组织ATP、GSH含量显著降低,MDA含量显著增加,而SOD活性降低(均P<0.01);与模型组比较,各配伍组均能不同程度地升高ATP、GSH含量(P<0.05或P<0.01),降低MDA含量(P<0.01),使SOD活性升高(P<0.05或P< 0.01)。见表2。
表2 各组氧化应激指标和ATP的比较 (±s,n=4)

表2 各组氧化应激指标和ATP的比较 (±s,n=4)
注:vs.假手术组(试验组0)△P<0.05,△△P<0.01;vs.模型组(试验组1)★P<0.05,★★P<0.01。
试验组别0 1 2 3 4 5 6 7 8 9 ATP(μg/g组织)503.60±48.57 285.16±44.79△△428.23±26.95★★394.28±21.82★★398.95±12.77★★249.69±7.86 504.84±34.47★★679.77±22.01★★329.05±8.38★464.87±28.13★★SOD(U/mg蛋白)65.41±1.71 38.97±1.68△△45.26±1.27★★44.51±3.13★★45.07±3.71★★58.02±2.43★★40.73±3.12 46.22±2.27★★59.78±2.03★★43.69±2.50★MDA (nmol/mg蛋白) 75.64±2.77 115.63±3.28△△97.74±2.20★★74.64±2.76★★78.38±1.25★★79.88±2.38★★62.54±1.72★★108.58±5.88★★119.32±2.22 105.70±1.50★★GSH(mg/g蛋白)3.40±0.40 1.17±0.37△△1.70±0.25★2.38±0.52★★2.32±0.28★★3.23±0.43★★1.39±0.30 2.31±0.23★★2.07±0.32★★3.24±0.40★★
2.2 各指标的正交试验分析
ATP应当以含量高为好,故在本实验条件下,配伍剂量应以 A3B3C3D2为最佳方案,即黄芪甲苷40 mg/kg,人参皂苷Rg150 mg/kg,人参皂苷Rb140 mg/kg,三七皂苷R110 mg/kg。
SOD应当以活性高为好,故在本实验条件下,配伍剂量应以A3B2C3D3为最佳方案,即黄芪甲苷40 mg/kg,人参皂苷Rg125 mg/kg,人参皂苷Rb140 mg/kg,三七皂苷R120 mg/kg。
MDA应当以含量低为好,故在本实验条件下,配伍剂量应以A2B3C3D2为最佳方案,即黄芪甲苷20 mg/kg,人参皂苷Rg150 mg/kg,人参皂苷Rb140 mg/kg,三七皂苷R110 mg/kg。
GSH应当以含量高为好,故在本实验条件下,配伍剂量应以A3B3C3D1为最佳方案,即黄芪甲苷40 mg/kg,人参皂苷Rg150 mg/kg,人参皂苷Rb140 mg/kg,三七皂苷R10 mg/kg。见表3-6。
2.3 正交试验的综合分析
由于氧化应激指标和能量代谢指标在缺血性脑损伤中的重要性不一样,故对各指标赋予不同权重系数:ATP为0.3,SOD为0.25,MDA为0.25(由于要求MDA值越小越好,故在计算MDA的权重计分时,将MDA结果取倒数再乘以权重系数),GSH为0.2,则综合评分(Y)=0.3ATP+0.25SOD+0.25/MDA+ 0.2GSH,对综合评分进行正交试验的方差分析,结果见表7。
综合计分分析表明:4种有效成分配伍时,各成分不同水平之间均有显著性差异(P<0.01)。综合计分以得分值高为好,故配伍剂量应以A3B3C3D2为最佳方案,即黄芪甲苷 40 mg/kg,人参皂苷 Rg150 mg/kg,人参皂苷Rb140 mg/kg,三七皂苷R110 mg/kg。
3 讨论
中药是通过多成分、多靶点发挥作用的。中药有效组分的总体效应不能用每一成分单独作用的线性叠加来表示,而是其中的有效成分综合作用的结果。因此,根据中医药理论和现代中药研究成果,将中药有效成分合理配伍将可能发挥增强疗效、减少毒副反应的作用,使药物配伍组方实现定量化[8]。以往我们基于方剂配伍理论和药理机制,对黄芪和三七的有效组分配伍抗脑缺血作用进行了研究,这为进一步开展三七和黄芪的有效成分配伍研究,创制成分清楚、机制明确、效应增强的中药有效成分配伍组方奠定了实验依据。

表3 ATP正交试验的方差分析 (μg/g组织,n=4)
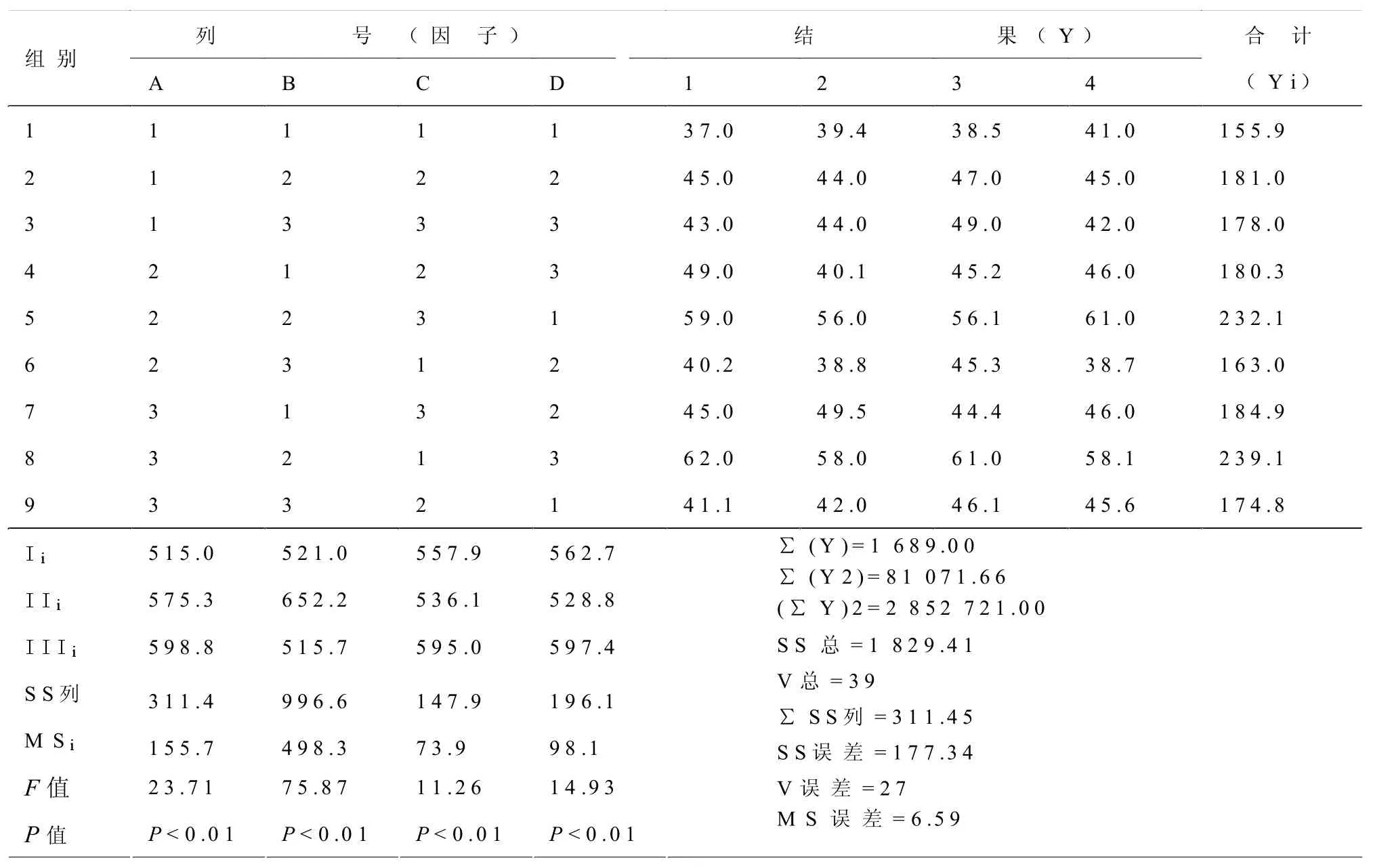
表4 SOD正交试验的方差分析 (U/mg蛋白,n=4)

表5 MDA正交试验的方差分析 (nmoL/mg蛋白,n=4)

表6 GSH正交试验的方差分析 (mg/g蛋白,n=4)

表7 赋予各指标不同权重后的综合计分的方差分析 (n=4)
脑缺血后病理变化十分复杂,主要病理生理机制有能量代谢障碍,自由基、一氧化氮(NO)和兴奋性氨基酸(EAA)的神经毒作用,血脑屏障(BBB)破坏等[8-11]。脑缺血后,脑组织的主要化学能量ATP急剧减少,高能磷酸化合物生成减少,造成脑组织能量代谢障碍。同时产生大量的超氧阴离子和羟自由基,与细胞膜上脂质发生脂质过氧化反应,使GSH含量减少,SOD活性降低,以及MDA含量增加,破坏膜功能和线粒体的呼吸功能,进一步使能量生成障碍。我们根据以往的研究成果,采用正交试验方法,对黄芪和三七苷类有效组分的四种主要有效成分进行了抗脑缺血的有效配伍研究。结果表明,黄芪甲苷、人参皂苷Rg1、Rb1和三七皂苷R1配伍能增加脑组织中ATP、GSH含量和SOD活性,减少MDA的生成,对抗脑缺血再灌注损伤。提示黄芪和三七配伍抗脑缺血的作用是来自于其中有效成分合理配伍的结果,不同的有效成分可能作用于不同的靶点,从而发挥对脑缺血的综合防治作用。综合评价其抗氧化应激损伤和增强能量代谢的效应,我们得出:黄芪甲苷、人参皂苷Rg1、Rb1和三七皂苷R1的有效配伍剂量为:黄芪甲苷40 mg/kg,人参皂苷Rg150 mg/kg,人参皂苷Rb140 mg/kg,三七皂苷R110 mg/kg。这为进一步合理利用黄芪和三七的有效成分开发有效的抗脑缺血中药有效成分配伍复方奠定了基础。
[1]张春霞,胡利民,康立源,等.脑缺血氧化应激损伤及中药拮抗作用研究进展[J].中华中医药学刊,2007,25(12):2 509-2 511.
[2]秦晓康,朱萱萱.中药治疗缺血性脑损伤研究进展[J].实用中医内科杂志,2008,22(11):84-86.
[3]谭 华,黄小平,邓常清.黄芪总苷和三七总皂苷配伍对小鼠缺血再灌注脑组织氧化应激的影响 [J].中西医结合学报,2010,8(5):448-452.
[4]黄小平,谭 华,陈北阳,等.黄芪总苷和三七总皂苷配伍对脑缺血再灌注后MMP-9和TIMP-1表达的影响 [J].中国中药杂志,2010,35(16):2 187-2 191.
[5]黄小平,谭 华,邓常清,等.黄芪总苷和三七总皂苷配伍对小鼠脑缺血再灌注脑组织能量代谢的影响[J].湖南中医药大学学报,2012,32(7):19-22,40.
[6]邓常清,黄小平.基于方剂配伍理论和药理机制的中药有效组(成)分配伍研究思路[J].湖南中医药大学学报,2011,31(11):3-6.
[7]YonekuraI, KawaharaN, NakatomiH, etal.A model of global cerebral ischemia in C57 BL/6 mice[J].J Cereb Blood Flow Metab,2004,24(2):151-158.
[8]张海燕.中药复方配伍的研究进展 [J].华北煤炭医学院学报,2010,12(5):648-649.
[9]Nielson C,Fleming RM.Blood glucose and cerebrovascular disease in nondiabetic patients[J].Angiology,2007,58(5):625-629.
[10]Choi YS,Cho KO,Kim EJ,et al.Ischemic preconditioning in the rat hi ppocampus increases antioxidant activities but does not affect the level of hydroxyl radicals during subsequent severe ischemia[J].Exp Mol Med,2007,39(4):556-563.
[11]Nishimura M,Izumiya Y,Higuchi A,et al.Adiponectin prevents cerebral ischemic injury through endothelial nitric oxide synthase dependent mechanisms[J].Circulation,2008,117(2):216-223.
[12]McEwen BS, Reagan LP.Glucose transporter expression in the central nervous system:relationship to synaptic function[J]. Eur J Pharmacol,2004,490(1-3):13-24.
(本文编辑 杨 瑛)
The Combination Study of Astragaloside IV,Ginsenosides Rg1,Rb1and Notoginsenoside R1on Antagonizing Oxidative Stress Injury and Promoting Energy Metabolism after Ischemia-reperfusion in Mice
HUANG Xiaoping,WANG Bei,QIU Yongyuan,ZENG Rong,DENG Changqing,TANG Yinghong*
(Molecular Pathology Laboratory of Hunan University of Chinese Medicine,Key Laboratory of Hunan Province for Prevention and Treatment of Integrated Traditional Chinese and Western Medicine on Cardio-cerebral Diseases,Key Laboratory of Hunan Universities for Cell biology and Molecular techniques,Changsha,Hunan 410208,China)
astragaloside IV; ginsenoside Rg1; ginsenoside Rb1; notoginsenoside R1;combination;cerebral ischemia-reperfusion;oxidative stress;energy metabolism
R743.31,R285.5
A
10.3969/j.issn.1674-070X.2014.07.002.005.07
2013-03-24
国家自然科学基金资助项目(81102557);教育部2010年度高等学校博士学科点专项科研基金资助项目(20104323110001);湖南省高校创新平台开放基金资助项目(11K050);湖南省教育厅一般项目(11C0963);湖南省中医药管理局重点项目(201301);湖南省科技厅一般项目(2014SK3001)。
黄小平,女,副教授,主要研究方向为心脑血管疾病的防治研究。
*唐映红,女,硕士研究生导师,教授,E-mail:dchangq@sohu.com。
〔Abstract〕Objective To study the combination relativity among Astragaloside IV, Ginsenoside Rg1,Rb1and Notoginsenoside R1againstischemia-reperfusion injury through oxidative stress and energy metabolism,expliciting the effective combination dose.Methods Using L9(34)orthogonal experimental method,C57BL/6 mice were randomly grouped,treated for 3 d.At 1 h after the last administration,bilateral common carotid artery (CCA)were occluded with artery clip for 20 min followed by reperfusion for 30 min,to detect the contents of adenosine triphosphate (ATP),glutathione (GSH),malondialdehyde (MDA)and the activity of superoxide dismutase(SOD)in brain tissues.Results Astragaloside IV,ginsenosides Rb1,Rg1and notoginsenoside R1increased the contents of GSH,ATP and the activity of SOD,decreased MDA content,having inhibitory effect on oxidative stress injury after cerebral ischemia-reperfusion and improving energy metabolism ofbrain tissues.Fouractive components combination potentiated the effect against cerebral ischemia-reperfusion injury. Conclusion The effective combination dose of four active component antagonizing oxidative stress injury and improving energy metabolism after ischemia-reperfusion in mice was Astragaloside IV 40 mg/kg,ginsenosides Rg150 mg/kg,ginsenosides Rb140 mg/kg,notoginsenoside R110 mg/kg, respectively.

