耐热链霉菌4″-O-异戊酰基转移酶基因在变铅青链霉菌TK24中的表达
张家瑚,钟晶晶,戴剑漉,王以光,夏焕章,赫卫清
1 沈阳药科大学生命科学与生物制药学院,辽宁 沈阳 110016
2 中国医学科学院/中国协和医科大学医药生物技术研究所 卫生部抗生素生物工程重点实验室,北京 100050
耐热链霉菌4″-O-异戊酰基转移酶基因在变铅青链霉菌TK24中的表达
张家瑚1,钟晶晶2,戴剑漉2,王以光2,夏焕章1,赫卫清2
1 沈阳药科大学生命科学与生物制药学院,辽宁 沈阳 110016
2 中国医学科学院/中国协和医科大学医药生物技术研究所 卫生部抗生素生物工程重点实验室,北京 100050
张家瑚, 钟晶晶, 戴剑漉, 等. 耐热链霉菌4″-O-异戊酰基转移酶基因在变铅青链霉菌TK24中的表达. 生物工程学报, 2014, 30(9): 1390–1400.
Zhang JH, Zhong JJ, Dai JL, et al. Expression of 4"-O-isovaleryltransferase gene from Streptomyces thermotolerans in Streptomyces lividans TK24. Chin J Biotech, 2014, 30(9): 1390–1400.
拟研究异源调控系统提高耐热链霉菌Streptomyces thermotolerans 4″-O-异戊酰基转移酶基因 (ist) 表达的可能性。在麦迪霉素产生菌Streptomyces mycarofaciens 1748中曾克隆到BamHⅠ~8.0 kb片段,含此基因片段的变铅青链霉菌TK24 Streptomyces lividans TK24转化子可将螺旋霉素高效转化为丙酰螺旋霉素。序列分析表明此片段除包含麦迪霉素4″-O-丙酰基转移酶基因 (mpt) 外还存在与其连锁的两个正调控基因orf27和orf28。将这个基因簇中mpt基因的orf替换为ist基因的orf,然后与两个正调控基因或者单独一个orf27连接,将这些构建好的片段分别克隆到中等拷贝数及高拷贝数载体pKC1139和pWHM3上,再转化到S. lividans TK24中。通过测定S. lividans TK24转化子中螺旋霉素生物转化为4″-O-酰化螺旋霉素的产率来评价mpt和ist基因的表达水平。结果表明只有高拷贝载体pWHM3构建的重组质粒S. lividans TK24转化子中才能明显检测到4″-O-异戊酰螺旋霉素的产生。mpt基因的正调节系统可以提高ist基因的表达水平,含两个调节基因的转化子转化效率高于含单一调节基因的转化子。
螺旋霉素,4″-O-酰基转移酶基因,正调控基因,异源表达
碳霉素、麦迪霉素、泰乐菌素和螺旋霉素均为结构十分相似的16元环大环内酯类抗生素(图1),除了碳霉素以外,它们均广泛应用于临床或畜牧业[1-4]。16元环大环内酯如螺旋霉素在胃肠道中的稳定性好,组织分布广,体内持续时间长,无其他大环内酯类抗生素所致的肝损害,对胃肠道的反应比14元环大环内酯类少[5]。对16元环大环内酯类抗生素构效关系的研究表明,碳霉糖4″位亲脂酰基基团对于分子向细胞的渗透有重要作用,而增加酰基碳链的长度可以提高其亲脂性,并提高其在体内的抗菌活性[6-7]。日本学者Okamoto先后利用碳霉素产生菌Streptomyces thermotolerans内酯环合成阻断变株或克隆4″-O-异戊酰基转移酶基因(4"-O-isovaleryltransferase gene, ist),转化或在泰乐菌素产生菌中表达均获得了4″-O-酰基化泰乐菌素[8-9]。本实验室在1994年从我国自主分离的麦迪霉素产生菌Streptomyces mycarofaciens1748中克隆了麦迪霉素4″-O-丙酰基转移酶基因(Midecamycin 4″-O-propionyltransferase gene, mpt),并在螺旋霉素产生菌Streptomyces spiramyceticus中表达,首次获得了基因工程技术制造的新抗生素丙酰螺旋霉素[10-11]。药效学研究证明其体内外活性均优于螺旋霉素[12]。继而克隆出S. thermotolerans中的ist基因,并在S. spiramyceticus中表达,获得了基因工程必特螺旋霉素 (现在的商品名为可利霉素)产生菌[13],研究证实螺旋霉素在4″位的异戊酰化更加增强其亲脂性,从而增加其组织浓度和体内抗菌活性[14],可利霉素已经完成Ⅲ期临床试验,目前已进入新药证书待批阶段。

图1 16元环大环内酯类抗生素Fig. 1 16 membered macrolide antibiotics.
在链霉菌的抗生素生物合成基因簇中常包含一个或多个途径特异性调控基因,它们一般调控一种抗生素或几种具有共同生物合成途径的抗生素的生物合成,这些途径特异性调控基因还受到其他调控基因的调控,通过改造这些调控基因可以提高抗生素的产量[15-17]。原来研究发现从S. mycarofaciens 1748中克隆的BamHⅠ ~8.0 kb片段含有mpt基因,而从S. thermotolerans中克隆的ist基因位于BamHⅠ~2.3 kb片段中,mpt基因与ist基因都是编码催化16元环大环内酯4″-O-酰基转移酶,二者在蛋白序列上有70%的一致性,但mpt在S. lividans TK24中的表达效果较好,推测在BamHⅠ~8.0 kb序列中存在mpt的正调控基因[10]。文中将分析S. mycarofaciens 1748中含mpt的BamHⅠ~8.0 kb片段的基因信息,并探索在S. lividans TK24中利用mpt的调控基因提高ist基因表达的可能性,为构建新的必特螺旋霉素基因工程菌奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种、基因和载体
S. lividans TK24为异源表达宿主,本实验室保存。大肠杆菌Escherichia coli DH5α感受态细胞,基因克隆和重组质粒构建受体菌,购自北京全式金生物技术有限公司。pKC1139温敏型链霉菌/大肠埃希菌穿梭载体,pWHM3链霉菌/大肠埃希菌穿梭高拷贝载体,pUC19重组质粒构建载体,本实验室保存。pSW4质粒携带有从S. thermotolerans 中克隆的含ist基因BamHⅠ~2.3 kb片段[13],本实验室构建。pWF5质粒含mpt基因的BamHⅠ~8.0 kb片段[10],本实验室构建。pKC-e-ist-ist质粒含链霉菌中组成型启动子PermE*和两个连锁的ist基因,本实验室构建[18]。
1.1.2 试剂
螺旋霉素购自河南天方药业股份有限公司,主要组分为螺旋霉素Ⅱ (SPⅡ) 和螺旋霉素Ⅲ(SP Ⅲ)。必特螺旋霉素对照品,本实验室自制,主要组分为4″-异戊酰螺旋霉素 (Ⅰ+Ⅱ+Ⅲ)。阿普拉霉素 (Apramycin, Am) 购自武汉远城科技发展有限公司。限制性内切酶、T4 DNA连接酶购自TaKaRa公司。KOD Taq DNA聚合酶购自北京天佑恒远生物科技有限公司。TLC硅胶板(GF254) 购自山东烟台吉德精化工有限公司。
1.1.3 培养基
MY固体培养基 (100 mL):酵母提取物0.4 g,麦芽提取物1.0 g,葡萄糖0.4 g,琼脂粉1.5 g;用于S. lividans TK24的固体培养。含有重组质粒的转化子培养在培养基中加入终浓度为50 μg/mL的Am。
R2YE培养基配方见文献[19],用于S. lividans TK24原生质体的制备和再生。
生物转化培养基 (100 mL):淀粉2.0 g,葡萄糖2.0 g,硫酸铵0.3 g,酵母粉0.5 g,黄豆饼粉1.0 g,磷酸二氢钾0.05 g,MgSO4·7H2O 0.02 g,碳酸钙0.5 g。
1.2 方法
1.2.1 分子克隆
PCR产物纯化,限制性酶切,DNA连接反应,转化和重组质粒筛选,按照文献[20]进行。将pWF5质粒上的BamHⅠ~8.0 kb片段亚克隆到pUC19载体,利用M13通用引物在中美泰和生物技术有限公司进行测序。
1.2.2 重组质粒的构建
利用SalⅠ酶切 (图2) pUC19重组质粒中BamHⅠ~8.0 kb外源片段,回收4.2 kb片段,此SalⅠ片段只包含orf27 (acyB2同源基因) 和mpt连锁基因,将其克隆至pUC19载体,再用BamHⅠ和Hind Ⅲ酶切,亚克隆至pKC1139或者pWHM3载体上获得重组质粒pKC-orf27-mpt或者pWH-orf27-mpt。
根据ist基因的核苷酸序列 (GenBank Accession No. D31821.1) 设计PCR引物 (表1)。上游引物为ist-F,在5'端加上mpt基因起始密码子上游相邻的50 bp碱基;下游引物为ist-R,在5'端加上mpt基因终止密码子下游相邻的50 bp碱基。以pSW4质粒为模板,通过PCR得到包含mpt基因orf上下游各50 bp序列的ist基因片段,在重叠PCR中当作其中一个模板 (图3)。以pUC19-8.0 kb质粒为DNA模板,利用orf27上下游基因序列引物mpt-LF和mpt-LR扩增出1.6 kb的PCR产物 (mpt-L),包含orf27基因和mpt基因起始密码子之前序列。利用mpt基因下游引物mpt-RF和mpt-RR扩增出250 bp的PCR产物 (mpt-R),包含了mpt基因的下游终止区序列。再以mpt-L片段、mpt-R片段和带有50 bp同源臂的ist-orf为模板,用mpt-LF和mpt-RR为引物,利用重叠PCR反应得到3.0 kb产物,这样就将mpt基因的orf替换为ist基因的orf,并直接使ist基因位于orf27基因的下游。将PCR产物克隆至pUC19载体,测序验证后,再分别亚克隆到pKC1139和pWHM3载体上得到重组质粒pKC-orf27-ist和pWH-orf27-ist。
用ScaⅠ酶切BamHⅠ~8.0 kb外源片段 (图2),回收3.9 kb片段,此片段包含orf28基因和部分orf27序列,将orf27-ist外源片段也用ScaⅠ酶切,回收2.0 kb片段,连接3.9 kb和2.0 kb片段得到orf28-orf27-ist连锁基因,将此片段通过BamHⅠ和Hind Ⅲ位点连接到pKC1139和pWHM3载体上获得重组质粒pKC-orf28-orf27-ist和pWH-orf28-orf27-ist。
本实验室原来构建的pKC-e-ist-ist质粒带有PermE*启动子和两个连锁的ist基因,利用EcoRⅠ和XbaⅠ酶切可以获得PermE*启动子和一个ist基因,将此片段亚克隆到pWHM3载体的相同位点得到质粒pWH-PermE*-ist,此质粒作为ist基因表达的阳性对照。
1.2.3 S. lividans TK24原生质体制备和转化具体操作按文献[19]进行。
1.2.4 生物转化产物检测
S. lividans TK24转化子在含Am (50 μg/mL)的MY平板上28 ℃培养6–8 d,挖块至生物转化培养基 (50 mL生物转化培养基/500 mL三角瓶),每种转化子各接3瓶,28 ℃振荡 (200 r/min)培养48 h,加入螺旋霉素至终浓度50 μg/mL,继续培养48 h,离心取10 mL上清液,用NaOH (1.0 mol/L)调至pH 8.5–9.0,等体积乙酸乙酯萃取,萃取液等分两份,室温吹干。一份溶于100 μL乙酸乙酯,用于TLC检测,展开剂为乙酸乙酯:环己烷:丙酮:氨水=5∶5∶1∶0.1 (V/V);碘熏显迹;另一份溶于300 μL甲醇,取4 μL进行HPLC检测 (日本岛津高效液相色谱仪,LC-10ATvp CLASS-VP V6.10),色谱柱为Kromasil C18 4.6 mm×150 mm,流动相为乙腈/10 mmol/L乙酸铵溶液 (50/50),流速为1 mL/min,检测波长231 nm。LC-MS (美国Thermo公司LTQ型液相色谱-质谱联用仪) 检测在本所仪器室进行,质谱条件:ESI源;正离子检测;鞘气 (N2) 流速0. 3 L/min;辅助气 (He)流速0.1 L/min;源电压4. 5 kV;毛细管温度350 ℃;毛细管电压4.5 V。

表1 本文所用的引物Table 1 Primers used in this study

图2 调控基因在3种大环内脂类抗生素生物合成基因簇中的位置Fig. 2 Organization of regulatory genes in biosynthetic gene clusters of three macrolide producers.
2 结果
2.1 S. myc arofaciens 1748克隆的BamHⅠ~8.0 kb片段测序结果与生物信息学分析
BamHⅠ~8.0 kb片段实际测序结果为8.9 kb,与Mido等[22]报道S. mycarofaciens中麦迪霉素生物合成基因簇 (GenBank Accession No. BD420675) 完全一致,位于其14 616 bp至23 507 bp之间,通过生物信息学分析其中包含orf28到orf23共6个基因,orf23是不完整的基因片段 (图2)。从S. mycarofaciens 1748克隆的BamHⅠ8.9 kb片段中orf26是mpt基因,与之连锁的是两个调控基因orf27和orf28。orf25、orf24和orf23是与糖基合成相关基因,分别为dTDP-4-酮-6-脱氧葡萄糖-2,3-脱水酶基因、Ⅱ型硫酯酶基因和dTDP-葡萄糖-4,6-脱水酶基因。BlastP分析显示S. mycarofaciens的Orf27与生二素链霉菌Streptomyces ambofaciens中Srm40在蛋白水平的同源性为68%,与S. thermotolerans中的AcyB2的同源性为70%。Orf28与S. ambofaciens中的SrmR的同源性为68%,在S. thermotolerans中至今尚无类似蛋白的报道。srm40和srmR均为螺旋霉素生物合成的正调控基因,并且这两个基因的转录处于级联反应系统,SrmR正调控srm40的转录,后者再激活螺旋霉素生物合成基因的转录[21,23]。推测orf27和orf28在麦迪霉素生物合成中起类似调控作用。但是orf27和orf28与4″-O-酰基转移酶基因orf26 (mpt) 是连锁的,而在S. ambofaciens中srmR和srm40是不连锁的,相隔约22 kb (图2)。类似的两个调控基因还存在于其他大环内酯类抗生素安哥拉霉素(GenBank Accession No. EU232693) 和蔷薇霉素生物合成基因簇[24]。

图3 重组质粒的构建Fig. 3 Construction of the recombinant plasmids. → primer; a: mpt-LF; b: mpt-LR; c: mpt-RF; d: mpt-RR.
2.2 重组质粒的异源表达和生物转化
将按方法1.2.2构建的重组质粒通过原生质体转化法导入到S. lividans TK24中,经Am抗性筛选获得包含相应重组质粒的TK24转化子:TK24 (pKC-orf27-mpt) 和TK24 (pWH-orf27-mpt)、TK24 (pKC-orf28-orf27-mpt) 和TK24 (pWH-orf28-orf27-mpt)、TK24 (pKC-orf27-ist) 和TK24 (pWH-orf27-ist)、TK24 (pKC-orf28-orf27-ist) 和TK24 (pWH-orf28-orf27-ist)。这些阳性转化子经PCR方法确证后,再进行生物转化螺旋霉素的检测。TLC检测表明,以pKC1139为载体构建的4种重组质粒的转化子,没有发现Rf值类似于4″-O-异戊酰螺旋霉素的产物。而以pWHM3为载体构建的4种重组质粒的转化子,在其产物中都检测到Rf值类似于4″-O-异戊酰螺旋霉素的产物 (图4,泳道5–8所示)。
为了评价ist基因的表达情况,又构建了TK24 (pWH-PermE*-ist) 转化子作为ist基因表达的阳性对照,通过HPLC检测TK24 (pWH-PermE*-ist) 和其他转化子中酰化螺旋霉素的峰面积,根据峰面积的大小估算ist基因的表达情况,每种转化子重复3次取平均值,利用LC-MS测定典型生物转化产物的分子量和碎片峰,以确定其酰化产物,结果见图5和表2。
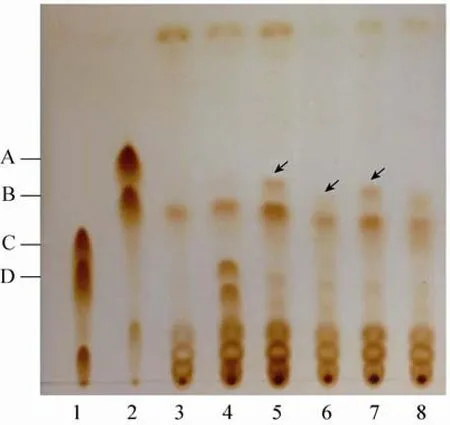
图4 TLC检测生物转化螺旋霉素的产物Fig. 4 Detection of bio-transformation products of spiramycin by TLC. 1: spiramycin; 2: bitespiramycin; 3: TK24 (pWHM3); 4: TK24 (pWHM3) with addition of spiramyicn, as a control; 5: TK24 (pWH-orf27-ist); 6: TK24 (pWH-orf27-mpt); 7: TK24 (pWH-orf28-orf27-ist); 8: TK24 (pWH-orf28-orf27-mpt). A: 4"-O- isovalerylspiramycin ; ⅢB: 4"-O-isovalerylspiramycin;Ⅱ C: spiramycin ; D: Ⅲspiramycin.ⅡThe product with Rf value similar to 4"-O-isovalerylspiramycin.

图5 HPLC检测生物转化螺旋霉素的产物Fig. 5 Detection of bio-transformation products of spiramycin by HPLC. (A) Bitespiramycin. (B) Spiramycin. (C) TK24 (pWHM3). (D) TK24 (pWH-PermE*-ist). (E) TK24 (pWH-orf27-mpt). (F) TK24 (pWH-orf28-orf27-mpt). (G) TK24 (pWH-orf27-ist). (H) TK24 (pWH-orf28-orf27-ist). 1: 4″-O-propionylspiramycin Ⅲ; 2: 4″-O-isobutyrylspiramycinⅡ; 3: 4″-O-isovalerylspiramycinⅠ; 4: 4″-O-isobutyrylspiramycin Ⅲ; 5: 4″-O-isovalerylspiramycinⅡ; 6: 4″-O-isovalerylspiramycin Ⅲ; 7: spiramycin Ⅰ; 8: spiramycin Ⅱ; 9: spiramycinⅢ.

表2 5种转化子中4″-O-酰化螺旋霉素的HPLC峰面积Table 2 HPLC peak area of 4″-O-acylated spiramycins in the 5 transformants
以必特螺旋霉素标准品为对照,5种转化子中的4″-O-酰化螺旋霉素都进行了HPLC、LC-MS及其各自碎片峰的鉴定。产物1为4″-O-丙酰螺旋霉素Ⅲ,分子量为955.62,产物2为4″-O-异丁酰螺旋霉素Ⅱ,分子量和产物1一致为955.69,但二者的碎片峰不一样,丙酰螺旋霉素Ⅲ的碎片峰为755.50、596.53和355.20,而异丁酰螺旋霉素Ⅱ的碎片峰为741.50、582.38和388.27。产物3、5和6分别是4″-O-异戊酰化螺旋霉素Ⅰ、Ⅱ和Ⅲ,分子量分别为927.61、969.74和983.65。产物4是4″-O-异丁酰螺旋霉素Ⅲ,分子量为969.65,和产物5一致,但二者碎片峰有区别。与TK24 (pWH-PermE*-ist)相同,TK24 (pWH-orf27-ist)以及TK24 (pWH-orf28-orf27-ist) (图5 G、H) 均可以将螺旋霉素转化为4″-O-异戊酰化螺旋霉素Ⅰ、Ⅱ和Ⅲ,也有少量丙酰和丁酰化的产物,而含两个正调控基因的TK24 (pWH-orf28-orf27-ist) 比含单一调控基因的TK24 (pWH-orf27-ist) 转化效率要高,总的4″-O-酰化螺旋霉素峰面积大于含单一调控基因的转化子,其转化效率与TK24 (pWH-PermE*-ist)相当。同样,含两个正调控基因的TK24 (pWH-orf28-orf27-mpt) 转化效率也明显高于TK24 (pWH-orf27-mpt) (图5E、F)。
3 讨论
在研制必特螺旋霉素时,将来自S. thermotolerans中的ist基因 (ist-BamHⅠ2.3 kb片段,图2所示) 导入到S. spiramyceticus中,可以很容易检测到4″-O-异戊酰螺旋霉素的产生,但将该片段通过pKC1139或pSET152等载体导入到S. lividans TK24中,其转化子中却很难检测到4″位酰化的螺旋霉素。在ist基因前面加上强启动子PermE* 后才在S. lividans TK24中检测到螺旋霉素的4″-O-异戊酰化的产物[18]。本研究表明,利用S. mycarofaciens1748中的正调控基因orf27和orf 28可以实现异源ist基因在S. lividans TK24中的表达,其转化效率与组成型启动子调控下的ist基因相当。而且无论是mpt基因还是ist基因在两个调控基因存在时比在单个调控基因的情况下表达效率高。mpt和ist基因产物对底物有较大的宽容性,都能催化丙酰基、丁酰基和异戊酰基对螺旋霉素4″位进行酰化,只是Mpt倾向使用短链的丙酰或丁酰,而Ist更偏好长链的异戊酰基。在本研究中采用mpt基因的orf替换为ist基因的orf,即利用mpt启动子对ist的异源表达进行了初步研究。只有在RNA和蛋白表达水平深入研究不同调控蛋白对ist基因转录调控的影响,才能真正了解ist在异源宿主菌中的调控和表达情况。
李佳等[25]在测定一些强启动子,如PermE*或者Psf在不同链霉菌中表达活性时,发现S. lividans与天蓝色链霉菌Streptomycescoelicolor和委内瑞拉链霉菌Streptomyces venezuelae相比,S. lividans的表达活性最低,所以在变铅青链霉菌中外源基因的表达量是偏低的。我们也发现ist基因在S. lividans TK24宿主中即使在正调控基因acyB2存在的条件下,其表达量也偏低,因此,采用不同拷贝数的质粒载体明显影响其表达效率。用复制子为pSG5型pKC1139载体构建的重组载体,拷贝数在链霉菌中一般是20–50个之间,但在S. lividans TK24转化子的产物中也只能检测到微量螺旋霉素的4″酰化产物。而采用高拷贝pWHM3载体构建重组质粒,其复制子是pIJ型,拷贝数40–300个,其转化效率明显提高。因此,可以看出ist基因在S. lividans TK24中的表达量比较低,下一步准备将这些重组质粒导入到螺旋霉素产生菌中,检测这些转化子中ist基因的表达情况,为构建新型高产的必特螺旋霉素产生菌奠定基础。
REFERENCES
[1] Bunnag C, Jareoncharsri P, Voraprayoon S, et al. Efficacy of spiramycin as an alternative to amoxicillin in the treatment of acute upper respiratory tract infections. Clin Drug Investig, 1998, 15(6): 461–466.
[2] Paquet C, Yudin MH. Toxoplasmosis in pregnancy: prevention, screening, and treatment. J Obstet Gynaecol Can, 2013, 35(1): 78–79.
[3] Mazzariol A, Koncan R, Vitali LA, et al. Activities of 16-membered ring macrolides and telithromycin against different genotypes of erythromycin-susceptible and erythromycinresistant Streptococcus pyogenes and Streptococcus pneumoniae. J Antimicrob Chemother, 2007, 59(6): 1171–1176.
[4] Corns SM, Ashlock DA, Bryden KM. Development of antibiotic regimens using graph based evolutionary algorithms. Biosystems, 2013, 114(3): 178–185.
[5] Rubinstein E, Kellern N. Spiramycin renaissance. J Antimicrob Chemother, 1998, 42: 572–576.
[6] Omura S, Sano H, Sunazuka T. Structure activity relationships of spiramycins. J Antimicrob Chemother, 1985, 16(Suppl A): 1–11.
[7] Sano M, Sunazuka T, Tanaka H, et al. Chemical modification of spiramycins VI. Synthesis and antibacterial activities of 3,3″-di-O-acyl-4″-O-sulfonyl and 3,3″-di-O-acyl-4″-O-alkyl derivatives of spiramycin I. J antibiot (Tokyo), 1985, 38: 1350–1358.
[8] Arisawa A, Kawamura N, Tsunekawa H, et al. Cloning and nucleotide sequences of two genes involved in the 4″-O-acylation of macrolide antibiotics from Streptomyces thermotolerans. Biosci Biotechnol Biochem, 1993, 57(12): 2020–2025.
[9] Arisawa A, Kawamura N, Narita T, et al. Direct fermentative production of acyltylosins by genetically-engineered strains of Streptomyces fradiae. J Antibiot (Tokyo), 1996, 49(4): 349–354.
[10] Wang YG, Jin LF, Xu XM, et al. A genetically engineered hybrid antibiotic propionyl spiramycin. Chin J Antibiot, 1994(2): 109–116 (in Chinese).王以光, 金莲舫, 徐小敏,等. 基因工程丙酰螺旋霉素. 中国抗生素杂志, 1994(2): 109–116.
[11] Zhang XL, Wang YG. Stydies on midecamycin 4″-O-propionyltransferase gene structure. Acta Microbiol Sin, 1996, 36(6): 417–422 (in Chinese).张叙伦, 王以光. 麦迪霉素4″-O-丙酰基转移酶(mpt) 基因结构的研究. 微生物学报, 1996, 36(6): 417–422.
[12] Chen HZ, Zhang WX, Lou RH, et al. Pharmacological study on propionylspiramycin. Chin J New Drags, 1992, 1(1): 11–15 (in Chinese).陈慧贞, 张伟新, 娄人慧, 等. 丙酰螺旋霉素的药理研究. 中国新药杂志, 1992, 1(1): 11–15.
[13] Shang GD, Dai JL, Wang YG. Construction of a stable bioengineered strain of Biotechmycin. Chin J Biotech, 1999, 15(2): 171–175 (in Chinese).尚广东, 戴剑漉, 王以光. 生技霉素稳定型基因工程菌的构建. 生物工程学报,1999, 15(2): 171–175.
[14] Shi XG, Sun YM, Zhang YF, et al. Tissue distribution of bitespiramycin and spiramycin in rats. Acta Pharmacol Sin, 2004, 25(11): 1396–1401.
[15] Gilles PW, Kenneth JM. The regulation of the secondary metabolism of Streptomyces: new links and experimental advances. Nat Prod Rep, 2011, 28: 1311–1333.
[16] Aigle B, Corre C. Waking up Streptomyces secondary metabolism by constitutive expression of activators or genetic disruption of repressors. Methods Enzymol, 2012, 517: 343–366.
[17] Martín JF, Liras P. Engineering of regulatory cascades and networks controlling antibiotic biosynthesis in Streptomyces. Curr Opin Microbiol, 2010, 13(3): 263–273.
[18] Yang YH, He WQ, Li RF, et al. Incorporation of PermE*, a strong promoter, at 5'-upstream of 4″-isovaleryltransferase gene improves the bioconversion of spiramycin to 4″-isovaleryspiramycin in Streptomyces lividans TK24. Chin J Antibiot, 2010, 35(11): 826–830 (in Chinese).杨永红, 赫卫清, 李瑞芬, 等. 利用强启动子PermE*提高4″-异戊酰基转移酶基因在变铅青链霉菌TK24中对螺旋霉素的4″-异戊酰化水平.中国抗生素杂志, 2010, 35(11): 826–830.
[19] Tobias K, Bibb MJ, Mark JB. Practical Streptomyces Genetics. Norwich: The John Innes Foundation, 2000: 232–236.
[20] Sambrook J, Fritsh EF, Maniatis T. Molecular cloning: A Laboratory Manual. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989: 20–25.
[21] Fatma K, Emmanuelle D, Nathalie O, et al. Organization of the biosynthetic gene cluster for the macrolide antibiotic spiramycin in Streptomyces ambofaciens. Microbiology, 2007, 153: 4111–4122.
[22] Mido N, Hoshigo S, Murakami T. Medicamycin biosynthetic gene cluster: JP 2004049100-A/1. 2004-02-19.
[23] Karray F, Darbon E, Nguyen HC, et al. Regulation of the biosynthesis of the macrolide antibiotic spiramycin in Streptomyces ambofaciens. J Bacteriol, 2010, 192(21): 5813–5821.
[24] Farnet CM, Staffa A, Yang XS. Genes and proteins for the biosynthesis of rosaramicin: US 2003/0113874 A1. 2003-06-19.
[25] Li J, Xiang SH, Yang XS, et al. Evaluation of the activities of two promoters in Streptomycetes by reporter gene method. Acta Microbiol Sin, 2009, 49(11): 1454–1458 (in Chinese).李佳, 向四海, 杨秀山, 等. 报告基因法比较两种放线菌启动子的活性. 微生物学报, 2009, 49(11): 1454–1458.
(本文责编 郝丽芳)
Expression of 4″-O-isovaleryltransferase gene from Streptomyces thermotolerans in Streptomyces lividans TK24
Jiahu Zhang1, Jingjing Zhong2, Jianlu Dai2, Yiguang Wang2, Huanzhang Xia1, and Weiqing He2
1 College of Life Science and Biopharmaceuticals, Shenyang Pharmaceutical University, Shenyang 110016, Liaoning, China 2 Key Lab of Antibiotic Biotechnology, Minister of Health, Institute of Medicinal Biotechnology Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
4″-O-isovaleryltransferase gene (ist) was regulated by positive regulatory genes of midecamycin 4″-O-propionyltransferase gene (mpt) in Streptomyces lividans TK24. A BamHⅠ~8.0 kb fragment from Streptomyces mycarofaciens 1748 was proved that it contained mpt gene and linked with two positive regulatory genes, orf27 and orf28. Orf of mpt was replaced by orf of ist and linked with two regulatory genes or orf27 single, and individually cloned into the vectors pKC1139 or pWHM3 (high copy number), and then transformed into S. lividans TK24. The levels of mpt and ist expression were evaluated by the bio-tramsformation efficacy of spiramycin into 4″-O-acylspiramycins in these transformants. The results showed that 4"-O-isovalerylspiramycins could be detected only in the transformants containing the plasmids constructed with pWHM3. The efficacy of bio-transformation of the transformants containing two regulatory genes was higher than that of orf27 single. So, the positive regulatory genes system of mpt gene could enhance ist gene expression.
spiramycin, 4"-O-acyltransferase gene, positive regulatory gene, heterologous expression
November 19, 2013; Accepted: February 28, 2014
Weiqing He. Tel: +86-10-83157099; Fax: +86-10-60638137; E-mail: weiqing_he@hotmail.com;
Supported by: National Natural Science Foundation of China (No. 81172972), the Fundamental Research Funds for the Central Universities (No. 2012N09).
Huanzhang Xia. E-mail: xiahz612@sina.com
国家自然科学基金 (No. 81172972), 中央高校基本科研业务费专项资金 (No. 2012N09) 资助。

